左归丸改善自然衰老大鼠学习能力的中枢神经线粒体机制
赵新永 李晓婷 周飞
(1郑州工业应用技术学院医学院,河南 郑州 451150;2复旦大学附属浦东医院)
左归丸为经典补肾古方,出自明代张景岳的《景岳全书·新方八阵》。该方在临床上不仅应用于治疗老年性骨质疏松,而且也被广泛用于治疗肾虚型老年性记忆衰退。研究发现,左归丸确实具有延缓机体神经内分泌退行性变化及补肾健脑的功效〔1〕。衰老性记忆下降主要是因为随着年龄的增长,大脑中枢神经细胞的功能逐渐减退所造成。而大脑中枢神经细胞的功能减退又和线粒体的功能正常与否密切相关。大脑消耗了人体20%的氧气,而输送大脑的葡萄糖中99%都是用于提供能量〔2,3〕,而这些能量的产生绝大部分是由线粒体的有氧代谢来提供。在衰老的大脑中,几乎都伴随线粒体的功能障碍〔4〕。而且如果改善线粒体的功能,就能改变细胞活性,进而改善衰老大脑的功能〔5〕。前期研究中,在离体培养的海马细胞上也发现左归丸可能增强海马神经细胞的活性,但并未对其机制进一步探讨〔6〕。而目前对左归丸改善衰老性记忆减退,多集中在记忆有关的分子信号转导方面〔7~9〕。但左归丸能否作用于中枢神经线粒体及作用如何,并没有明确的研究报道。本研究拟观察补肾方药左归丸对衰老大鼠线粒体能量代谢的作用及可能的机制变化,进一步探索左归丸延缓衰老和改善学习记忆的作用机制。
1 材料与方法
1.1 动物 SPF级雄性SD大鼠40只,体重180~250 g,24月龄,合格证号SCXK(沪) 2016-0001,由上海中医药大学实验动物中心提供。饲养环境为温度(24±2)℃,相对湿度(50±10)%,大鼠维持自由饮食、饮水。
1.2 药物及试剂 方药组成参见文献〔6〕。 各中药饮片购自上海华宇中药饮片有限公司。制备方法为常规水煎液制成浸膏,左归丸药液含生药量为1.60 g/ml。单磷酸腺苷(AMP)钠,二磷酸腺苷(ADP)钠盐,三磷酸腺苷(ATP) 二钠盐对照品(美国Sigma-Aldrich公司);JC-1线粒体膜电位检测试剂盒(碧云天生物技术研究所);丙酮酸脱氢酶(PDH)及α-酮戊二酸脱氢酶(KGDH) 活性检测试剂盒(美国Sigma-Aldrich公司);辣根过氧化物酶(HPR)标记的山羊抗兔单抗及HPR山羊抗小鼠单抗(美国Santa Cruz公司);过氧化物酶体增殖物活化受体γ协同刺激因子(PGC)-1α一抗抗体(美国Bio Vision公司);β-肌动蛋白(actin) 抗体;聚偏氟乙烯(PVDF)膜和显影液(美国Millipore公司) 。
1.3 仪器 Morris水迷宫及分析软件分别为中国科学院神经研究所的DMS-2型和上海吉量软件科技有限公司的DigBehv-MG 型分析软件。低温超速离心机(日本Hitachi公司CP100WX型),高效液相色谱仪(美国Waters公司2695型),紫外分光光度计(美国Amersham Biosciences公司),PowerPacTMHC 型蛋白电泳仪,Mini Protean 3 Cell 型电泳槽、转移槽,biorad ChemiDoc MP 型凝胶成像分析系统,全波长酶标仪(美国Bio Tex公司) 。
1.4 动物分组及给药 随机分为对照组和左归丸组,每组20只。灌胃给药,按照人临床日用药量15 g浸膏折算大鼠给药量,左归丸给药剂量为12.12 g/kg,对照组灌服等体积生理盐水,1次/d,连续灌胃60 d。
1.5 Morris水迷宫法测试空间学习记忆能力 给药60 d后,进行Morris水迷宫实验,期间继续给药。每天从两个方向开始训练大鼠,2次/d,连续5 d。设定水中的游动时间最长为70 s,计算机自动记录大鼠的潜伏期。如未在最长时间内找到目标,则潜伏期为最长时间,将其引至平台上停留20 s。记录每组的潜伏期,计算其平均值并进行统计学分析。
1.6 脑组织AMP、ADP、ATP含量及能荷(EC) 测定 Morris水迷宫试验后,取脑置于玻璃匀浆器中,加入生理盐水在冰浴下制成20%脑匀浆液,加4%高氯酸0.5 ml混匀,4℃条件下12 000 r/min离心20 min,取0.5 ml上清液加20%氢氧化钾(KOH)80 μl,用高效液相色谱法(HPLC)测定AMP、ADP、ATP的含量。EC=(ATP+0.5ADP) /(ATP+ADP+AMP)。
1.7 PDH和KGDH活性检测 按照相关试剂盒说明书,在600 nm下测定吸光度A变化来计算PDH和KGDH活性。
1.8 脑组织线粒体膜电位测定 具体操作步骤参照试剂盒说明书进行荧光法测定。首先分离脑组织线粒体,用磷酸盐缓冲液(PBS)溶解,再加入7.5倍的PBS混匀,然后取1.5 ml离心,弃去上清,再加入染色液1.25 ml染色3 min,染色时要注意避光和保温,37℃下进行。590 nm和530 nm处测定,计算A590/A530比值。
1.9 Western印迹测定PGC-1α蛋白水平 大鼠测试结束后水合氯醛麻醉。取一定量脑组织,加入4℃放射免疫沉淀(RIPA)裂解液900 μl(含有100 nmol/L蛋白酶抑制剂),0℃匀浆,13 000 r/min离心15 min,取上清液。双缩脲法定量蛋白。10%聚丙烯酰胺凝胶电泳,每孔上样量为50 μg蛋白。电压100 V、15 min,120 V恒压、90 min。转膜:湿转,200 mA恒流。洗PVDF膜3次,5 min/次,封闭液封闭1.5 h。分别加一抗PGC-1α和内参β-actin,稀释比例参照抗体说明书,4℃避光孵育过夜。洗膜,加入抗兔HRP(稀释比例为1∶5 000),室温避光,与二抗稀释液孵育1.5 h。加发光剂曝光,压片显影。胶片进行灰度扫描计算PGC-12/α-actin比值。
1.10 统计学方法 应用SPSS19.0软件进行单因素方差分析及重复测量方差分析。
2 结 果
2.1 两组潜伏期比较 训练前3 d,两组潜伏期逐渐缩短,但差异无统计学意义(P>0.05),两组第4、5天差异有统计学意义(P<0.05,P<0.01)。且左归丸组穿越平台次数〔(19.00±2.20)次〕显著多于对照组〔(6.67±1.63)次,P<0.01〕。见表1。
2.2 两组脑组织AMP、ADP、ATP含量及EC值比较 与对照组比较,左归丸组脑内AMP含量降低,ADP含量升高,但差异无统计学意义(P>0.05);而ATP含量和EC值明显升高(P<0.05,P<0.01) 。见表2。
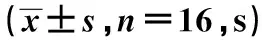
表1 两组潜伏期比较
与对照组比较:1)P<0.05,2)P<0.01;下表同
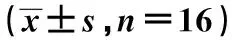
表2 两组AMP、ADP、ATP含量及EC值比较
2.3 两组脑组织PDH和KGDH活性比较 左归丸组脑组织PDH和KGDH活性〔(62.15±4.56)、(20.13±1.78)nmol/(min·mg)〕显著高于对照组〔(40.23±3.56)、(16.67±1.46)nmol/(min·mg),P<0.01〕。
2.4 两组脑组织线粒体膜电位比较 与对照组(2.92±0.42)比较,左归丸组(6.26±0.38)可明显提高线粒体膜电位(P<0.01) 。
2.5 两组脑组织PGC-1α通路蛋白表达比较 相较于对照组(0.422±0.122),左归丸组PGC-1α表达(0.853±0.131)显著增加(P<0.01),见图1。
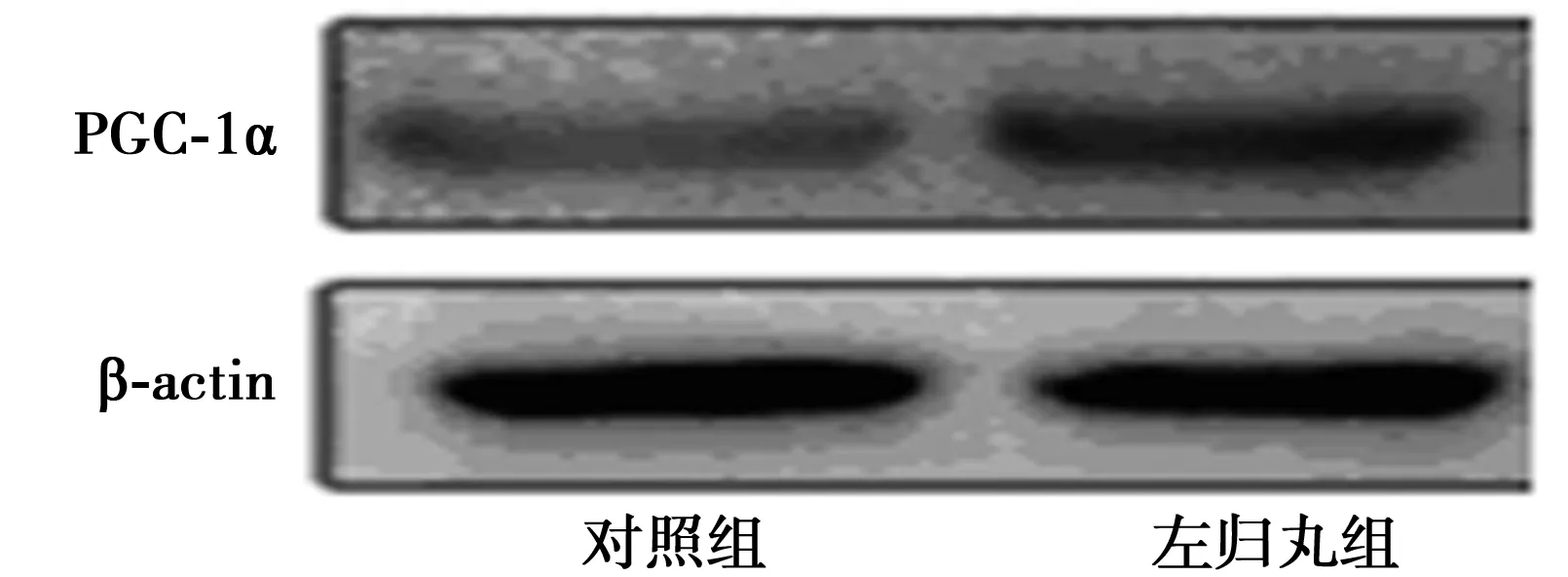
图1 左归丸对自然衰老大鼠脑组织PGC-1α蛋白表达的影响
3 讨 论
本研究发现,给予左归丸治疗衰老大鼠的空间学习记忆能力显著提高,和以往研究结果一致,说明左归丸确实能够改善和延缓自然衰老所导致的学习功能减退〔8,9〕。研究表明,随着衰老,大脑中枢的能量代谢水平显著下降,且认知也随着下降,而能量下降的原因是线粒体的损害和功能障碍,其主要表现是ATP生成下降,膜电位改变及EC显著降低〔10〕。而本研究结果显示,左归丸能够明显增加自然衰老大鼠脑内ATP的产生及EC水平,有效改善自然衰老大鼠中枢神经细胞的能量代谢。
ATP的产生主要和线粒体内的三羧酸循环代谢通路和线粒体膜的完整密切有关。在衰老人群和衰老动物中,该循环和线粒体膜都出现不同的损害。在三羧酸循环中,几乎所有的代谢关键酶都出现了不同程度的下降,其中PDH和KGDH活力的下降特别显著〔11〕。线粒体膜电位决定了电子链正常传递及氧化磷酸的正常进行。而左归丸能够改善线粒体膜的正常电位,从而提高ATP的产生,保证了神经细胞的正常能量需要。
Carelli等〔12〕发现,在衰老细胞内,线粒体的老化和功能障碍主要是因为线粒体动力代谢下降所致,特别是增生分裂下降,不能提供新生线粒体。而PGC-1α是促进线粒体增生和更新的重要调控蛋白,可以激活下游一系列其他蛋白转录因子如核呼吸因子(NRF)1和NRF2、线粒体转录因子(TFAM)〔13,14〕,这些蛋白会促使新的线粒体增生,替代老化的或受损的线粒体,保持线粒体的功能正常。在衰老的机体内,通常发现PGC-1α蛋白表达降低,导致线粒体更新速率减慢,从而影响能量代谢〔15〕。本实验发现,左归丸可以显著促进PGC-1α蛋白表达,从而促进线粒体的增生和更新。本研究结果提示,左归丸可能通过促进线粒体的及时更新而改善线粒体功能。所以,左归丸对大脑中枢神经的线粒体功能的改善和提高也可能是提高衰老性记忆的机制之一,而且因为改善了中枢神经细胞的能量代谢,从而延缓其衰老,更符合中医补精生髓的内涵。

