芡实超微粉的小鼠体内延缓衰老功效
朱煜冬 张汆 戚良号 袁怀波
(1合肥工业大学食品科学与工程学院,安徽 合肥 230009;2滁州学院生物与食品工程学院;3淮南湖鑫水产养殖有限公司)
芡实是睡莲科1年生水生草本植物芡的种子成熟种仁〔1〕。分布于我国中南、西南、华东、东北等地及东南亚、俄罗斯、日本、印度和朝鲜半岛〔2,3〕,于秋末冬初采收成熟果实〔4〕。芡实中碳水化合物含量为72.1%~77.6%,含有0.99%的粗纤维,是较好的能量和膳食纤维的食物来源〔2〕。芡实具有养血安神、去湿健脾、益肾固精等功效,对慢性腹泻、白带崩下、小便失禁等症有治疗作用〔5〕。近年来研究发现,芡实种仁和种皮中含有黄酮、脑苷脂、多酚类等物质。这些化合物通常被认为具有抗氧化活性〔6〕。
生物个体生长发育到一定阶段后,体内组织器官就会发生退行性变化,即衰老〔7〕。关于衰老机制的研究及寻找高效的抗衰老药物已成为当前医学生物学领域中的热点问题,并在很多方面取得了长远的进步〔8,9〕。但由于许多合成抗氧化剂存在一定毒性和潜在危害,开发和使用天然和安全的抗氧化剂是必要的〔10〕。许多药用植物被认为具有很好的抗氧化潜力〔11〕。研究表明,芡实的种子和种皮的提取物具有抗氧化作用〔12〕。本文通过建立D-半乳糖衰老模型小鼠,研究芡实超微粉在小鼠体内的延缓衰老作用。
1 材料与方法
1.1 材料与仪器 芡实:淮南湖鑫水产养殖有限公司;昆明种雄性小鼠,体重(20±2)g,SPF级,批准号:Scxk(苏)2011-0003,购于常州卡文斯实验动物有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、一氧化氮(NO)、总抗氧化能力(T-AOC)测定试剂盒:南京建成生物工程研究所;小鼠端粒酶酶联免疫吸附试验(ELISA)分析试剂盒:苏州卡尔文生物科技有限公司;D-半乳糖、生理盐水、维生素(V)E、无水乙醇等其他试剂均为国产分析纯。
SL-150型高速多功能粉碎机:浙江省永康市松青五金厂;HH-2数显恒温水浴锅:国华电器有限公司;SC-3614低速离心机:安徽中科佳学仪器有限公司;752紫外可见分光度计:上海光谱仪器有限公司;TGL-16B离心机:上海安亭科学仪器厂;JA1003电子天平:上海良平仪器仪表有限公司;Multiskan Go 1510酶标仪:Thermo Fisher Scientific公司。
1.2 芡实制剂的制备 芡实种子及外壳经超微粉碎后,过200目筛备用。每次灌胃前将芡实粉冲入生理盐水配置成悬浊液制剂,浓度为50 mg/ml;VE悬浊液制备同上,浓度为10 mg/ml。
1.3 衰老模型建立及灌胃处理方案 60只小鼠适应性饲养1 w后,随机分为正常组、衰老模型组、VE组、芡实高、中、低剂量组,每组10只,均用普通饲料喂养。模型组、VE 组和芡实高、中、低剂量组每天腹腔注射5% D-半乳糖,剂量为200 mg/kg,正常组注射等量生理盐水。同时,芡实高、中、低剂量组每天分别灌胃1 200、600、300 mg/kg芡实,VE组每天灌胃100 mg/kg VE;正常组和模型组灌胃等量生理盐水〔13〕。连续6 w。观察小鼠生长状况,每周测定一次体重。
1.4 小鼠血清、内脏采集和脏器指数计算 灌胃6 w后,禁食12 h,称重。采集血样,4 000 r/min离心10 min,收集血清,-20℃冷冻保存。取血完成后颈椎脱臼处死,无菌摘取小鼠的脑、肝脏和脾脏,生理盐水洗净后用滤纸吸干称重,计算脏器指数〔7,13〕。称量脏器重量后整体贮存于-80℃冰箱中待用〔14〕。
1.5 组织匀浆制备及各项生化指标测定 取组织块按1∶9(m/V)的比例加入冷生理盐水,用玻璃匀浆器冰浴研磨制备10%组织匀浆〔15〕。3 000 r/min离心10 min,取上清液。根据不同的实验需要,稀释成5.0%、1.0%、0.5%不同浓度后进行测定。分别测定小鼠血清、肝脏、脑组织中SOD、NO、MDA、GSH-Px、T-AOC及端粒酶水平,操作步骤和分析过程均按照试剂盒说明书进行。
1.6 统计学分析 采用SPSS21.0软件进行t检验及方差分析。
2 结 果
2.1 各组脏器指数比较 各组肝脏指数差异无统计学意义(P>0.05);衰老模型组脾脏指数高于正常组,脑指数低于正常组,但差异无统计学意义(P>0.05);与衰老模型组相比,VE组、芡实低、中、高剂量组脑指数明显上升(P<0.05)。见表1。

表1 各组脏器指数比较(n=10,%)
与正常组比较:1)P<0.05;与衰老模型组比较:2)P<0.05
2.2 各组血清及组织中SOD活性比较 与正常组相比,衰老模型组肝脏和脑中SOD活性显著降低(P<0.01,P<0.05);与衰老模型组相比,芡实中、高剂量组肝脏和脑中SOD 活性显著升高(P<0.01,P<0.05),见表2。
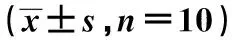
表2 各组组织和血清SOD活性比较
与正常组比较:1)P<0.05,2)P<0.01;与衰老模型组比较:3)P<0.05,4)P<0.01;同表5、表6、表7
2.3 各组血清及组织中MDA含量比较 与正常组相比,衰老模型组血清和肝脏中MDA含量显著增加(P<0.05)。与衰老模型组相比,VE组、芡实低、中、高剂量组血清、肝脏及芡实高剂量组脑中MDA含量显著下降(P<0.01,P<0.05),见表3。
2.4 各组血清及组织中NO含量比较 与正常组相比,衰老模型组血清、肝脏和脑中NO含量显著增加(P<0.05)。与衰老模型组相比,VE组肝脏和脑中,芡实中剂量组血清和肝脏中及高剂量组血清、肝脏和脑中NO含量显著下降(P<0.05)。见表4。
2.5 各组血清及组织中GSH-Px活性比较 与衰老模型组相比,VE组、芡实低、中、高剂量组血清和芡实高剂量组脑中GSH-Px活性显著升高(P<0.01,P<0.05)。见表5。
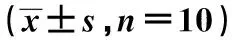
表3 各组组织和血清MDA 含量比较
与正常组比较:1)P<0.05;与衰老模型组比较:2)P<0.05,3)P<0.01;同表4
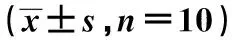
表4 各组组织和血清NO 含量比较
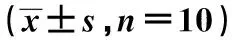
表5 各组组织和血清GSH-Px 活性比较
2.6 各组血清及组织中T-AOC水平比较 与正常组相比,衰老模型组血清、肝脏和脑中T-AOC水平显著降低(P<0.05)。与衰老模型组相比,芡实中、高剂量组血清和脑及芡实低、高剂量组肝脏中T-AOC水平显著升高(P<0.01,P<0.05)。见表6。
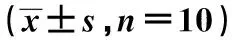
表6 各组组织和血清中T-AOC水平比较
2.7 各组肝脏、脑组织中端粒酶含量比较 与正常组相比,衰老模型组肝脏和脑中端粒酶含量显著降低(P<0.05)。与模型组相比,VE组和芡实中、高剂量组肝脏和脑中的端粒酶含量显著提高(P<0.01,P<0.05)。见表7。
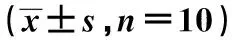
表7 各组肝脏、脑组织端粒酶含量比较
3 讨 论
本试验结果表明,芡实超微粉能明显降低衰老小鼠机体的MDA和NO含量,显著提高小鼠机体SOD和GSH-Px活性,显著提高小鼠T-AOC,且在一定范围内效果随剂量增加而增强,说明芡实超微粉能有效降低体内自由基数量,防止氧化损伤,具有显著的抗衰老功效,且一定剂量的芡实超微粉对机体的端粒酶具有保护作用。说明芡实超微粉可能通过对端粒酶的保护作用,降低细胞分裂时染色体的损伤,从而起到延长细胞寿命、延缓机体衰老的功效。
综上,芡实超微粉具有增强机体抗氧化能力、拮抗小鼠脑萎缩及对端粒酶的保护等多种作用。通过多种途径的协同作用达到改善机体衰老症状,对延缓衰老起积极作用。但芡实超微粉成分复杂,对于其抗衰老的有效成分及其具体作用机制还有待更深入的硏究。

