肠内营养治疗对原发性肝癌肝动脉化疗栓塞术后患者肝功能、凝血功能的影响及临床意义
王瑛 袁鹤立 袁楠 张博 郭建魁
(1开滦总医院肝胆外科,河北 唐山 063000;2华北理工大学附属医院)
原发性肝癌(PLC)按病理类型主要分为肝细胞癌(HCC)、胆管细胞癌及混合性肝癌。HCC是最常见的PLC〔1〕,具有独特的发病机制,5年生存率仅15%〔2〕,是全球死于癌症疾病的第二大原因〔3〕。肝癌治疗主要包括手术、局部治疗和全身治疗〔4〕。对于中晚期肝癌患者,其治疗方法主要有消融术和肝动脉化疗栓塞术(TACE)治疗〔5,6〕。加速康复外科理念在外科很多领域,如胃肠外科、肝胆外科、乳腺外科等都得到了广泛开展及深化〔7~9〕。术后传统的进食要求是待胃肠功能恢复出现肠道排气后才开始进食,而有研究表明,术后早期进行肠内营养治疗不仅有利于伤口愈合、减少感染,还可以帮助机体改善肝功能、促进胃肠功能恢复、缩短住院日等优点〔10,11〕。目前,国内外对恶性肿瘤患者的凝血功能研究较多,但关于HCC的报道相对有限,本文主要对比分析口服肠内营养剂和经口进食的方法对行TACE治疗后HCC患者肝功能、凝血功能的影响。
1 资料与方法
1.1 研究对象 2014年6月至2016年6月在开滦总医院接受TACE的HCC患者90例,分为肠内营养组42例和对照组48例。纳入条件:①临床及病理学检查明确诊断为PLC。②术前肝穿刺活检病理为HCC。③均合并血管癌栓,肿瘤临床分期(TNM分期)为Ⅱ、Ⅲ期。④肿瘤部位未经过放化疗或其他抗肿瘤治疗。⑤学历、文化社会背景职业等无特殊限制。⑥知情同意,并签署知情同意书。排除标准:①术前接受新辅助化疗或放疗。②肝功能Child-Pugh分级C级。③术后不能耐受或更改肠内营养治疗方案。④术前未达到有效控制乙型肝炎病毒患者。⑤肿瘤肝内转移或合并其他恶性肿瘤、丙肝后肝硬化患者。⑥特殊人群,如心理精神疾病、糖尿病、肾功能不全、血液系统疾病等患者。
两组术前均经过化验、影像学检查及病理检测确诊为HCC,术前碘过敏试验阴性。两组均行TACE治疗,术中单化疗药:注射用洛铂(生产厂家:海南长安国际制药有限公司,10 mg/支),剂量50 mg/m2;碘化油注射液(生产厂家:烟台鲁银药业有限公司,10 ml/支)。两组均为同一组手术医师手术,纳入的HCC患者术前行营养风险筛查2002评分(NRS2002)后,均存在营养不良风险。研究方案获得医院伦理委员会批准。肠内营养组给予静脉营养及肠内营养支持,对照组给予静脉营养及传统术后饮食,两组一般资料差异无统计学意义(P>0.05),具有可比性,见表1。

表1 两组一般资料比较
1.2 治疗方法 两组术后24 h内给予静脉置管滴注营养液,术后24 h开始,非蛋白质热量采用脂肪乳和葡萄糖供给,比例2∶3,疗程5 d。两组采用不同的营养支持治疗,能量配比均按照热量每日105 kJ/kg,氮供给每日0.2 g/kg,总液量50 ml/(kg·d)。术后护肝药为异甘草酸镁输5 d,1次/d,每次100 mg 〔商品名:甘美,生产厂家:正大天晴药业集团股份有限公司,50 mg/支),恶心、呕吐症状明显者加予盐酸托烷司琼注射液 (商品名:严迪,生产厂家:山西振东制药有限公司,5 ml/支)对症治疗,1次/d。
肠内营养组术后6 h内给予短肽型肠内营养剂〔商品名:百普素,生产厂家:荷兰纽迪希亚制药(无锡)有限公司,125 g/盒〕总量50~100 g,术后12~24 h给予患者口服总量100~125 g,2 d后总量125~250 g,3 d后可根据患者耐受情况,逐渐增加口服剂量,最大至325 g,疗程14 d。术后如果肠内营养组患者进食逐渐好转,可酌情减少肠内营养剂的剂量,最低剂量不低于125 g。注意观察术后患者胃肠功能,部分患者服用后会出现腹胀、腹泻等不良反应,可能与肠内营养液特殊气味及浓度过高等有关,服用前应按照混合均匀、少量多次、先稀后浓的方法口服,若患者胃肠症状较为明显,酌情给予胃动力药进行治疗。
对照组患者术后予传统术后饮食指导,先予流食,如水、牛奶、米汤等,可逐步过渡到半流食,如稀粥、细面条汤、鸡蛋羹、酸奶等。
1.3 检测方法 抽取两组患者手术前、手术后7、14 d空腹静脉血10 ml,采用全自动生化检测仪测定肝功能指标:天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、白蛋白(ALB)、直接胆红素(DBIL)、间接胆红素(IBIL)及胆碱酯酶(CHE)。手术前、手术后7、14 d采集两组静脉血,每次不少于5 ml,检测其凝血功能指标,包括血浆D-二聚体(D-D)、纤维蛋白原(FIB)及凝血酶原时间(PT)。
1.4 检验设备 ①检测肝功能及血浆D-D仪器:日立7600-020全自动生化分析仪。②凝血四项仪器:STA-R Evolution全自动血凝仪。
1.5 两组术后并发症 观察两组术后并发症发生情况,包括肺感染、细菌性肝脓肿、肝衰竭等。
1.6 统计学方法 采用SPSS23.0软件进行t检验、χ2检验。术后累积生存率采用Kaplan-Meier曲线计算及Log-rank检验。影响因素采用COX多因素回归分析。
2 结 果
2.1 两组手术前后肝功能指标比较 两组术前AST、ALT、ALB、DBIL、IBIL及CHE水平差异无统计学意义(P>0.05);术后AST、ALT、DBIL、IBIL水平先升高后降低,ALB、CHE水平先下降后升高。肠内营养组术后14 d ALB、DBIL及CHE水平与对照组比较差异有统计学意义(t=11.642,2.884,6.251;P=0.017,0.015,0.031),见表2。

表2 两组手术前后AST、ALT、ALB、DBIL、IBIL、CHE水平比较
与对照组比较:1)P<0.05;与术前比较:2)P<0.05;与术后7 d比较:3)P<0.05; 下表同
2.2 两组手术前后凝血功能比较 两组术前D-D、FIB、PT水平比较差异无统计学意义(P>0.05)。两组术后7 d D-D、FIB、PT及14 d D-D水平差异均无统计学意义(均P>0.05)。肠内营养组术后14 d FIB、PT水平与对照组差异有统计学意义(t=5.381,7.281;P=0.035,0.041),见表3。

表3 两组手术前后D-D、FIB、PT水平比较
2.3 两组手术后并发症比较 肠内营养组与对照组术后肺感染(1 vs 3例)、细菌性肝脓肿(1 vs 2例)、肝衰竭(0 vs 2例)、胸腹水(3 vs 7例)比较,差异有统计学意义(χ2=4.008,P=0.045)。
2.4 单因素、多因素生存分析HCC患者的预后 TNM分期、是否肠内营养治疗、TBIL、CHE、PT是影响PLC患者的预后因素(P<0.05),见表4。多因素分析结果显示,是否肠内营养治疗是影响PLC患者预后的独立危险因素,而PT是其保护因素,见表5。
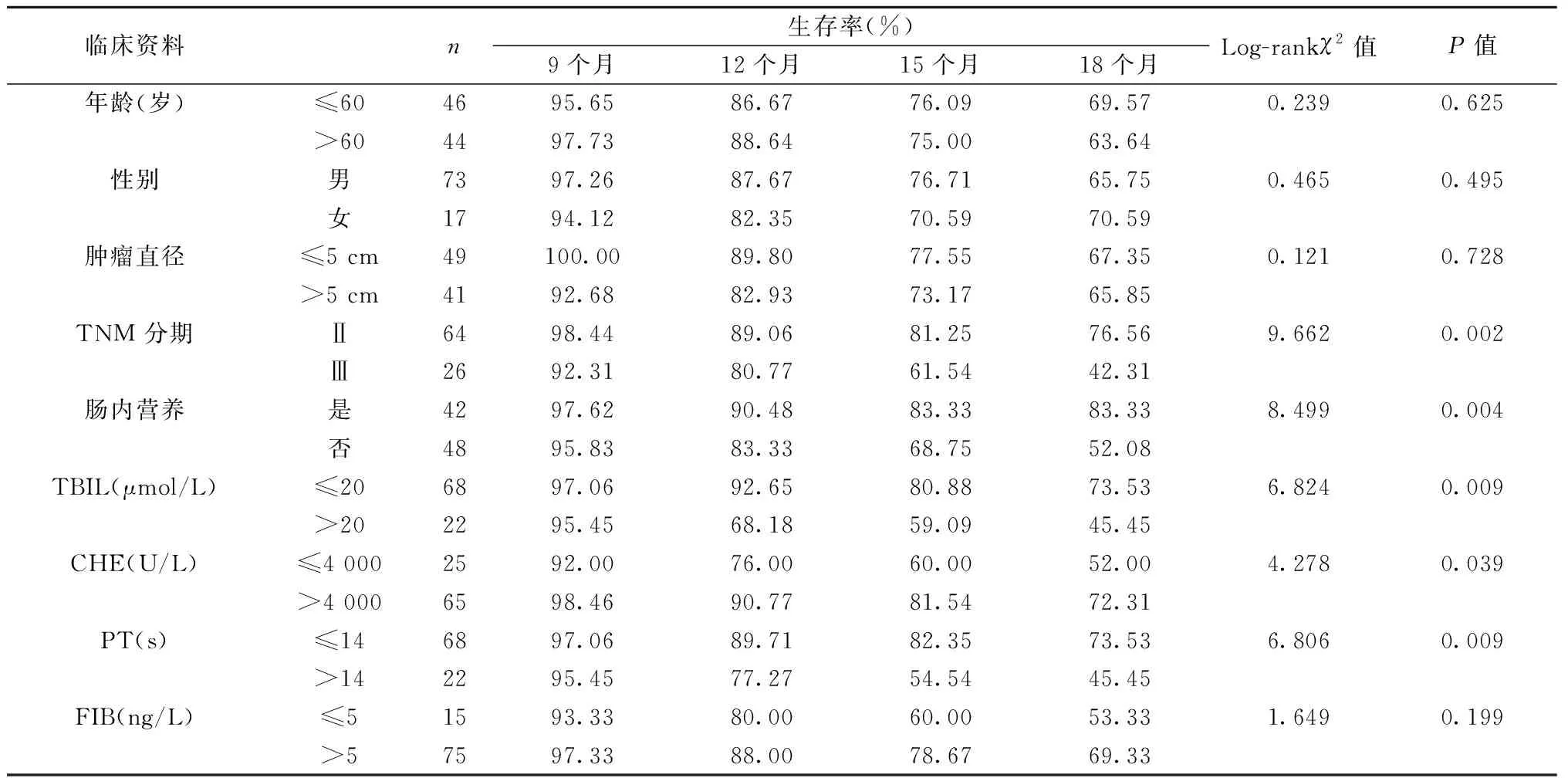
表4 影响HCC患者生存率单因素分析
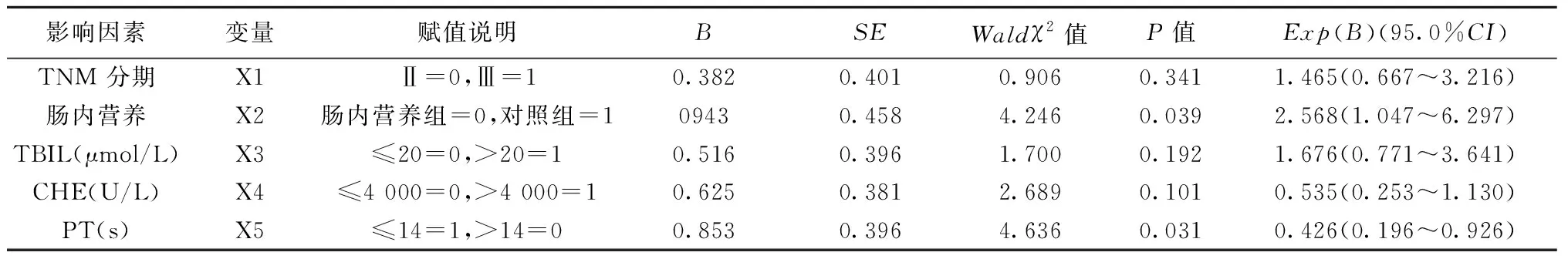
表5 影响肝癌患者生存的多因素COX回归分析
3 讨 论
恶性肿瘤患者机体常处于高代谢状态,其营养不良原因多是由于机体能量消耗增高所致〔12〕。目前,对于不可手术切除的HCC患者而言,TACE被作为一线治疗方案,TACE治疗是通过准确选择肿瘤血管,把化疗药物栓塞灌注相应动脉,从而使局部化疗药物杀死癌细胞,并使肿瘤组织缺血坏死而达到提高患者生存率为目的的治疗方法〔13〕。TACE治疗作为姑息性治疗可以显著延长患者的总生存率〔14〕,是一种安全、有效,且不良反应较低的微创治疗手术方法〔15〕。腹痛和发热是TACE后较为常见的主要症状,通常术后2 w内可以逐步缓解,但胆管炎、胰腺炎、肺栓塞等严重并发症发生率很低〔16,17〕。肝损伤是TACE后的另一常见并发症,严重时甚至可以导致肝衰竭,是影响肝癌患者远期疗效的重要因素之一。目前,有多种方法已应用于肝功能的临床评估,包括静脉血检验、吲哚氰绿试验、影像学检查、自终末期肝病模型(MELD)评分、ALB-胆红素(ALBI)评分及Child-Pugh评分(CPS)。过去单一指标不再适合肝功能的准确客观评价,多指标联合应用能更好地评估患者预后。CPS是国内应用较广泛的肝功能评价方法,其中有肝性脑病、腹水、血清胆红素、ALB及PT 5个指标〔18〕。肠外营养容易引发患者发生肝功能异常及胆汁淤积,胆汁代谢功能紊乱会继续损害患者肝功能恢复〔19〕。2017年,欧洲临床营养与代谢大学(ESPEN)进一步明确指出了早期筛查癌症患者营养风险的重要性〔20〕。短肽型肠内营养剂(百普素)主要适用于胃肠道功能有损失,且不能足量摄入传统食物来提供机体营养需求的患者,而TACE术后的PLC患者由于术中化疗及自身肝功能代谢合成功能受损,所以当有营养不良风险时更适合此类患者服用。
人体血清中有两种CHE,分别是乙酰胆碱酯酶和丁酰胆碱酯酶,也被称为真性CHE和假性CHE。其中,假性CHE曾被称为拟CHE,在肝细胞内合成,可以反映肝脏合成功能,其活力下降程度与肝病病情严重程度相关,研究也证实CHE可作为判断肝病预后重要敏感指标之一〔21~23〕。本研究结果说明,肠内营养组患者的肝脏合成ALB、CHE能力更强,肠内营养剂可以减少分解代谢,并促进机体合成,改善患者术后胆红素的代谢功能,促进胆酸和胆盐的代谢,从而促进术后患者肝脏功能的恢复。
临床常用检查凝血功能的指标主要有PT、活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、FIB、D-D等。恶性肿瘤患者的凝血功能通常存在明显异常,而凝血功能的异常对恶性肿瘤的转移和复发过程又起重要作用〔24〕。有研究显示,恶性肿瘤患者的凝血系统及纤溶系统功能存在异常,而且与肿瘤的生长、转移、浸润及预后密切相关〔25〕。肝癌患者不少是由肝硬化进一步发展而来,而肝硬化患者的凝血功能通常较差,且同时存在出血或血栓形成,甚至有血栓栓塞后继发出血的可能〔26〕。人体内的凝血因子主要是在肝脏内合成,肝癌患者由于肝功能差,会出现PT延长、FIB下降的现象,监测肝癌患者的凝血功能有重要意义〔27〕。本研究结果说明,肠内营养治疗可以促进患者术后FIB的合成,且降低PT水平,减少出血可能,促进肝癌患者TACE治疗后的凝血功能恢复,但肠内营养治疗是否存在双向调节凝血功能,还需要进一步研究。本研究结果提示,肠内营养剂可以减少肝癌患者TACE治疗后并发症的出现,让患者在住院治疗过程中更安全。
目前,国内外关于影响PLC患者预后的研究结果也不尽相同,有研究指出癌细胞的来源、肿瘤大小、肿瘤标志物、是否累及血管、合并癌栓、是否合并未控制乙肝、治疗途径及药物等,均可能是影响PLC患者预后的危险因素〔28~31〕。本研究结果显示,是否肠内营养治疗是影响TACE后PLC患者预后的独立危险因素,PT是其保护因素;且未经肠内营养治疗的PLC患者预后较差,这一结果对TACE后观察PLC患者的病情及预后有一定的提示作用。
综上,肠内营养剂支持治疗可以促进PLC患者术后肝功能、凝血功能及早恢复,减少TACE治疗后并发症的出现,是否肠内营养治疗是影响TACE后PLC患者预后的独立危险因素,对行TACE治疗的PLC患者预后恢复具有一定的临床指导意义。

