强启动子A4促进黄色链霉菌高产放线菌素D
杨帅 刘琴 万传星
(新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室/塔里木大学生命科学学院,新疆阿拉尔843300)
1 前言
放线菌素D(Actinomycin D)是上世纪40年代Waksman首次从微小链霉菌Streptomyces parvullus中分离得到的多肽类抗生素[1],具有抗菌、抗肿瘤、抗癌和抗病毒作用[2]。目前文献报道产放线菌素D的菌株有微小链霉菌S.parvulus,哥斯达黎加链霉菌S.costaricanus,公牛链霉菌S.tauricus,灰红链霉菌S.griseoruber,抗生链霉菌S.rubiginosohelvolus,锈赤蜡黄链霉菌S.rubiginosohelvolus,黄灰链霉菌S.flavogriseusNJ-4等[3-8]。黄色链霉菌Streptomyces luteusTRM 45540是本课题组分离自新疆罗布泊土壤的放线菌,其主要次生代谢产物为放线菌素D[9],前期命名为易变链霉菌Streptomyces mutabilisTRM 45540,后经全基因组测序和多相分类鉴定为S.luteus[10]。启动子插入或替代是提高抗生素产量的常用方法之一,如尹守亮等在龟裂链霉菌M4018宿主内利用强启动子过表达OtcR蛋白,使土霉素的产量提高到原来产量的4倍[11];周威等用红霉素启动子(ermE*P1)替换波卓霉素生物合成簇抗性基因btmA和前体肽合成基因btmD启动子实现了波卓霉素的产量提高[12];陶立彬等利用PermE*启动子提高了淀粉酶产色链霉菌丰加霉素的产量[13]。本实验拟通过接合转移方法将强启动子A4随机插入整合在黄色链霉菌Streptomyces luteusTRM 45540基因组上,考察其对放线菌素D产量的影响。
2 材料与方法
2.1 材料
2.1.1 菌株、质粒和培养基
黄色链霉菌 TRM 45540(Streptomyces luteus)菌株,由新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室提供。
质粒pSET152和大肠杆菌Escherichia coliS17-1,均由华中农业大学刘琴博士提供。
LB培养基(1 L):胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,pH 7.0;
ISP4培养基 (1 L):可溶性淀粉 10 g,K2HPO41 g,MgSO4·7 H2O 1.0 g,(NH4)2SO44.0 g,CaCO31.0 g,琼脂粉 18 g,pH 7.0~ 7.5;
燕麦-豆粉培养基(1 L):燕麦片30.0 g,大豆粉15.0 g,NaCl 19.0 g,K2HPO41.5 g,MgSO4.7H2O 2.5 g;
Modified-ISP4(1 L):可溶性淀粉 10 g,K2HPO41.0 g,NaCl 1.0 g ,(NH4)2SO42.0 g,CaCO32.0 g,酵母提取物0.5 g,蛋白胨1 g,MgSO4.7H2O 1.0 g,无机盐溶液 1 mL/L,琼脂20 g;无机盐溶液:FeSO41 g/L,MnCl21 g/L,ZnSO41 g/L,使用前溶化后添加MgCl2至终浓度为10 mM。
2.1.2 主要仪器和试剂
仪器:洁净工作台(Air Tech型,上海博讯实业有限公司);恒温摇床(HYG-A型,太仓市实验设备厂);高效液相色谱仪(LC-20AT型,日本岛津公司),配有二元梯度泵和SPD-20A紫外检测器。色谱柱:C18柱(Inertsil ODS-SP 4.6 mm×250 mm,5 μm)。
试剂:阿伯拉抗生素、萘啶酮酸购自北京索莱宝科技有限公司,PCR用相关试剂购自北京康为世纪生物科技有限公司,放线菌素D(纯度大于99.0%)由本实验室分离鉴定,其余试剂购自国药集团。
2.2 方法
2.2.1 大肠杆菌Escherichia coliS17-1感受态的制备及DNA转化
感受态细胞的制备:(1)挑取平板上的E.coliS17-1单菌落于5 mL LB培养基内,37℃,220 r/min,16 h;(2)将过夜培养的菌液按1%的接种量转入含50 mL LB三角瓶中,37℃,220 r/min,培养2.5 h左右,直至OD=0.6 ;(3)收集菌体,5 000 r/min,10 min;(4)加入25 mL TFBI重悬菌体,5 000 r/min,4 min,弃上清;(5)在菌体中加入2 mL TFBII重悬菌体,并分装100 μL/离心管,放于-80 ℃储存备用。
DNA的转化:从-80℃取一支100 μL感受态细胞在冰上放置5 min,加入5 μL酶连产物或2 μL质粒,继续在冰上放置30 min。37℃热激2 min或42℃热激90 s,然后在冰上放置5 min。加入1 mL LB培养基,在37℃摇床中以200 r/min培养45 min。5 000 r/min离心3 min,倒掉大部分上清,用余下的上清将沉淀悬浮。涂布加有相应抗性的平板,37℃培养箱过夜培养。
2.2.2 转化子的构建
以质粒pLQ 007+A4为模板扩增A4片段,扩增启动子A4引物序列为:
引 物 pA4up:AAAAGGATCCGACACATCCTCCAGCTGAG
引物 pA4down:AAAATCTAGAGGACCACCAGTAAGAGCTGCGA
凝胶回收A4片段,用XbaI+BamHI酶切回收A4片段,提取pSET152的质粒DNA,用XbaI+BamHI酶切质粒DNA,脱磷处理后与A4片段进行连接;然后转入E.coliS17-1感受态细胞中,形成转化子pYS001(图1).

图1 pYS001质粒构建图谱
2.2.3 接合子的构建
将pYS001接种在10 mL LB(Apr)培养基中,37℃,16 h;转接培养了16 h的转化子,以1%的接种量接种到新鲜的LB(Apr)培养基中,37℃,培养2.5-3 h,直至OD=0.6(600 nm);取新鲜的孢子悬液100 μL,用TSB清洗3次,5 000 r/min,4 min;完成后加入100 μL TSB悬浮,55 ℃,10 min,37 ℃,3 h;将重新转接的转化子悬液,收集2次,12 000 r/min,1 min,用 LB 清洗 3 次,5 000 r/min,4 min,加入100 μL LB,于 100 μL 的孢子悬浮液混匀,放置5 min,将共培养的产物涂布于Modified-ISP4平板中,30℃培养12~14 h;对平板进行抗生素覆盖处理,覆盖抗生素溶液配方为1 mL超纯水、25 μL Nal、25 μL Apr。置于操作台吹干后,30 ℃,培养5~7 d。一周后挑取单菌落进行纯化培养,提取接合子和TRM 45540菌株的总DNA,PCR验证A4片段是否成功导入TRM 45540体内。
2.2.4 转化子质粒的双酶切验证
将提取的转化子质粒DNA,使用HindIII和BamHI进行酶切验证,体系如下:DNA 5 μL,10×fast Didest buffer 2 μL,HindIII 1 μL,BamHI 1 μL,ddH2O 11 μL。
2.2.5 转化子和接合子PCR验证
反应体系(20 μL):上游引物(10 μM)0.5 μL;下游引物(10 μM)0.5 μL;模版(约 30 ng/μL)0.5 μL;Buffer(10μL,含 Mg2+)2 μL;dNTPs(2.5 mM)2 μL;DNA 聚合酶(5 U/μL)0.5μL;ddH2O 14 μL。
PCR反应程序:预变性,95℃,10 min;变性94 ℃,30 s;复性,58 ℃,30 s;延伸,72 ℃,1 min。变性-复性-延伸,循环30次;终延伸72℃,10 min。
2.2.6 菌株培养发酵及前处理流程
采用ISP4培养基制备接合子菌株S.luteusTRM 45540::pYS001和野生菌株S.luteusTRM 45540种子液,装液量150 mL/瓶、28℃、180 r/min摇床培养3天后,按4%接种量接种到燕麦-豆粉培养基中发酵,装液量150 mL/瓶、28℃、180 r/min的摇床培养7天。每隔24 h取5 mL发酵液,50℃烘干后甲醇反复提取,定容到5 mL进行高效液相色谱(HPLC)检测分析。
2.2.7 HPLC法检测放线菌素D含量[14]
放线菌素D标准品配制成浓度为10.0 mg/mL的母液,倍性稀释成系列浓度,HPLC流动相为0~40 min,10%~100%甲醇,流速为1 mL/min,进样量为10 μL,柱温35℃,检测波长为443 nm,制作标准曲线如图2。放线菌素D的标准曲线回归方程为 y=(1.687 6×10-6)x+0.038 9,方程中x是峰面积,y是放线菌素D含量,R2值为0.999 6,放线菌素D的含量与峰面积呈良好线性关系,可用于放线菌素D的含量分析。

图2 放线菌素D的HPLC标准曲线
3 结果与分析
3.1 转化子质粒双酶切验证
提取转化子pYS001质粒,利用XbaI+BamHI双酶切,酶切产物葡聚糖凝胶电泳图参见图3。由图3可知,转化子pYS001质粒中含有A4片段。

图3 转化子pYS001质粒的双酶切验证
3.2 转化子PCR产物验证
提取转化子pYS001总DNA并以其为模板,利用启动子A4(524bp)的一对引物pA4up与pA4down进行 PCR,所用 PCR条件为 94,10 min;94 ℃,30 s;58 ℃,30 s;72 ℃,1 min;30个循环;72 ℃,10 min。将PCR产物进行葡聚糖凝胶电泳分析(参见图4),结果显示转化子pYS001的PCR产物中含有A4片段,表明转化成功。
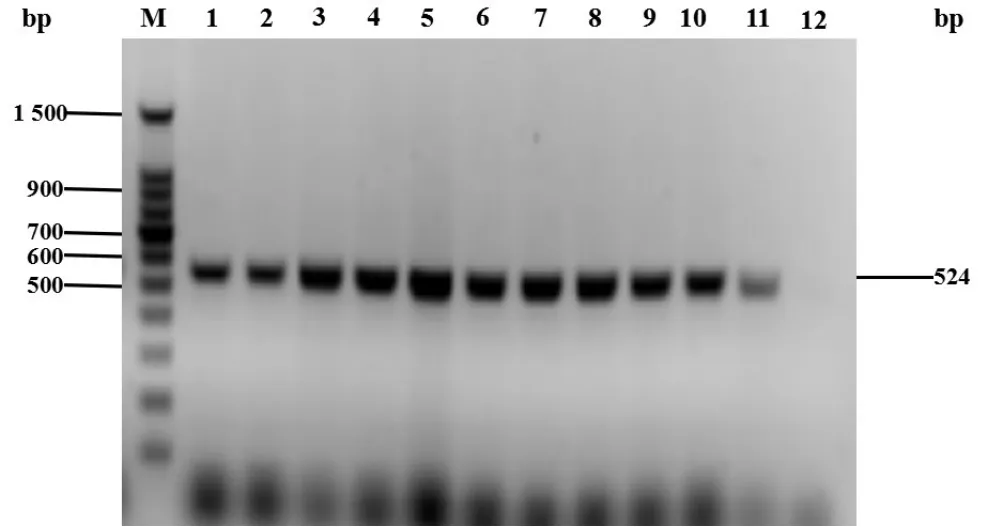
图4 转化子pYS001 PCR产物验证
3.3 接合子S.luteusTRM 45540::pYS001中启动子A4的PCR验证
对接合转移获得的接合转移子进行阿伯拉抗生素(Apr)和萘啶酮酸(Nal)筛选,获得稳定遗传的接合子S.luteusTRM 45540::pYS001,以接合子总DNA为模板,利用启动子A4(524 bp)的一对引物pA4up与pA4down进行PCR扩增,PCR产物经凝胶电泳分析(参见图5),结果表明启动子A4成功导入接合子中并能稳定遗传。
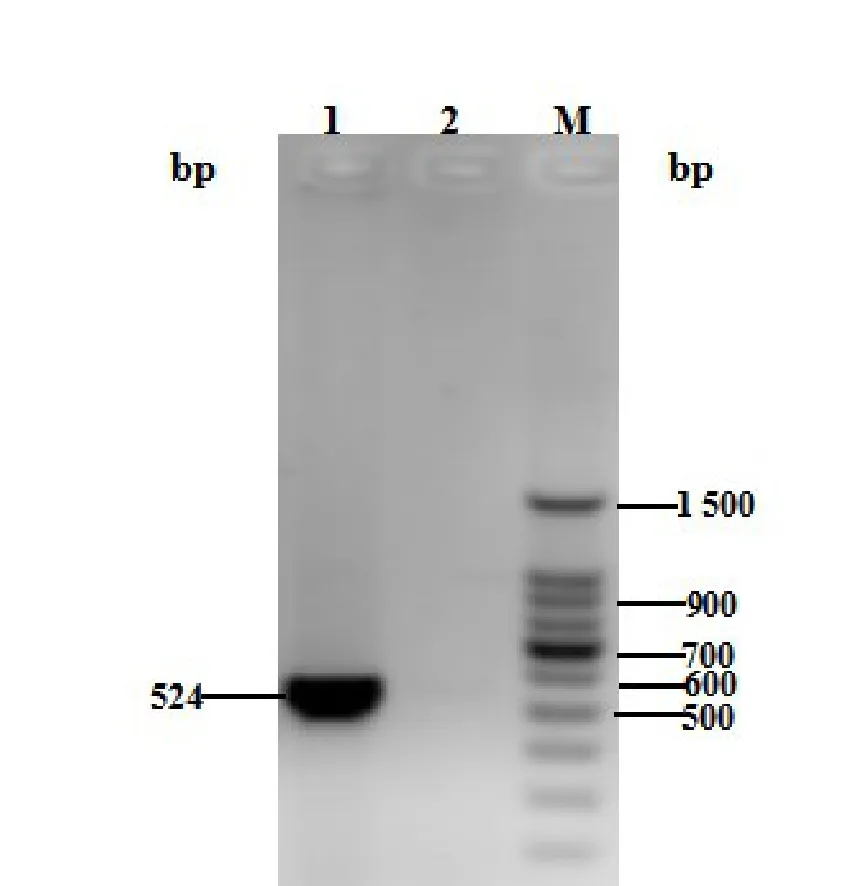
图5 接合子S.luteusTRM 45540::pYS001中启动子A4的PCR验证
3.4 接合子S.luteusTRM 45540::pYS001与野生菌株S.luteusTRM 45540发酵产物放线菌素D的比较分析
接合子S.luteusTRM 45540::pYS001和野生菌株TRM 45540经燕麦-豆粉培养基发酵7 d后进行放线菌素D的HPLC分析和含量动态检测(如图6、图7所示),接合子S.luteusTRM 45540::pYS001发酵7d后产放线菌素D的量为821.8 mg/L,明显高于原始菌株TRM 45540放线菌素D的产量(647.6 mg/L),说明启动子A4促进了黄色链霉菌TRM 45540产放线菌素D的产量。
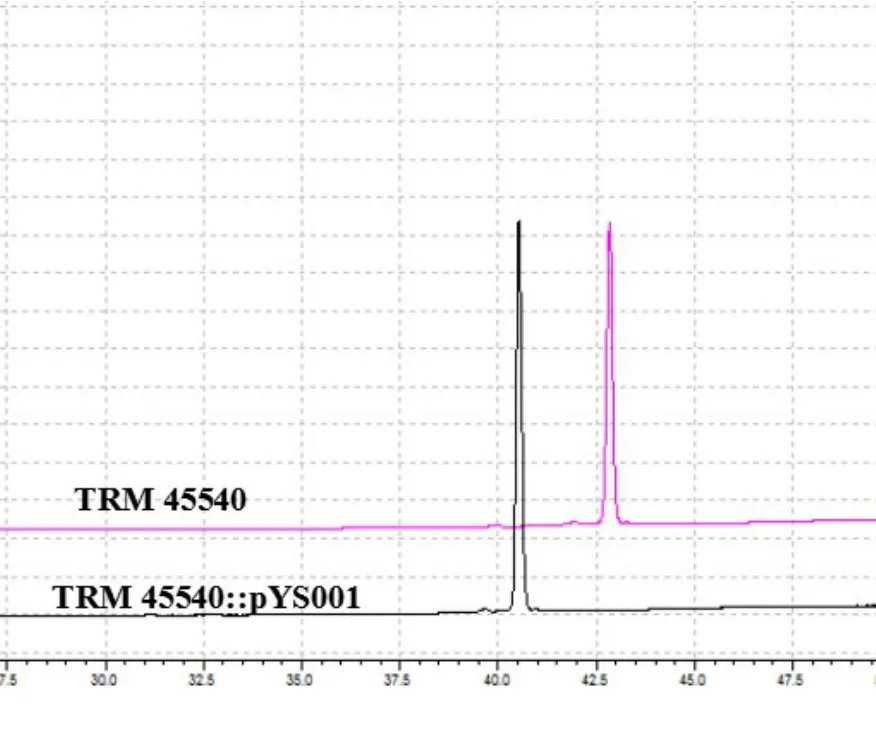
图6 S.luteusTRM 45540与S.luteusTRM 45540::pYS001发酵产物443nm波长下HPLC图
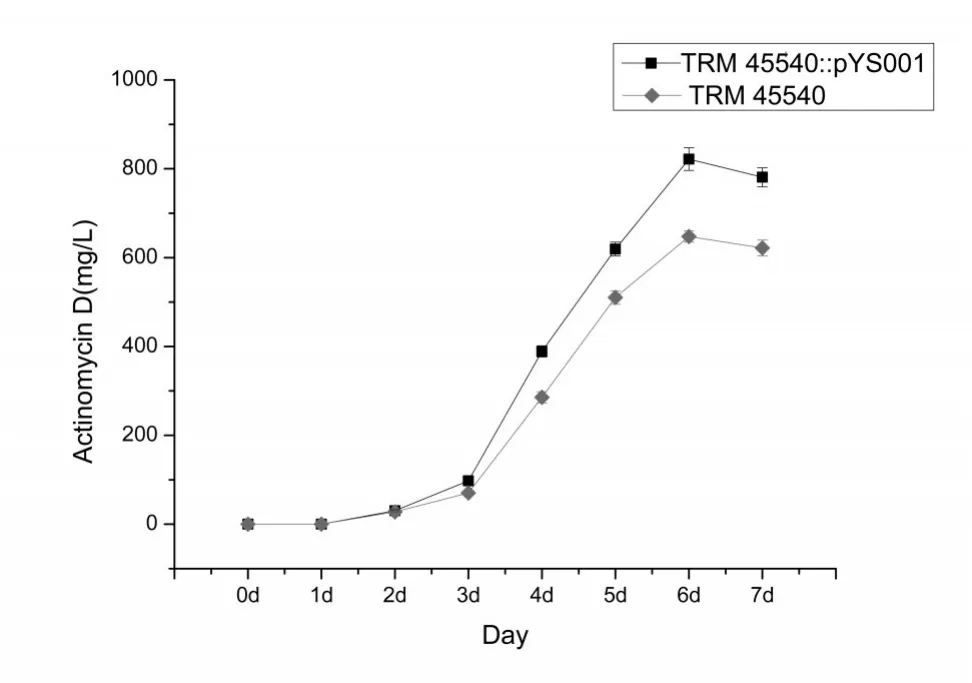
图7 S.luteusTRM 45540与S.luteusTRM 45540::pYS001产放线菌素D的曲线
4 讨论与结论
放线菌素D(又称更生霉素)是具有抗菌、抗病毒、抗肿瘤等多种活性的酯环肽类抗生素,其作用机理为嵌合于DNA双链内,抑制DNA依赖的RNA聚合酶活性,干扰细胞的转录,从而抑制mRNA合成,尽管由于其毒性较高限制了放线菌素D的使用,但放线菌素D却是治疗霍奇金病、神经母细胞瘤、绒毛膜上皮癌和横纹肌肉瘤等恶性肿瘤的特效药,还可提高肿瘤对放射治疗的敏感性,临床上有一定的需求,所以一直有放线菌素D高产菌株的报道,如灰红链霉菌Streptomyces griseoruber放线菌素D的产量为210 mg/L[15],红树林链霉菌Stremptmeces costaricanus产量报道为 300 mg/L[16];两株耐碱放线菌Streptomyces sindenensis放线菌素D的产量分别为120 mg/L和850 mg/L[17],黄灰链霉菌Streptomyces flavogriseusNJ-4放线菌素D的产量最高,为960 mg/L[18]。本实验通过接合转移的策略,导入强启动子A4对TRM 45540进行分子改造,使黄色链霉菌S.luteusTRM 45540放线菌素D的产量提高到821.8 mg/L,在放线菌素D的制备上具有一定的应用潜能。
——一道江苏高考题的奥秘解读和拓展

