生存胁迫法分离那拉提土壤拮抗放线菌及活性产物
刘占文 张利莉
(塔里木大学生命科学学院/新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆阿拉尔843300)
近几年新型病情及耐药菌株的不断出现,对抗生素尤其是新的活性良好的抗生素的发现已经迫在眉尖[1],人们也努力尝试诸如生物组合合成及半合成等方法获得新型抗生素并取得了很大成就,然而这些方法获得的抗生素均为已知抗生素的衍生物[2],要想获得母核新颖的抗生素必须需要新的资源。而放线菌是抗生素的重要产生资源菌,因此如何从环境中获得活性放线菌成了解决问题的关键[3] 。
放线菌是抗生素的重要产生菌,获得活性放线菌资源在抗生素发掘中十分重要[4],但是常规的放线菌分离法存在两个不足,一是获得可培养放线菌的数量有限,仅为自然间放线菌总量的1%,鉴于此,Ling等年开发了一种“iChip”的装置,此法可将土壤可培养放线菌的分离率提高到50%[5],此法的核心原理是避免土壤放线菌在生长过程中互相干扰,赋予了每个放线菌单独的生存生长空间,实现了“一室一菌”[6];二是分离获得的可培养放线菌中活性放线菌比例偏低,后续活性放线菌的筛选工作繁重,活性产物获得几率不高[7],如罗红丽等从我国西藏地区分离的可培养放线菌中,活性放线菌的比例只有38.5%[8],其原因可能是土壤中非活性放线菌的比例偏高所致,因此如何处理分离土壤样品,使其活性放线菌的比例提高在活性放线菌资源获得上显得尤为重要[9]。
本研究根据“自然选择适者生存”的思想,设计了“生存胁迫法”来提高土壤样品中活性放线菌的比例,既在预分离的土壤样品中人工加入多种病原菌进行胁迫,逐步淘汰面对病原菌无法生存的放线菌,同时富集能够拮抗病原菌的放线菌,并以此预处理土样作为放线菌分离的理想土壤样品。同时为了进一步提高可培养放线菌的分离比例,借鉴了“iChip”法分离放线菌的思路,采用“96孔板法”实现“一室一菌”进行可培养活性放线菌的分离。
结果表明,“生存胁迫法”和“96孔板法”相结合,分离获得的活性放线菌比例高达89.7%,并通过次生代谢产物的挖掘,从分离到的一株链霉菌——S.luteusTRM70003中成功鉴定了两个活性良好的抗生素,分别为放线菌素D和星形孢菌素。可见该法在土壤活性放线菌分离获得上有效可行,为后续土壤放线菌资源及其次生代谢产物的挖掘提供了理论参考和实践借鉴。
1 材料和方法
1.1 供试土样
实验用土样于2017年6月采于新疆那拉提,无菌袋包装后4℃保藏。
1.2 供试病原菌
供试病原菌均为课题组保藏菌种,分别为:金黄色葡萄球菌(Staphylococcus aureusATCC 6538)、表皮葡萄球菌(Staphylococcus epidermidisATCC 35984)、大肠杆菌(Escherichia coliATCC 25922)、白色念珠菌(Candida albicansATCC 64550)、棉花黄萎病(Verticillium dahliaeACCC 36211)、棉花枯萎病(Fusarium oxysporum fsp.VasinfectumACCC31038)、辣椒疫霉(Phytophthora capsiciACCC36278)。
1.3 实验用培养基
ISP4:可 溶 性 淀 粉 10 g,K2HPO41.0 g,Mg-SO4.7H2O 1.0 g,(NH4)2SO42.0 g,CaCO32.0 g,微量元素液1.0 mL,NaCl 1.0 g,琼脂 18.0 g,pH 7.0~7.6。
ISP3:燕麦 20.0 g,微量元素液 1.0 mL,NaCl 1.0 g,pH 7.0~7.5。
AM6:葡萄糖10.0 g,淀粉20.0 g,蛋白胨5.0 g,酵母浸膏5.0 g,碳酸钙5.0 g,蒸馏水1.0 L,pH7.0。
1.4 主要试剂及仪器
PCR仪(Lab Cycler S tandard,SENSO,德国);凝胶成像仪(ChemDoc XRS+,伯乐公司,美国);高压灭菌器(BXM-150M,博迅,上海);超净工作台(SW-CJ-2F,博迅,上海);高效液相色谱仪(LC-20AT,岛津,日本);制备液相仪(Waters255,Waters,美国);核磁共振仪(500-54 Ascend UHL,Bruker,德国);凝胶、甲醇、二氯甲烷(分析纯,天津市福晨化学试剂厂)。
1.5 实验方法
1.5.1 土壤预处理
根据“自然选择适者生存”的思想,设计了“生存胁迫法”处理土样,即将S.aureusATCC 6538、S.epidermidisATCC 35984、E.coliATCC 25922、C.albicansATCC 64550、V.dahliaeACCC 36211、F.sp.VasinfectumACCC31038、P.capsiciACCC36278 7种病原菌分别制成菌悬液或孢子悬液,各取10 mL加入到1000g风干土样中,同时加入10g可溶性淀粉于土样中,定期补水,维持土样湿润,30d后用于放线菌分离。
1.5.2 放线菌分离
将预处理好的土样稀释到10-4后,无菌条件下加入到倒有ISP4培养基的96孔板中,每孔5 μL,28℃培养11 d后挑去单菌落于培养皿中进行纯化培养。
1.5.3 纯培养的16S rDNA鉴定
菌株的DNA提取用SDS-蛋白酶法,应用引物27F(5′-AGA GTT TGA TCC TGG CTC-3′)和1492R(5′-CGG CTA CCT TGT TAC GAC TT-3′)进行扩增放线菌的16S rDNA及测序(上海生工)。利用EzTaxon-e进行序列比对,进行菌株的初步鉴定,采用Neighbour-joining法对分离获得的放线菌进行多重序列分析,用软件MEGA构建系统发育树。
1.5.6 活性放线菌筛选及次生代谢能力分析
采用ISP4液体培养制备种子液,采用ISP3及AM6为发酵培养基,对分离获得的放线菌进行发酵(140 rpm,28℃,7 d),发酵液过大孔吸附树脂并菌体甲醇超声提取无合并的浸膏,经甲醇重新溶解后获得放线菌次生代谢粗提物,待用。以大肠杆菌、金黄色普通球菌及白色念珠菌为指示菌,采用滤纸片扩散法对放线菌次生代谢粗提物进行活性实验,同时将粗提物进行HPLC分析。
1.5.7S.luteusTRM70003发酵、分离与纯化
将菌株S.luteusTRM70003接种于ISP4液体培养基中(每500 mL锥形瓶中装200 mL液体培养基),每瓶接种6块菌饼,于28℃、180 rpm条件下培养7 d,得发酵种子液。发酵种子液接种于AM6发酵培养基中,与制备种子液培养相同时间,过滤分离菌体和发酵液,菌体用甲醇进行超声提取,发酵液进行大孔树脂柱层析,合并,浓缩,进行柱层析分离,分离流程图如1所示。
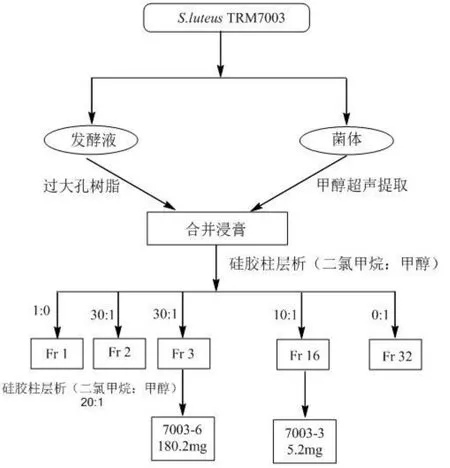
图1 S.luteusTRM70003发酵产物分离纯化
1.5.8 活性次生代谢产物的鉴定
根据化合物的物理化学性质并结合核磁1H NMR、13C NMR、HSQC及HMBC谱图数据,基于活性跟踪基础上对Fr3和Fr16部位分离的活性产物进行结构解析,确定化合物的结构。
2 结果与分析
2.1 那拉提土壤放线菌的分离及16S rDNA鉴定
根据《伯杰氏系统细菌学鉴定手册》结合形态学和分子生物学对分离于那拉提土壤的29株放线菌进行鉴定[10](图2),其中28株为链霉菌,占总分离菌株的96.55%,1株为小单孢菌,占总分离菌株的3.45%,结果表明,从图2中看出,28株链霉菌分支情况较好,说明“生存胁迫法”和“96孔板法”相结合能较好的分离获得土壤中的活性放线菌。此外,那拉提土壤的放线菌种类和丰富度单一,可能于土壤营养成分适应于放线菌属中链霉菌的生长。
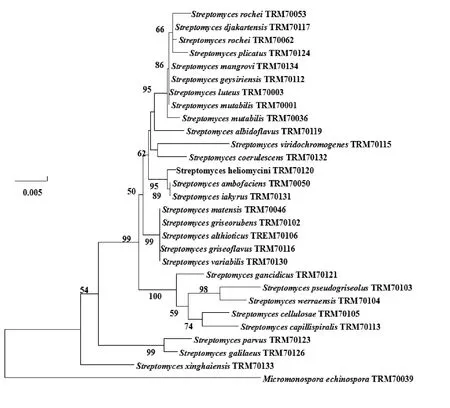
图2 29株放线菌16S rDNA鉴定及聚类
2.2 29株放线菌株次生代谢能力
根据16S rDNA序列比对结果,通过文献调研29株放线菌相似菌株的次生代谢能力,结果如表2所示,由表2可知,29株相似放线菌中,只有S.mangroviTRM70134(98.82%)和S.gancidicusTRM70121(99.20%)两株链霉菌未见文献报道产生抗生素的情况,而S.ambofaciens TRM70050(99.26%,二素链霉菌)主要产生螺旋霉素及罗红霉素;S.galilaeusTRM70126(100.00%,加利链霉菌)主要产生阿克拉霉素、S.geysiriensisTRM70112(99.72%喷泉链霉菌)主要产黄霉素、S.pseudogriseolusTRM70103(假浅灰链霉菌)主要产色霉素和茴香霉素等菌株及其所产的抗生素都具有良好的开发应用价值。29株放线菌中,相似菌株应用于实际生产的工业菌种多达9株,占总菌株的31.0%,29株放线菌相似菌株产生次生代谢产物能力较强,所产抗生素中有11种已经用于临床或农业生产。由此可见,“生存胁迫法”和“96孔板法”相结合是分离产生拮抗活性菌株的有效手段。
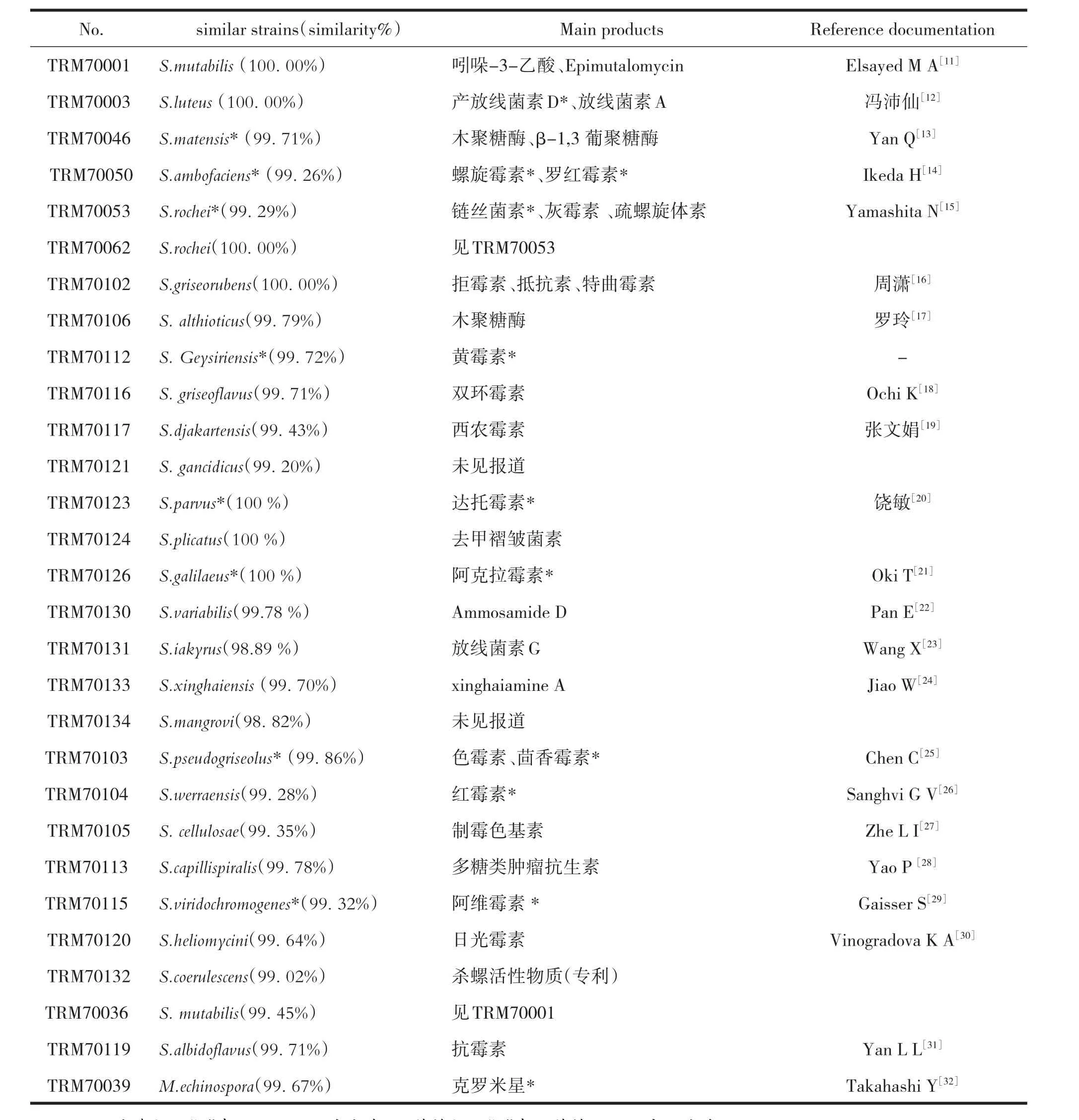
表2 29株放线菌相似菌株及拮抗活性成分分析
2.3 发酵产物拮抗活性与HPLC分析
采用AM6和ISP3两种培养基对分离的29株放线菌进行发酵,获得粗提物后对E.coli、S.aureus和C.albicans靶标菌进行抗菌活性测试,采用滤纸片扩散法对放线菌次生代谢粗提物进行活性实验,同时将粗提物进行HPLC分析。结果如表3和图3。
从29株放线菌的HPLC分析来看,29株放线菌均有不同程度的产生次生代谢产物能力,更进一步证实了“生存胁迫法”和“96孔板法”相结合在分离活性放线菌上的优势。
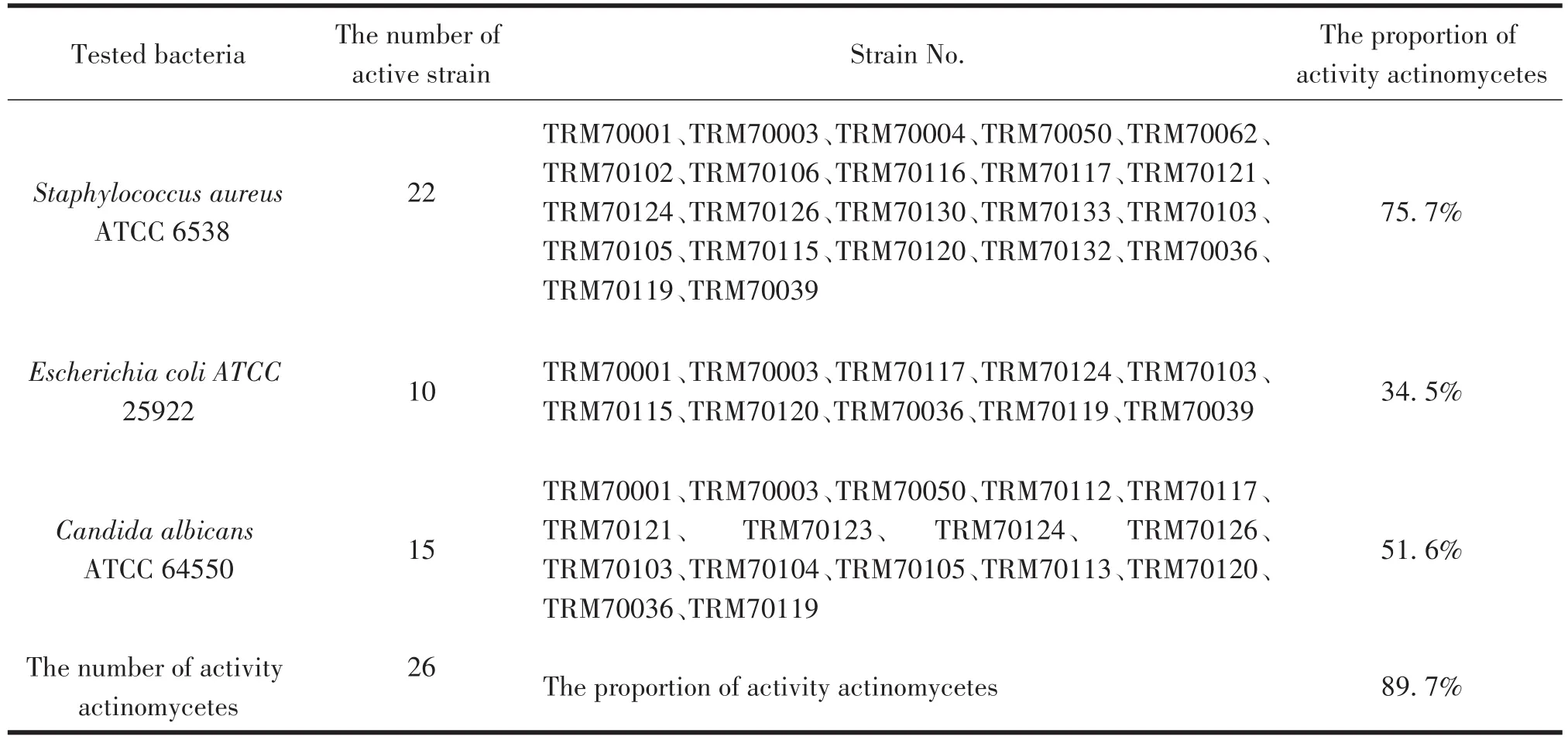
表3 29株放线菌拮抗活性筛选Table 3 Antimicrobial activity screening of 29 actinomycetes
从表3可以看出,分离获得的29株放线菌中,至少对三种供试靶标菌一种有活性的菌株多达26株,占89.7%,远大于常规分离法获得活性菌株的比例。其中对三种供试靶标菌都具有活性的菌株为:TRM70001、 TRM70003、 TRM70117、 TRM70124、TRM70103、TRM70120、TRM70119等7株放线菌表现出了对三种靶标菌的拮抗活性(24.1%,)表明其具有广谱抑菌能力。

图3 29株放线菌次生代谢产物HPLC分析
2.4 S.luteusTRM70003发酵产物分离鉴定
鉴于S.luteusTRM70003发酵粗提物对大肠杆菌、金黄色葡萄球菌及白色念珠菌都具有抑制活性,且HPLC分析显示代谢产物丰富,采用ISP3对该菌株进行发酵及产物分离鉴定,最终成功分离获得了两种活性良好的抗生素70006-6和70003-3,通过1H NMR及13C NMR数据于文献比对,70003-6鉴定为放线菌素D[33],70003-3为星形孢菌素[34],其13C NMR信息如表4和表5,结构如图4所示。

图4 放线菌素D(左)和星形孢菌素(右)化学结构
3 讨论
医药领域新药的研发主要来源于放线菌,70%以上的抗生素都来源于放线菌次生代谢产物,从放线菌中寻找次生代谢产物的方法也多种多样,基于文献报活性追踪,拮抗活性筛选和高通量筛选的方法和手段分离的活性菌株率为1‰,甚至更少。而本论文基于“生存胁迫法”和“96孔板法”相结合分离思路,将各种病原菌和土壤共同孵育,再通过常规分离方法获对病原菌有拮抗活性菌株的比例高达89.7%,而且分析拮抗菌株产生次生代谢产物的丰富度来分析,29株放线菌中有9株放线菌已经工业化,11中在临床和农业实际中有所应用。可见“生存胁迫法”和“96孔板法”相结合法是有效的活性放线菌分离及次生代谢产物挖掘方法,值得推广提倡,也因此本研究为后续活性放线菌资源的获取提供了重要的理论参考和实际借鉴作用[35-36]。
同时对分离到的S.luteusTRM70003进行了发酵产物分离鉴定,最终成功获得了两种活性;良好的抗生素——分别为放线菌素D及星形孢菌素。对多种病原菌都具有抗菌活性。然而不足的是,本研究分离获得放线菌数量有限,仅为29株,而且多样性较差,29株放线菌中只有一株为小单孢菌,其余均为链霉菌,这可能与分离培养基过于单一(本研究仅用ISP4作为分离培养基)有关,如何进一步提高分离放线菌的多样性及数量有待进一步研究。
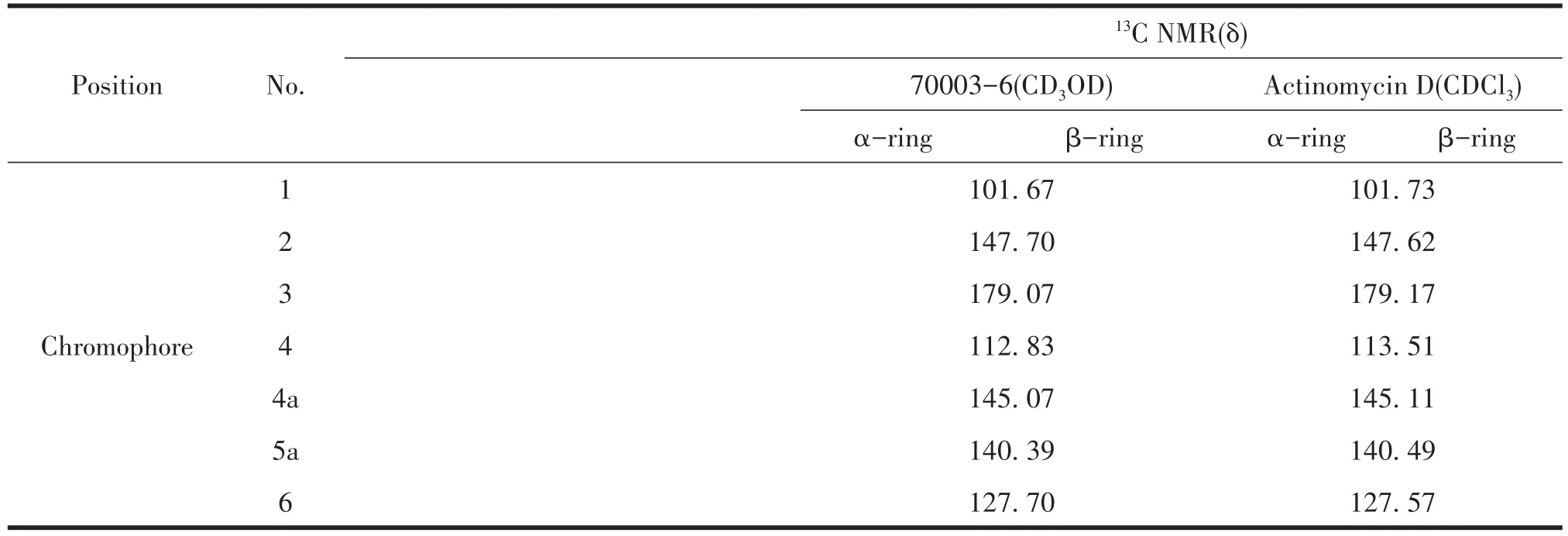
表4 化合物70003-6和放线菌素D13C NMR数据
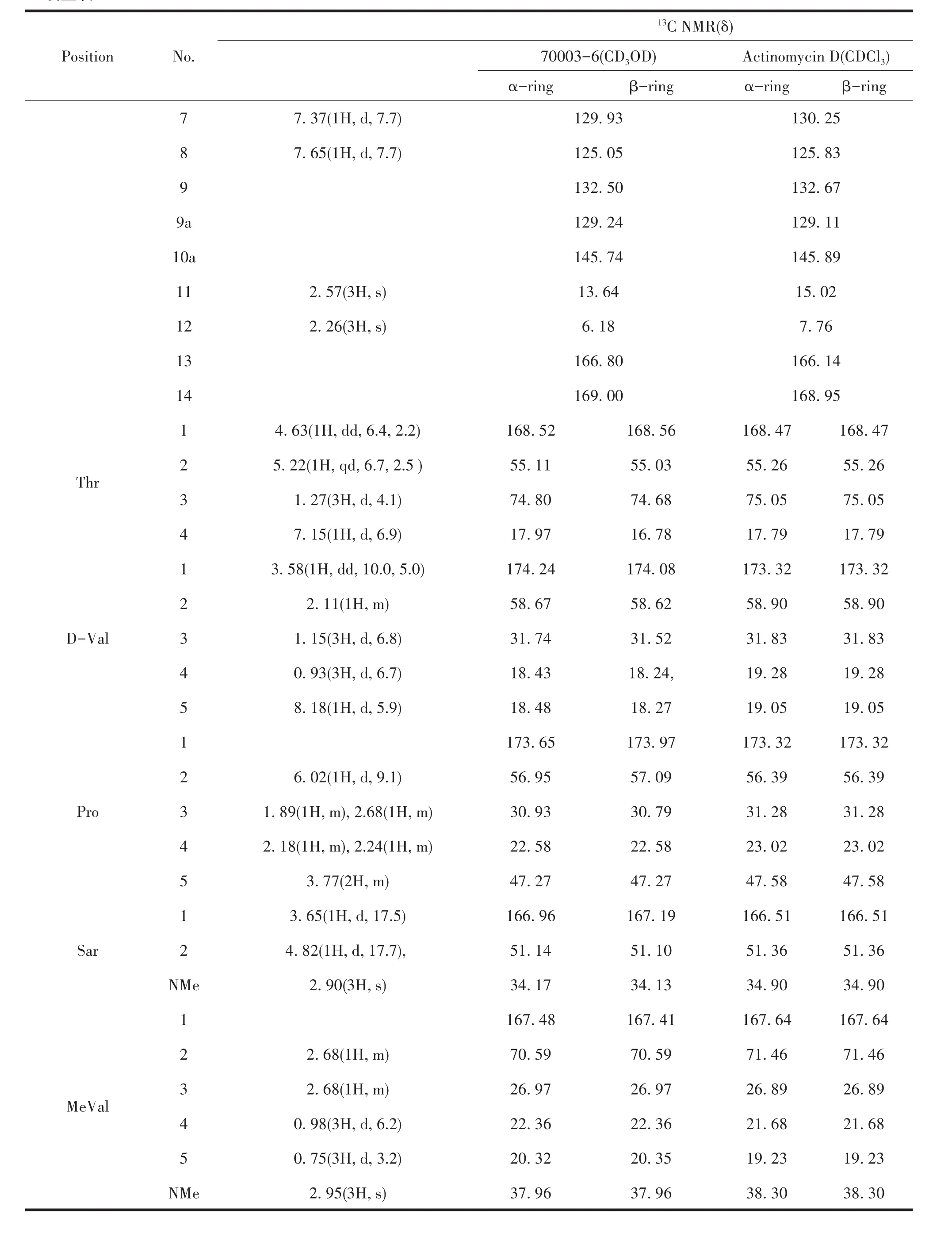
续上表
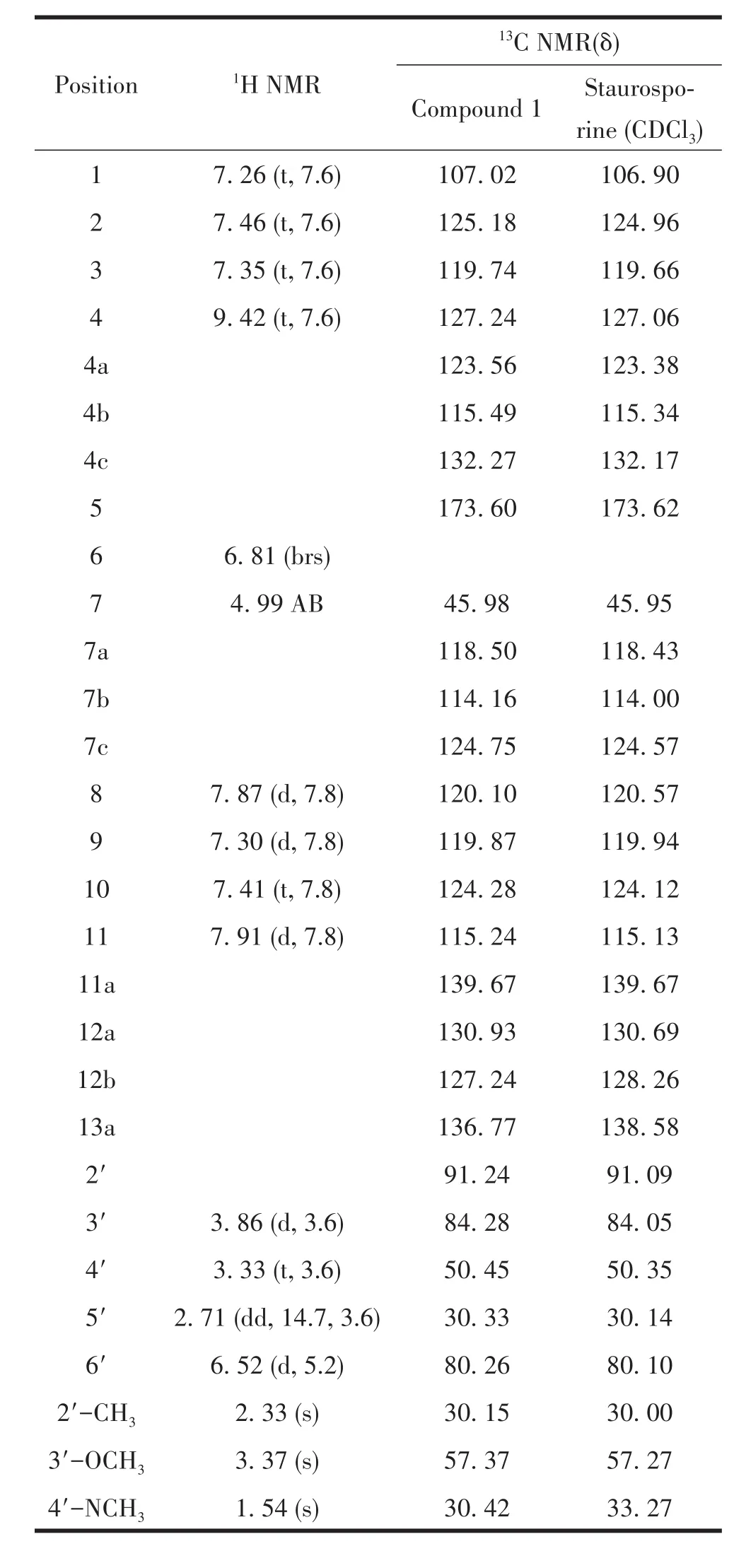
表5 化合物70003-3和星形孢菌素D13C NMR数据

