白藜芦醇通过激活PI3K/Akt通路抑制高糖致肾小管上皮细胞凋亡的研究△
杨莎莎,周利
湖北医药学院 附属太和医院 肾内科,湖北 十堰 442000
糖尿病肾病(DN)的特征在于肾炎、尿白蛋白、肾小球滤过率降低、肾小球硬化症和肾间质纤维化,是终末期肾病(ESRD)的主要原因。因此,探索介导DN的机制对于缓解DN的预防和治疗策略至关重要[1]。白藜芦醇(RSV)是一种天然多酚化合物,存在于各种水果中,如葡萄、坚果、浆果以及红葡萄酒。以前的研究表明,RSV具有多种有益的健康效果,包括抗氧化、抗炎、抗癌、心脏保护和神经保护活动。关于糖尿病肾病,以前的报道表明RSV可以改善肾功能不全和病理改变,以及通过体内糖尿病条件下的多种信号通路阻止高葡萄糖诱导的肾小球系膜细胞增殖和肾小球纤维连接蛋白的表达[2]。现已有研究报道指出,白藜芦醇对高糖诱导肾小管上皮细胞凋亡具有保护作用,从而对糖尿病肾病起保护作用[3-4]。
糖尿病患者的死亡率很高。由高血糖引起的线粒体功能障碍有助于DN发生发展,其原理可能与活性氧(ROS)过度产生和腺苷三磷酸(ATP)产生的降低有关,尤其是在肾小管上皮细胞。近端肾小管主要作用水的重吸收、葡萄糖及电解质(钠离子)运输,这些都需要大量的ATP。而ATP主要来源于细胞内的线粒体。当细胞受到损害(氧化应激),线粒体功能障碍导致ATP产出减少。因此,肾氧化应激是DN重要的发病机制之一,抑制肾氧化应激可有效地治疗DN,这为其治疗提供了新切入点[5]。
磷脂酰肌醇-4,5-二磷酸3-激酶(PI3K)蛋白激酶B(Akt)途径即PI3K/Akt,是调节细胞增殖、分化、凋亡、衰老、抗氧化的关键信号通路[6]。研究表明,PI3K/Akt通路对氧化应激及其引起的凋亡起着重要的保护作用[7]。大量研究报道指出,白藜芦醇具有抗氧化应激的作用[8]。基于上述报道,本研究采用高糖诱导肾小管上皮细胞损伤作为模型,探讨白藜芦醇是否通过激活PI3K/Akt通路抑制高糖诱导的氧化应激,从而对肾小管上皮细胞发挥保护作用。
1 材料与仪器
1.1 材料
白藜芦醇(南京景竹生物科技有限公司,批号:JS190524,纯度:99%)。肾小管上皮细胞(HK-2,南京凯基生物科技发展有限公司)。
胎牛血清(美国Earthox公司)、胰酶和DMEM培养基(上海翊圣生物科技公司);MTT试剂盒(沈阳万类生物科技公司);乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)试剂盒购自南京建成生物公司;JC-1(线粒体膜电位)试剂盒购自AAT Bioquest;膜联蛋白V/碘化丙啶(Annexin-V/PI)细胞凋亡检测试剂盒(沈阳万类生物科技公司);二氢乙锭(DHE,美国AAT Bioquest公司);抗体磷酸化Akt(p-Akt)、Akt、细胞色素C(CYT-C)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)购自沈阳万类生物科技公司;LY294002(美国APExBIO公司)。
1.2 仪器
立式压力蒸气灭菌器(上海三中医疗器械有限公司),干燥箱(上海福玛实验有限公司),超净工作台(苏净集团有限公司),二氧化碳孵箱(美国Thermo Fisher公司),荧光显微镜(德国 Leica公司),高速台式大容量离心机(德国HERMLE公司),多头磁力搅拌器(江苏中大仪器厂),超声波破碎机(美国SONICS公司),制冰机(日本大阪松下电器产业株式会社),优普超纯水制造系统(新加坡优普公司),流式细胞仪(美国BD FACSCelestaTM公司)。
2 方法
2.1 细胞培养及分组
肾小管上皮细胞培养在DMEM培养基,在37 ℃、5% CO2条件下培养,待细胞达到90%左右的融合度时,取对数生长期细胞用于实验。实验分组(平行孔数n=5):空白对照组;模型组(培养基中加入30 mmol·L-1高糖孵育8 h);白藜芦醇低、高浓度组(培养基中分别先加入5、10 μmol·L-1白藜芦醇孵育4 h,再加入30 mmol·L-1高糖孵育8 h);PI3K抑制剂组(10 μmol·L-1白藜芦醇和10 μmol·L-1PI3K抑制剂LY294002共同处理4 h,再加入30 mmol·L-1高糖孵育8 h)。
2.2 MTT法检测细胞活力
将细胞以1×105个/mL接种于96孔培养板中。按本实验设计的分组及给药方法培养后,去上清液,每孔加入新鲜培养液90 μL、MTT 10 μL(5 g·L-1),培养4 h;然后弃上清液,每孔加入100 μL DMSO,摇床中振摇15 min后,在酶标仪492 nm波长处测定吸光度值。根据每组细胞的吸光度(A)值计算细胞活力。
2.3 流式细胞术检测细胞凋亡变化
按实验设计处理各细胞组后,消化、离心、收集细胞。用PBS洗涤2次,调整细胞密度为5×105个/L。按照Annexin-V/PI细胞凋亡检测试剂盒说明,在每组细胞中加入5 μL的Annexin-V及10 μL的PI,反应15 min,加入300 μL缓冲液,1 h内用流式细胞仪检测各组细胞的凋亡率。Q1:坏死细胞比例;Q2:晚期细胞凋亡比例;Q3:正常细胞比例;Q4:早期细胞凋亡比例。其中总凋亡率=Q2+Q4。
2.4 DHE荧光探针检测肾小管上皮细胞中ROS的变化
根据文献中的方法[9],将肾小管上皮细胞以1×105个/孔密度接种于6孔板中。分组、给药同上,24 h后弃去上清液,PBS洗3次,加入10 μmol·L-1的DHE,37 ℃孵育30 min,在荧光显微镜下观察、拍照。使用Imge-pro plus 6软件分析,结果以荧光强度表示。
2.5 JC-1检测线粒体跨膜电位(MMP)
将肾小管上皮细胞接种到24孔细胞培养板中。实验分5组:空白对照组、模型组、白藜芦醇组(浓度为5、10 μmol·L-1)、PI3K抑制剂组。细胞培养和处理方法同2.1,培养结束后,加入1 mL的JC-1染色工作液(5 mg·L-1),在细胞培养箱中于37 ℃温育20 min,然后用JC-1染色缓冲液洗涤两次,同时加入细胞培养液。利用倒置荧光显微镜观察荧光,测量红色和绿色荧光强度以了解细胞线粒体膜电位(ΔΨM)的变化。正常线粒体显示红色荧光,当ΔΨM降低时,显示绿色荧光。使用Imge-pro plus 6.0软件分析。聚集体和单体JC-1的比例用于量化线粒体膜电位的变化。
2.6 肾小管上皮细胞抗氧化指标测定
收集各组细胞上清液,按照试剂盒说明书检测LDH、MDA、SOD、GSH-PX含量变化。
2.7 免疫印迹法(Western-blot)测定蛋白表达
按实验设计处理细胞后,弃去上清液,收集各组细胞置于裂解液(RIPA+1 mmol·L-1PMSF)中(4 ℃)。各组的样本蛋白浓度通过BCA蛋白定量测定肾小管上皮细胞中的蛋白浓度。添加5×的上样缓冲液,在沸水中放置4 min。40 μg蛋白在8%~12% SDS-PAGE中,85 V的条件下2 h,然后通过半干转转膜15 V、20 min,转至PVDF膜上。PVDF膜在1%BSA中室温封闭2 h。添加一抗p-Akt、Akt、CYT-C、Caspase-3一抗(1∶1000),4 ℃过夜。TBST清洗3次,每次5 min。PVDF膜在室温下孵育二抗2 h。TBST清洗3次,每次5 min。通过ECL显影液进行显影。
2.8 统计学分析
3 结果
3.1 白藜芦醇对高糖作用后肾小管上皮细胞活力的影响
MTT检测发现,与空白对照组相比,高糖损伤组活力显著降低(P<0.01),而白藜芦醇组细胞活力明显上升(P<0.01)。LY294002组结果与白藜芦醇高浓度组相反(P<0.01)。实验结果说明白藜芦醇可以增强肾小管上皮细胞的活力,而LY294002能阻止这种效果(见表1)。
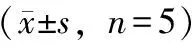
表1 白藜芦醇对细胞活力的影响
注:与模型组比较,*P<0.05,**P<0.01;与白藜芦醇高浓度组比较,##P<0.01,下同。
3.2 白藜芦醇对高糖作用后肾小管上皮细胞凋亡的影响
流式细胞术检测发现,高糖损伤组细胞凋亡率明显升高(P<0.01,与对照组比较);而不同浓度的白藜芦醇组细胞凋亡率显著下降(P<0.01);PI3K抑制剂组结果与白藜芦醇高浓度组相反(P<0.01);说明白藜芦醇能减少高糖作用后肾小管上皮细胞的凋亡率,而LY294002能阻止这种效果(见图1、表2)。

图1 白藜芦醇对高糖作用后肾小管上皮细胞凋亡率的影响
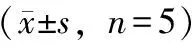
表2 白藜芦醇对细胞凋亡率的影响
3.3 白藜芦醇对高糖作用后肾小管上皮细胞ROS的影响
DHE荧光探针检测显示,高糖损伤组肾小管上皮细胞ROS显著升高(P<0.01),而白藜芦醇组ROS含量则明显降低(P<0.01),PI3K抑制剂组结果与白藜芦醇高浓度组相反(P<0.01)。实验表明,白藜芦醇可以在高糖作用后减少肾小管上皮细胞中ROS的产生,而LY294002可以阻止这种作用(见图2,表3)。

图2 白藜芦醇对高糖作用后肾小管上皮细胞的ROS影响
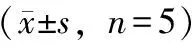
表3 白藜芦醇对细胞ROS的影响
3.4 白藜芦醇对高糖作用后肾小管上皮细胞线粒体膜电位(MMP)的影响
JC-1检测白藜芦醇对高糖作用后肾小管上皮细胞线粒体膜电位的变化检测发现,与对照组相比,模型组(高糖损伤组)肾小管上皮细胞线粒体膜电位显著下降(P<0.01);而不同浓度白藜芦醇组细胞线粒体膜电位随浓度梯度逐渐上升(P<0.01);PI3K抑制剂组与白藜芦醇组结果相反(P<0.01)(见图3、表4)。
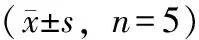
表4 白藜芦醇对肾小管上皮细胞膜电位(MMP)的影响
3.5 白藜芦醇对高糖作用后肾小管上皮细胞LDH、MDA、SOD和GSH-PX的影响
经检测发现,高糖损伤组LDH、MDA含量显著增加,SOD、GSH-PX活性显著下降(与对照组相比,P<0.01);白藜芦醇具有改善细胞抗氧化能力,各组LDH、MDA含量逐渐下降,SOD、GSH-PX活性逐渐上升(P<0.01)。PI3K抑制剂组结果与高浓度白藜芦醇组相反(P<0.01)(见表5)。
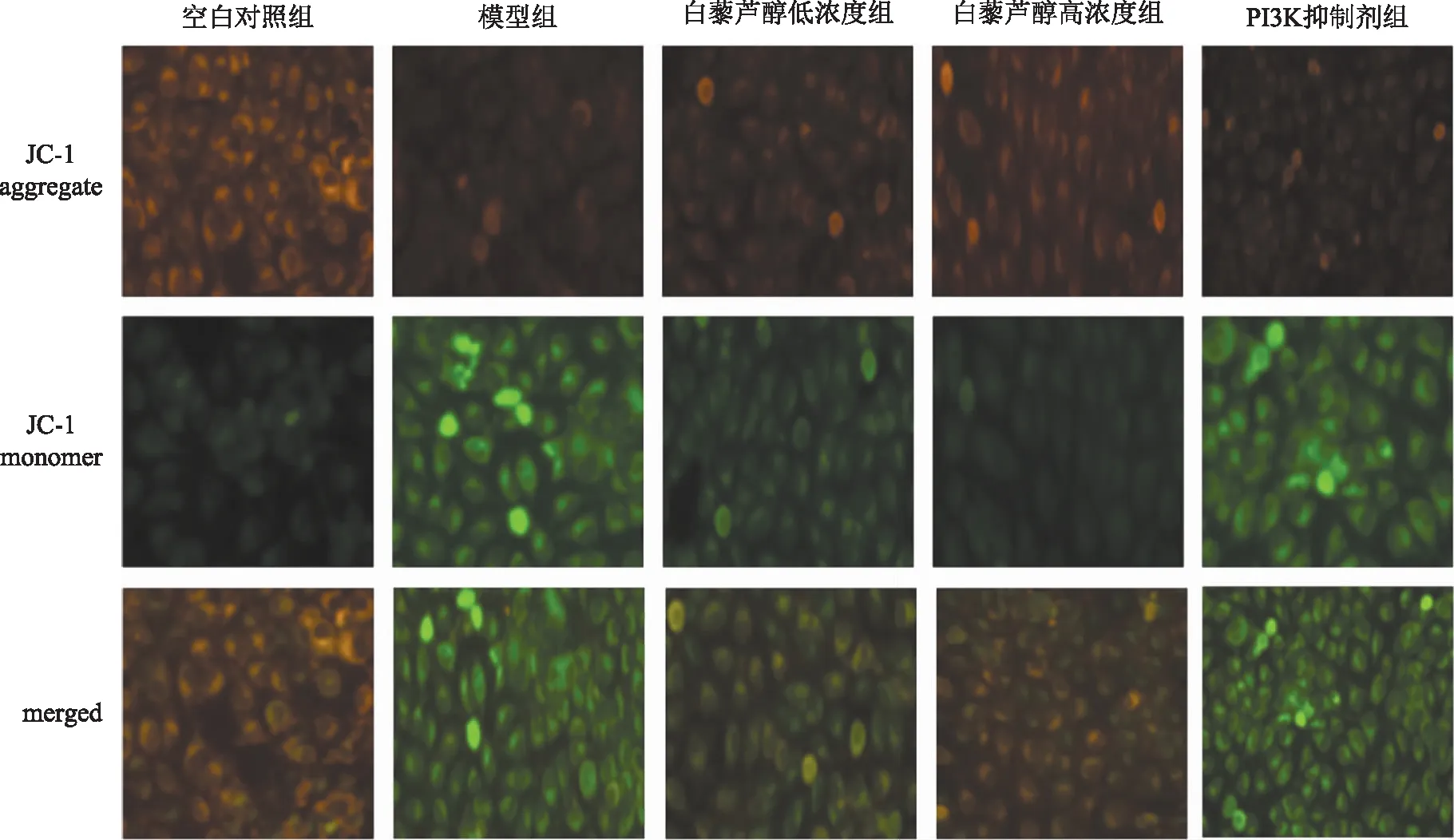
图3 白藜芦醇对高糖作用后肾小管上皮细胞线粒体膜电位的影响
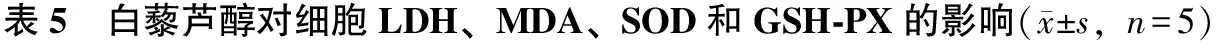

分组剂量/μmol·L-1LDH/U·L-1MDA/nmol·mg-1SOD/U·mg-1GSH-PX/U·mg-1空白对照组252.8±44.7∗∗2.13±0.23∗∗38.1±2.2∗∗146.1±16.3∗∗高糖损伤组(模型组)30974.5±129.14.49±0.2814.3±1.462.5±12.9白藜芦醇低浓度组5727.6±164.4∗3.65±0.34∗22.7±3.5∗85.4±13.4∗白藜芦醇高浓度组10478.2±175.8∗∗2.66±0.17∗∗34.5±4.1∗∗116.7±18.2∗∗PI3K抑制剂组10+10955.3±156.9##4.37±0.25##15.2±1.7##61.2±10.7##
3.6 白藜芦醇对高糖作用后肾小管上皮细胞CYT-C、Caspase-3、p-Akt/Akt蛋白表达的影响
Western-blot分析显示,模型组肾小管上皮细胞中p-Akt/Akt的表达显著低于空白对照组(P<0.01)。白藜芦醇恢复了细胞p-Akt/Akt的表达(P<0.01),抑制剂发挥效应,阻止这种作用。模型组中CYT-C、Caspase-3的表达升高,白藜芦醇可以降低CYT-C、Caspase-3的表达(P<0.01),PI3K抑制剂组结果与之相反。提示白藜芦醇可能通过上调p-Akt/Akt的表达来降低CYT-C、Caspase-3的表达,而LY294002可以阻止这种作用。因此,白藜芦醇抑制氧化应激及其诱导凋亡的机制与PI3K/Akt通路密切相关(见图4、表6)。
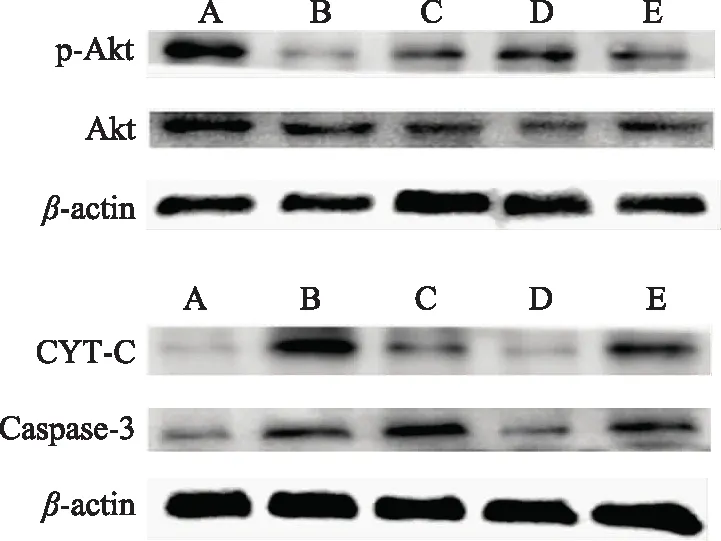
注:A.空白对照组;B.模型组;C.白藜芦醇低浓度组;D.白藜芦醇高浓度组;E.PI3K抑制剂组。图4 白藜芦醇对高糖作用后肾小管上皮细胞中CYT-C、Caspase-3、p-Akt/Akt蛋白表达的影响
4 讨论
糖尿病已成为全球主要的公共卫生问题之一。在中国,糖尿病在成年人中的患病率达到了10.9%。DN是糖尿病的常见慢性微血管并发症,也是终末期肾病的重要原因。同时,糖尿病患者大约40%有DN。肾小球结构肥大、肾小球基底膜增厚、系膜细胞增生、肾小管间质扩张以及细胞外基质(ECM)成分(如胶原和纤维连接蛋白)的异常积聚是DN的主要病理特征。胶原纤维的增加是肾纤维化的主要特征。在此过程中,肾脏经历过多的胶原沉积,导致肾实质逐渐硬化和瘢痕形成,最终导致肾功能完全丧失[10]。本研究在体外培养大鼠肾小管上皮细胞,发现用高糖刺激能明显增加肾小管上皮细胞的凋亡。氧化应激被认为是糖尿病肾病共同的发病途径[11]。
糖尿病肾病的发生发展中,活性氧扮演着重要角色[12]。有报道指出,氧化应激引起的肾小管上皮细胞凋亡,活性氧在其中发挥关键作用[13]。在高糖环境下ROS产生过多,会导致核酸断裂、酶失活、多糖解聚、脂质过氧化和许多其他破坏性过程,最终会导致细胞凋亡。本实验中,白藜芦醇降低了高糖作用后肾小管上皮细胞ROS含量。LDH、MDA、SOD、GSH-PX代表着细胞的氧化应激的水平。本实验中,模型组LDH和MDA升高,而不同浓度的白藜芦醇组LDH和MDA含量逐渐下降,证明白藜芦醇可以减少细胞氧化应激。
PI3K/Akt途径是细胞周期过程中非常重要的细胞内信号传导途径。它与细胞静止、增殖、癌症和长寿等有关[14]。PI3K活化磷酸化并进一步激活Akt,Akt定位于细胞膜。活化的Akt具有多种生物学功能,包括激活cAMP反应元件结合蛋白,抑制p27,在细胞质中定位叉头盒蛋白O(FOXO),激活磷脂酰肌醇3-磷酸(PtdIns3ps或PI3P)和激活哺乳动物雷帕霉素靶蛋白(mTOR)。已经确定PI3K/Akt途径可以通过几种生物分子增强,包括表皮生长因子(EGF)、胰岛素样生长因子(IGF)-1和胰岛素钙调蛋白。相反,该途径被其他分子拮抗,包括PTEN、糖原合成酶激酶3β和转录因子HB9。PI3Ks是脂质激酶家族,通过磷脂酰肌醇(PI)的特异性催化3-羟基磷酸化产生第二信使[15]。PI3K/Akt信号途径的磷酸化作用生成p-Akt而被激活,抵抗细胞的氧化应激损伤[16]。在我们的研究中,白藜芦醇激活PI3K/Akt通路,这是抑制氧化应激及其介导的细胞凋亡的潜在机制。
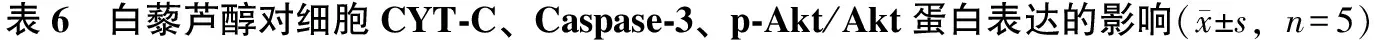
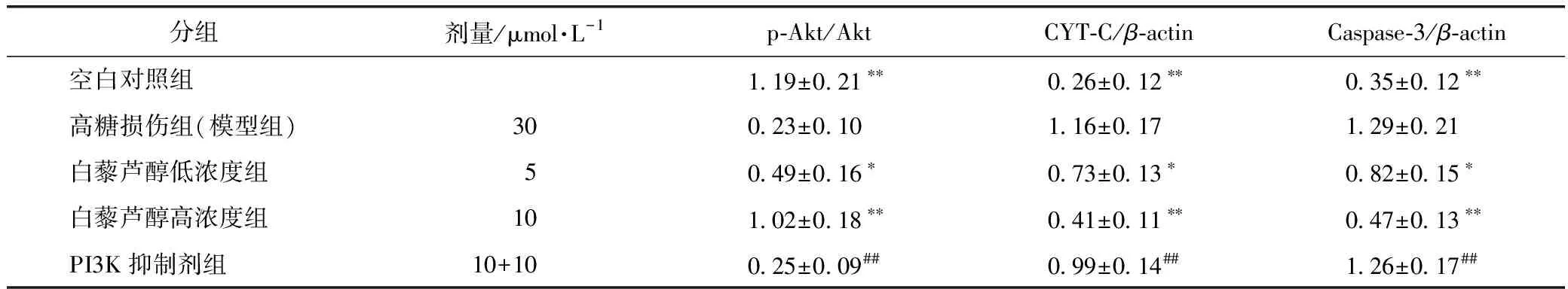
分组剂量/μmol·L-1p-Akt/AktCYT-C/β-actinCaspase-3/β-actin空白对照组1.19±0.21∗∗0.26±0.12∗∗0.35±0.12∗∗高糖损伤组(模型组)300.23±0.101.16±0.171.29±0.21白藜芦醇低浓度组50.49±0.16∗0.73±0.13∗0.82±0.15∗白藜芦醇高浓度组101.02±0.18∗∗0.41±0.11∗∗0.47±0.13∗∗PI3K抑制剂组10+100.25±0.09##0.99±0.14##1.26±0.17##
综上所述,白藜芦醇部分可能通过激活PI3K/Akt通路抑制了高糖介导的肾小管上皮细胞氧化损伤及凋亡。

