依帕司他对糖尿病周围神经病变患者同型半胱氨酸和多伦多临床评分的影响
彭少林,杨水冰,沙永红,杨井金1,,张美彪1,*
(1怀化市第一人民医院内分泌代谢科,国家代谢性疾病临床医学研究中心怀化分中心,怀化 418000;2吉首大学医学院临床医学系,吉首 416000)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病慢性并发症之一,研究表明新诊断2型糖尿病患者中DPN的发生率为10%~15%,病程>10年的的发生率为50%[1]。血清同型半胱氨酸(homocysteine,Hcy)水平升高是DPN重要的危险因素,影响疾病的发展与转归[2]。而依帕司他是一种治疗DPN的药物,它可抑制醛糖还原酶,疗效和安全性较好。目前关于依帕司他对DPN的研究主要集中在神经传导速度、症状及体征方面,较少涉及对Hcy的影响。本研究对采用依帕司他治疗前后患者血清Hcy水平及多伦多临床评分系统(Toronto clinical scoring system,TCSS)变化进行了比较,以探讨其可能机制,旨在为DPN患者的药物治疗提供依据。
1 对象与方法
1.1 研究对象
入选2016年4月至2017年4月怀化市第一人民医院内分泌代谢科2型糖尿病患者97例,随机数表法分为依帕司他组(n=33)、依帕司他联合甲钴胺组(n=30)和甲钴胺组(n=34)。纳入标准:符合世界卫生组织糖尿病及DPN诊断标准[3]。排除标准:颈腰椎疾病(如神经根压迫、椎管狭窄);脑血管疾病后遗症(如脑卒中);药物、手术及其他代谢疾病;格林-巴利综合征;严重心肝肾功能障碍;严重动静脉血管性病变;恶性肿瘤;妊娠;过敏;近1个月使用依帕司他和甲钴胺;使用大剂量糖皮质激素;精神、行为异常不能完成本研究。研究经我院伦理委员会批准,研究对象均签署知情同意书。
1.2 方法
甲钴胺组:基础治疗的同时口服甲钴胺片(扬子江药业集团南京海陵药业有限公司,国药准字:H20052325),0.5 mg/次,3次/d。依帕司他联合甲钴胺组:甲钴胺片用法同甲钴胺组,同时口服依帕司他片(扬子江药业集团南京海陵药业有限公司,国药准字:H20040840),50 mg/次,3次/d。依帕司他组:基础治疗的同时口服依帕司他片,依帕司他片的用法同上。3组患者的治疗周期为3个月。
1.3 观察指标
临床指标检测:禁食8 h,空腹取2 ml肘静脉血,离心后用美国BECKMAN DXC 800全自动生化分析仪测空腹血糖(fasting blood glucose,FBG)、餐后2小时血糖(2 h postprandial blood glucose,2hPBG)、糖化血红蛋白(glycosylated hemoglobin Alc,HbA1c)、血脂、肝肾功能和Hcy等。
神经症状评分:采用TCSS进行评分。TCSS包括神经症状、神经反射和感觉功能检查评分,总分19分,6~8分为轻度DPN,9~11分为中度DPN,12~19分为重度DPN[4]。评分由同一名医师进行,记录治疗前后各组变化情况。
1.4 统计学处理

2 结 果
2.1 3组患者基线资料比较
3组患者性别、年龄、糖尿病病程、血压和血脂等差异均无统计学意义(P>0.05;表1)。
2.2 3组患者治疗前后血糖水平比较
相比治疗前,3组患者治疗后FBG、2hPBG、HbA1c水平均下降,但差异无统计学意义(P>0.05)。3组患者治疗前后FBG、2hPBG、HbA1c水平组间差异无统计学意义(P>0.05;表2)。
2.3 3组患者治疗前后Hcy和TCSS水平比较
3组患者治疗前Hcy和TCSS水平差异无统计学意义(P>0.05)。相比治疗前,3组患者治疗后Hcy水平下降,依帕司他组和依帕司他联合甲钴胺组TCSS评分下降,差异有统计学意义(P<0.05)。依帕司他联合甲钴胺组相比依帕司他组和甲钴胺组治疗后Hcy和TCSS水平低,差异有统计学意义(P<0.05;表3)。
2.4 不良反应情况
依帕司他组2例患者服药当天出现腹泻,减量服药2 d后自行好转;依帕司他联合甲钴胺组中2例患者服药1 d出现恶心和干呕,1 d后症状消失;甲钴胺组未出现不良反应,3组患者不良反应发生率差异无统计学意义(P>0.05)。
3 讨 论
DPN发生机制较复杂。研究显示高血糖应激状态、脂质代谢异常、代谢性炎症、胰岛素抵抗都可导致DPN发生[5]。机体在醛糖还原酶作用下激活多元醇代谢通路是糖尿病多种慢性并发症产生的基础,而依帕司他是醛糖还原酶抑制剂,能够有效抑制该酶活性,从而阻断这一通路,降低山梨醇和果糖在机体内的浓度,提高Na+-K+-ATP酶活性,从而恢复内皮细胞功能,提高神经细胞传导速度,改善患者麻木、疼痛等症状[6,7]。李平等[8]研究表明,经过4~12周依帕司他治疗,DPN患者的神经病变症状、体征及神经传导速度均有一定程度改善。TCSS是用于诊断及评估DPN患者的非创伤性手段,与DPN诊断金标准肌电图相比无创伤,且敏感性及特异性均高[4,9]。本研究以TCSS评分作为评估手段,结果表明依帕司他治疗后患者TCSS评分明显降低,联合甲钴胺评分下降更显著,提示联合治疗效果好。但治疗前患者的TCSS评分均较高,考虑与DPN患者病程长、当地经济发展滞后、居民健康意识薄弱、疾病诊疗水平不高有关。
研究显示Hcy与微血管、神经病变关系密切,可用于神经病变的监测[10,11]。高水平Hcy在代谢时产生活性氧簇,可直接导致血管内皮细胞功能损伤,从而使舒血管因子如一氧化氮、前列环素等水平减少,致使神经血管内膜舒张功能障碍,局部血流缺乏而致神经受损[12]。同时,通过甲基化方式代谢的关键维生素如维生素B6、维生素B12等也会受高水平Hcy影响致吸收障碍,导致神经病变[13]。本研究发现,治疗前DPN患者Hcy处于较高水平,治疗后无论是甲钴胺、依帕司他单药组,还是依帕司他联合甲钴胺治疗组,Hcy水平均较治疗前降低且存在统计学差异,联合治疗较其余两组更显著。我们推测依帕司他可能通过抑制氧化应激方式减轻糖尿病个体的氧化应激来降低Hcy水平。同时甲钴胺是一种内源性维生素B12,参与核酸及蛋白质合成,外源性补充后水平提高,可促进Hcy代谢而降低其水平。此外,高水平Hcy在血管内皮细胞中堆积,可直接作用于神经细胞突触连接处,使神经递质释放受阻、神经发生脱髓鞘病变、神经细胞功能受损,对神经细胞产生直接的毒性作用[14]。
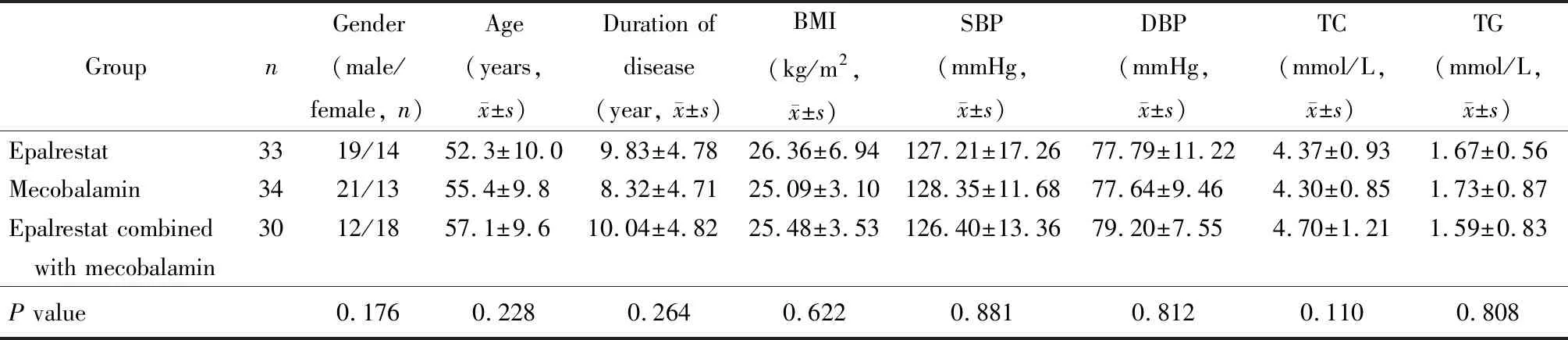
表1 3组患者基线资料比较
BMI: body mass index; SBP: systolic blood pressure; DBP: diastolic blood pressure; TC: total cholesterol; TG: triglycerides. 1 mmHg=0.133 kPa.

表2 3组患者治疗前后FBG, 2hPBG和HbA1c比较
FBG: fasting blood glucose; 2hPBG: 2 h postprandial blood glucose; HbA1c: glycosylated hemoglobin Alc.

表3 3组患者治疗前后Hcy和TCSS水平比较
Hcy: homocysteine; TCSS: Toronto clinical scoring system. Compared with before treatment,*P<0.05; compared with epalrestat and mecobalamin group,#P<0.05.
综上所述,依帕司他能够降低DPN患者血清Hcy水平,其可能通过抑制氧化应激修复神经损伤。但本研究并未进一步检测氧化应激相关指标,需进行完善。同时,我们发现依帕司他联合甲钴胺能显著降低TCSS评分,明显缓解患者的神经症状与体征。本研究样本数量少,观察周期较短,长久疗效还需大样本、长时间观察。

