模糊控制在射频消融温度与阻抗监测系统中的应用
成志新,孟辉,刘传永,王大鹏,金振华,李博
(1.山东省药学科学院,济南250101;2.山东微感光电子有限公司,济南250014)
1 引 言
近年来,采用射频热疗的方法治疗肿瘤,在临床上取得了较好的效果。射频消融是一种加热治疗肿瘤的微创治疗技术,利用一定频率的射频加热,使得肿瘤温度短时间内快速升高,肿瘤组织凝固性坏死[1]。
温度的精确控制对于射频消融疗效至关重要,温度达到50~65℃才能实现有效治疗。温度过低,达不到治疗效果,导致癌细胞扩散;温度过高,会杀死正常细胞,甚至引起组织炭化,造成正常组织的不可逆损伤[2]。大量实验发现,肿瘤组织温度和阻抗之间具有耦合性。治疗过程中,随着射频能量的增加,组织温度升高,肿瘤细胞热凝固程度不断加剧,病灶组织因水份减少而炭化,导致阻抗加大;组织阻抗增高过快时,为防止组织汽化结碳影响消融范围,需要降低射频能量,这样也势必导致组织温度下降[3]。
现有的射频消融设备一般采用独立的温度或阻抗控制方式,忽略了两者的相互影响和耦合关系。我们将温度和阻抗两种监测方法结合起来,通过对射频输出功率的智能控制,使治疗过程中温度和阻抗处于稳定状态,在最短时间内得到最大范围的肿瘤消融区。
人体组织在结构、性质上相差很大,治疗过程中组织形态也不断改变,很难建立较为精确的数学模型;而且生物组织导热性能较弱,对温度的控制属于大迟滞系统,经典的PID控制具有一定局限性[4]。由于在离体实验及临床医学中,积累了大量数据可以作为专家经验库,针对受控对象的复杂性与动态性,系统选用模糊控制算法对温度和阻抗进行控制[5],确保对肿瘤病灶进行均匀、平稳的射频加热。
2 温度及阻抗检测
2.1 系统总体结构
射频消融系统由单片机控制器、射频功率源、电极针、阻抗检测、光纤光栅测温等部分组成,总体结构见图1。
光纤光栅测温及阻抗检测作为监测核心,实时测量肿瘤组织的温度及阻抗变化,通过单片机控制系统的模糊控制器,对射频输出功率进行控制,确保温度和阻抗处于稳定状态。
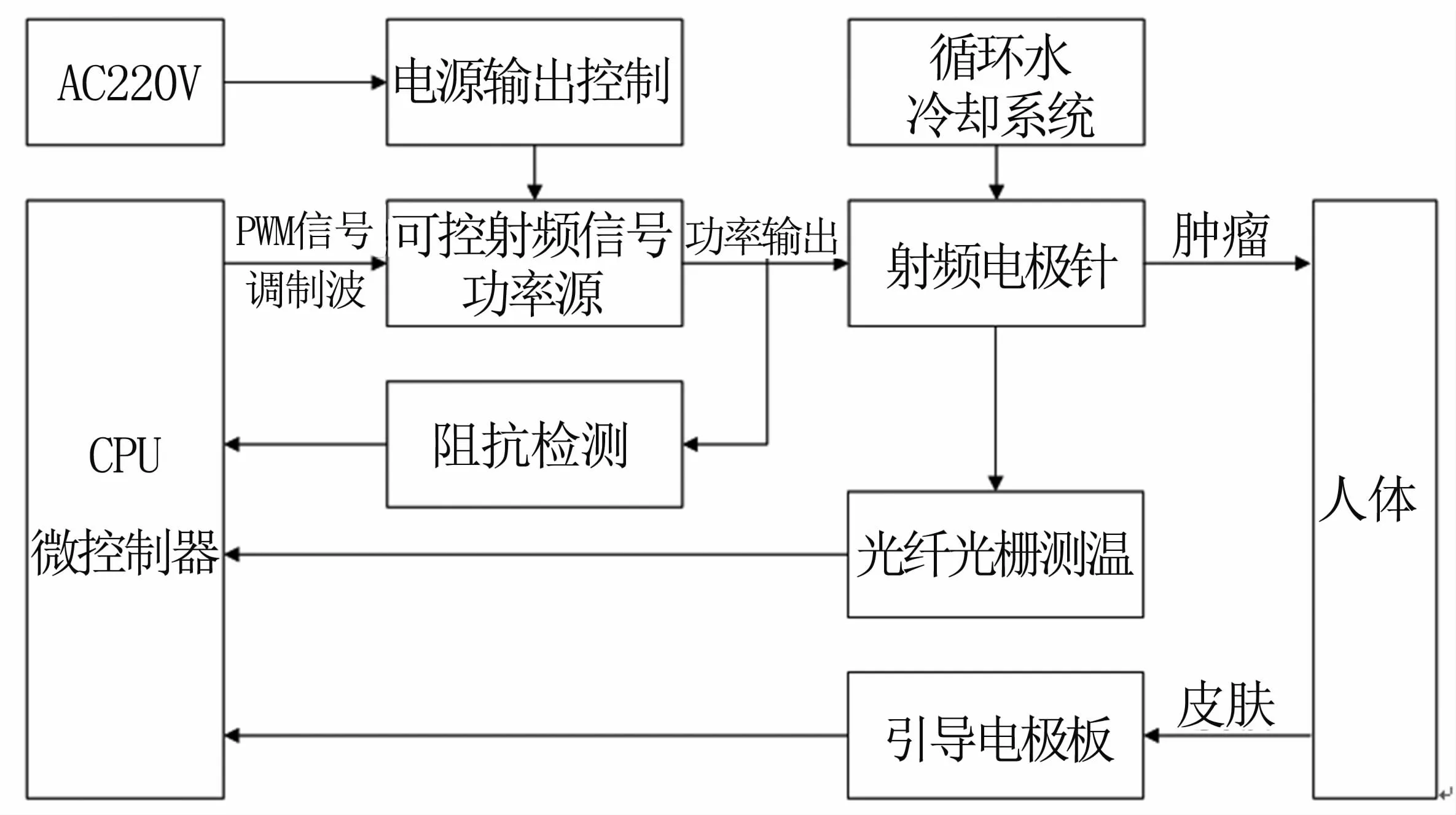
图1 系统总体结构Fig 1 General structure of system
2.2 温度测量
现有的射频消融设备大多采用热电阻、热电偶测量温度,但二者均为导体材料,且通过金属导线传输信号,绝缘性能和抗电磁干扰能力较弱[6]。
光纤光栅温度传感器由非导电性的二氧化硅与聚酰亚胺等材料制成,具有体积小、抗电磁干扰等优点[7]。光纤光栅温度传感器可以在不关闭射频输出的情况下,实时测量肿瘤组织温度,加热效率更高。
当测量端的温度改变时,光纤光栅反射光的中心波长漂移量与温度变化呈现出良好的线性关系,通过中心波长的漂移量便可以获得测量点的温度[8]。光纤光栅温度传感器测量温度的重点是利用光纤光栅解调仪解调出中心波长,系统选用山东微感光电子开发的光纤光栅温度传感器和光纤光栅多点温度解调仪测量组织温度,测温精度达到±0.3℃,满足射频消融系统的精度要求。
2.3 温度测量
系统通过测量治疗过程中人体组织的相对电压和相对电流,经过计算得到阻抗值。为避免大功率射频信号对测量系统造成干扰,系统采用电阻采样、互感器隔离的方式,将电压、电流耦合至测量系统,该方式信号失真小、不损耗被测电路能量[9]。电压、电流采样电路见图2。
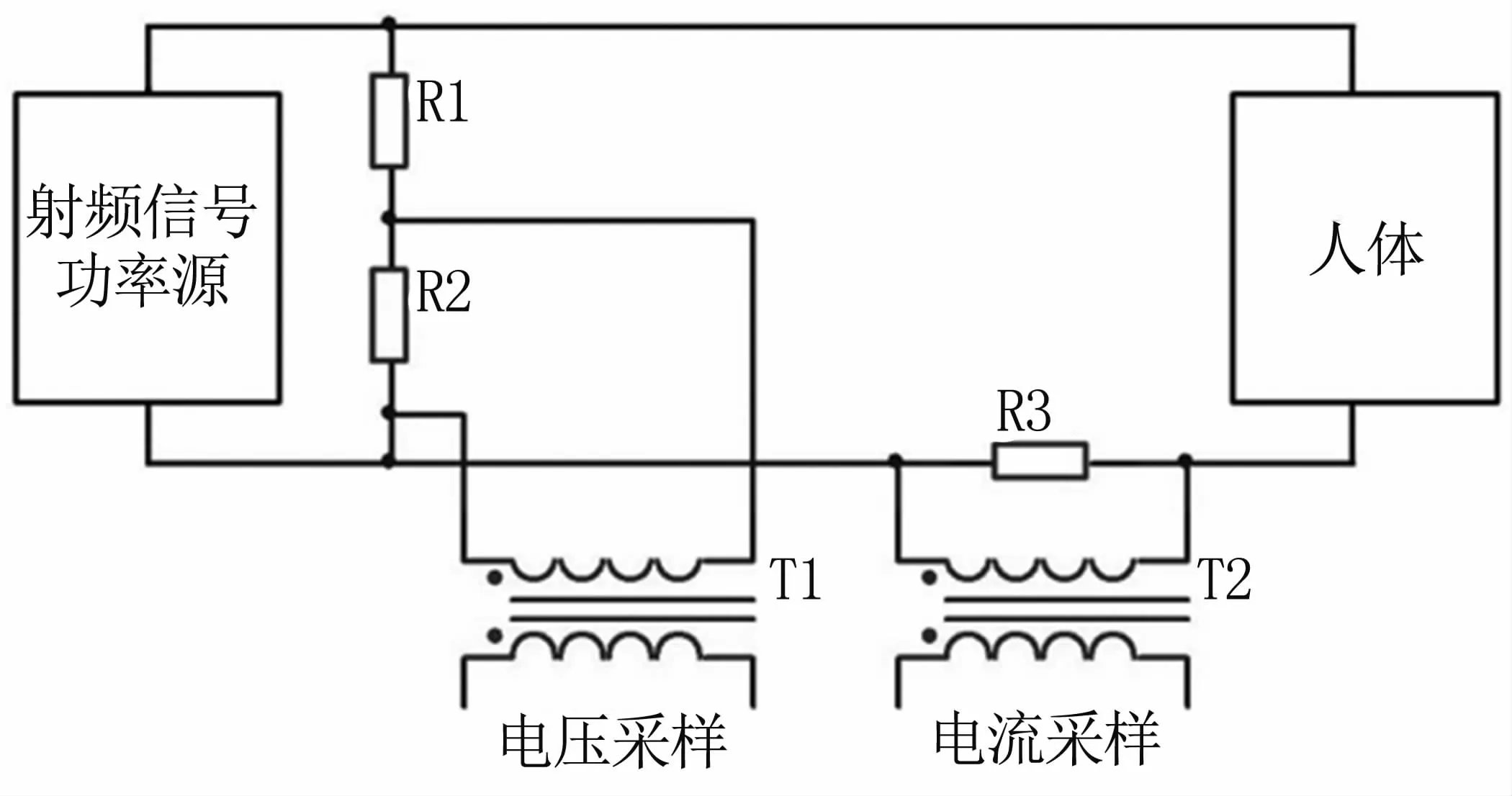
图2 电压和电流采样电路Fig 2 Voltage and current sampling circuit
系统测得的电压和电流信号,经过放大、滤波及A/D转换后输入单片机,通过电压、电流与阻抗的标定关系式,得到人体组织的阻抗值。
3 单片机模糊控制器设计
温度及阻抗控制是一种时变的复杂过程,为了在最短时间内得到最大范围的消融区,系统采用两个阶段对加温过程进行控制。第一阶段主要是在阈值范围之外,以设定的射频输出功率,确保组织温度在短时间内快速上升;第二个阶段采用模糊控制的方法,确保温度和阻抗平稳可靠地接近目标值[10]。温度模糊控制范围设定为温度偏差值-4~4℃,阻抗模糊控制范围设定为阻抗偏差值0~9Ω。
3.1 模糊控制系统结构
温度和阻抗模糊控制器的设计主要是根据理论知识和临床医学中获得的实用数据,建立针对温度和阻抗控制的模糊规则表,利用模糊工具使其定量化,转化为模糊控制算法[11]。模糊控制器将实际测得的温度值、阻抗值与目标值进行对比,根据偏差大小和偏差变化率,利用模糊控制算法得到相应的控制输出量,通过控制射频输出功率,将温度和阻抗值维持在目标值范围内。温度和阻抗模糊控制系统的工作原理见图3。
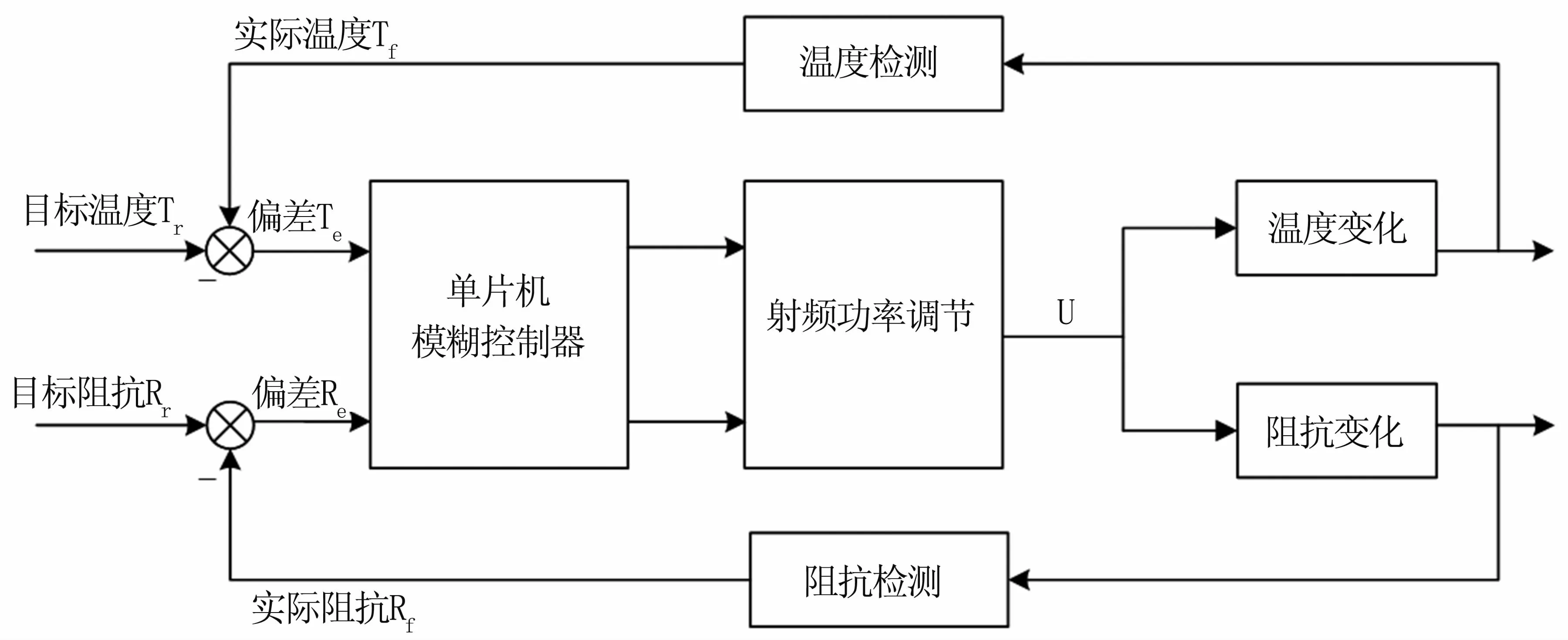
图3 温度和阻抗模糊控制系统Fig 3 Temperature and impedance fuzzy control system
模糊控制器的输入变量包括:Te、△Te、Re、△Re。其中,Te、△Te分别为肿瘤组织处的温度值与目标值的偏差、偏差随时间的变化率;Re、△Re分别为肿瘤组织处阻抗与目标阻抗的偏差、偏差随时间的变化率。
模糊控制器的输出变量为射频功率控制输出U。经过模糊推理,按规则调节输出信号的占空比,改变射频输出功率,从而实现对温度和阻抗的调节。模糊控制器的核心是使系统输出的动态和静态响应特性最佳[5],当温度、阻抗测量值与目标值偏差较大时,控制输出以尽快消除偏差为主;当偏差较小时,控制输出以保持系统稳定、防止超调、避免振荡为主。
3.2 温度与阻抗模糊控制器设计
模糊控制系统中,将温度偏差Te分为5个模糊子集,分别为负中、负小、零、正小、正中,简化表示为TE={NM,NS,Z,PS,PM},TE的论域为:{-4,-2,0,2,4}。图4为TE模糊子集的隶属函数曲线,处于设定值附近的温度值,通过隶属函数找到相应的隶属度,将温度偏差转换为模糊量。
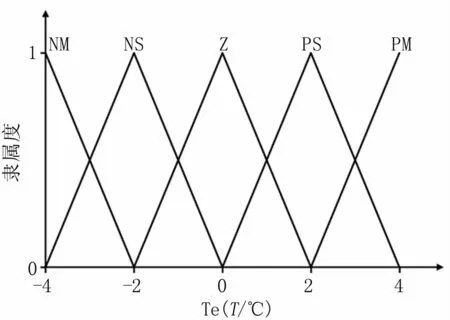
图4 Te的隶属函数Fig 4 Membership function for Te
同样将温度偏差变化率△Te分为5个模糊子集:TEC={NM,NS,Z,PS,PM},论域为:{-1,-0.5,0,0.5,1},隶属函数曲线见图5。
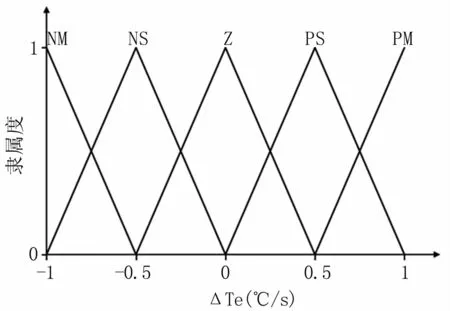
图5 △Te的隶属函数Fig 5 Membership function for△Te
一旦阻抗值大于目标值,人体组织将因凝血炭化而无法恢复正常,影响消融范围和治疗效果,因此,治疗过程中阻抗值不允许大于目标值。系统将阻抗偏差Re分为4个模糊子集:{负大、负中、负小、零},简化表示为 RE={NB,NM,NS,Z},论域为:{-9,-6,-3,0},隶属函数曲线见图6。
阻抗偏差变化率△Re划分为5个模糊子集:REC={NM,NS,Z,PS,PM}。REC的论域为:{-6,-3,0,3,6},隶属函数曲线见图7。
控制器输出状态U分为7个模糊子集:{负大2,负大1,负中2,负中1,负小2,负小1,零},简化表示为 U={NB2,NB1,NM2,NM1,NS2,NS1,Z},各输出状态对应不同占空比的射频输出信号,U的论域为:{0.2,0.4,0.6,0.7,0.8,0.9,1}。治疗过程中,如果组织温度与阻抗值均远低于目标值,则采用较大占空比,以较大的输出功率使温度迅速上升,缩短治疗时间;当温度或阻抗接近目标值时,为了防止温度上升过快或阻抗增加过快而产生大的振荡,则采用较小占空比,降低输出功率以保证温度和阻抗处在正常范围内,提高治疗效果。
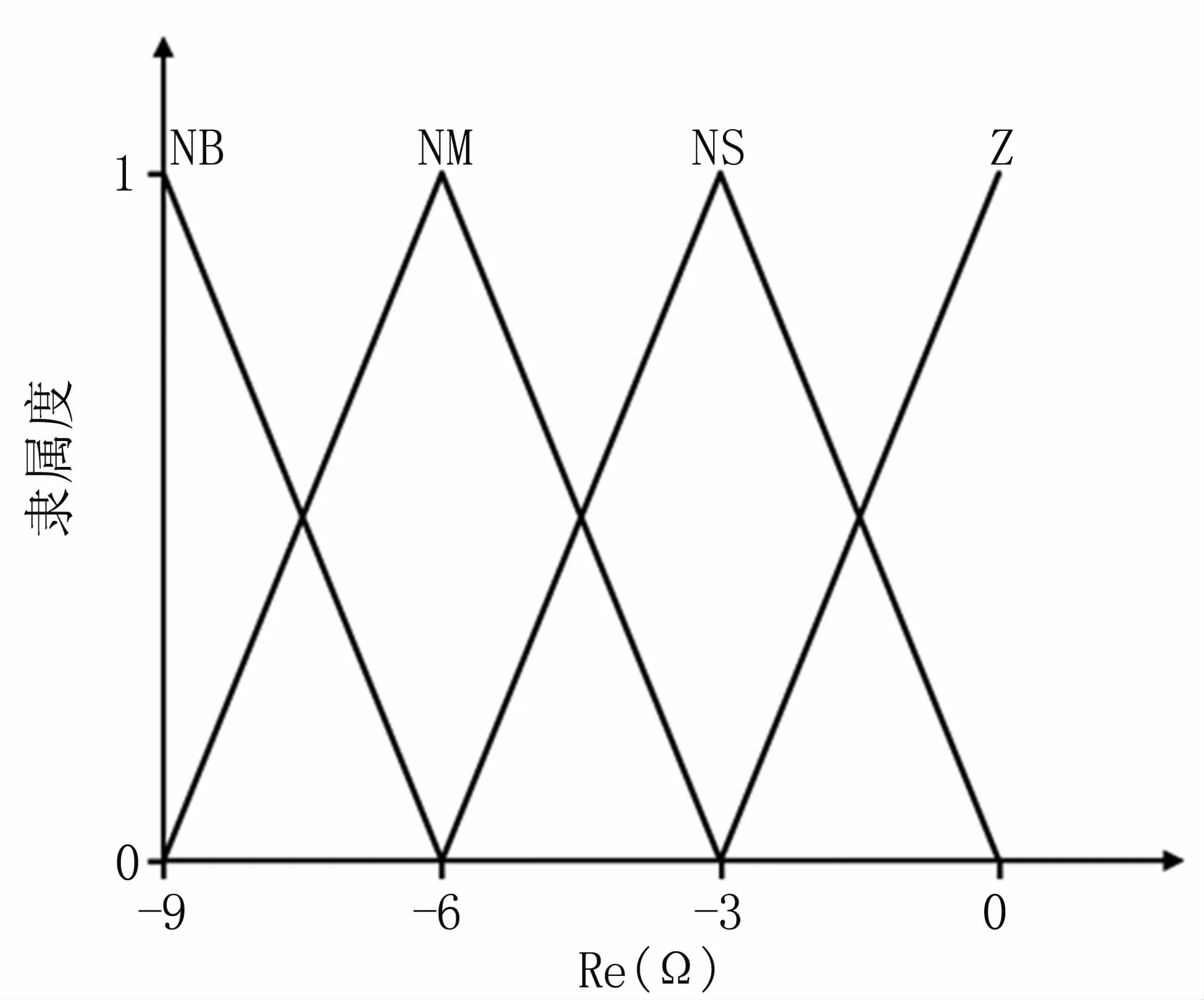
图6 Re的隶属函数Fig 6 Membership function for Re
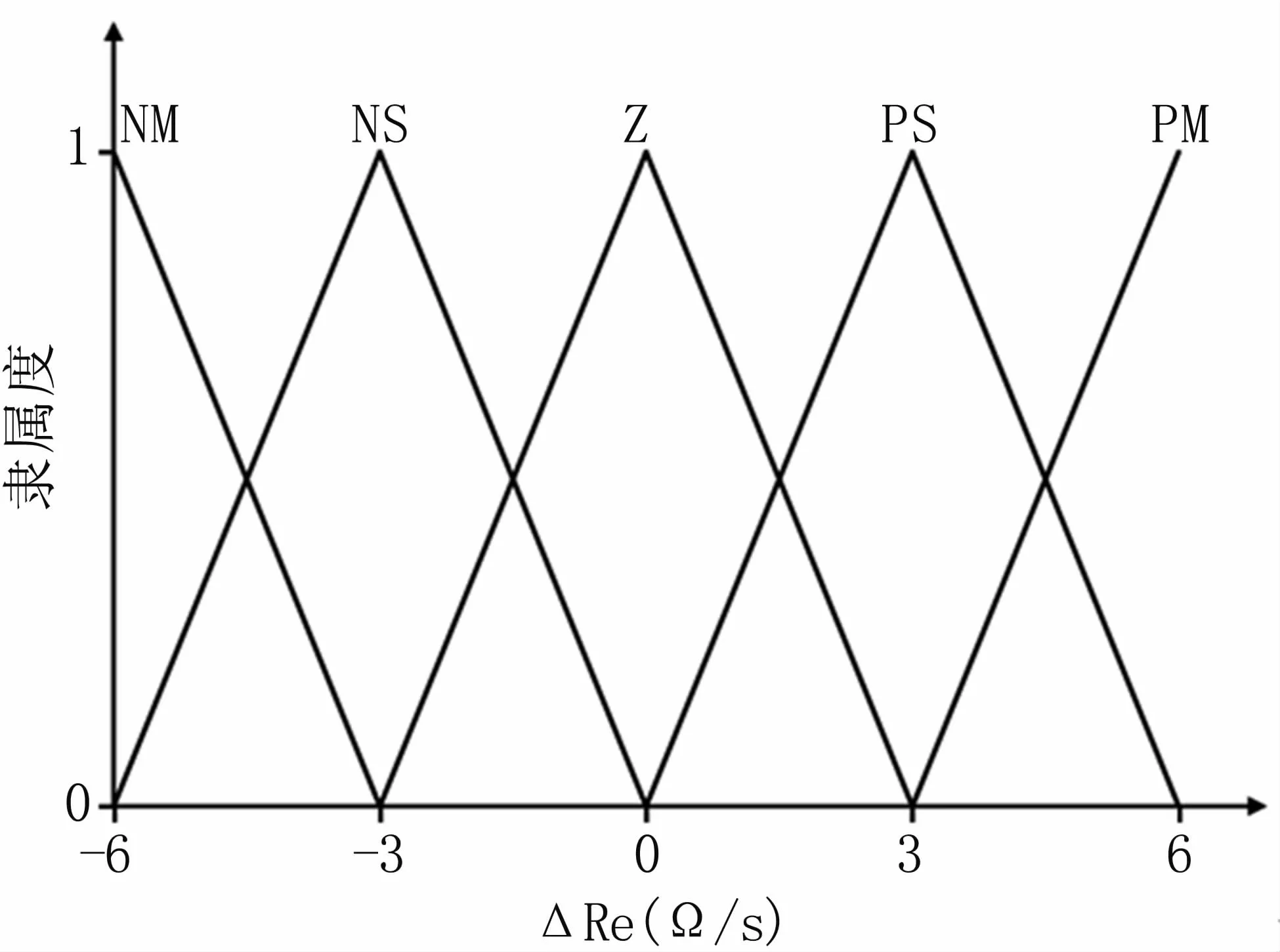
图7 △Re的隶属函数Fig 7 Membership function for△Re
3.3 模糊控制规则建立
模糊控制器有 TE、TEC、RE、REC四种输入,各输入量又分别有多种划分,所以模糊规则集合一共由500(5×5×4×5)条模糊规则构成,控制规则集结构复杂、数量庞大,需要建立一个构造合理的控制算法结构,才能减少运算时间,提高系统的稳定性和运行效率。
系统选用分层多规则集结构的形式,将控制器分解成由多个简单的规则集组成的分层结构,减少模糊控制规则的维数,简化模糊关系[12]。将温度相关参数TE、TEC作为高层全局变量,将阻抗相关参数RE、REC作为低层局部变量,模糊控制器用下面的模糊条件语句描述:
高层(判别规则集 T):if(TE=TEi and TEC=TECj),then{控制规则为 R};
低层(控制规则集 R):if(RE=REm and REC=RECn),then U=Uk。
以其中一层规则为例,可以描述为:
if(TE=NSand TEC=NM)
then{if(RE=NM and REC=PS)then U=NM1;
if(RE=NM and REC=PM)then U=NM2;……}
4 实验验证
实验过程中,将新鲜离体猪肝放置于引导电极板上,射频电极针插入猪肝主叶部位,设置治疗温度60℃,分别在模糊控制和PID控制两种方式下监测组织温度。每间隔20 s对两种控制方式下的组织温度进行一次采样,分别得到40组温度测量数据,见表1。
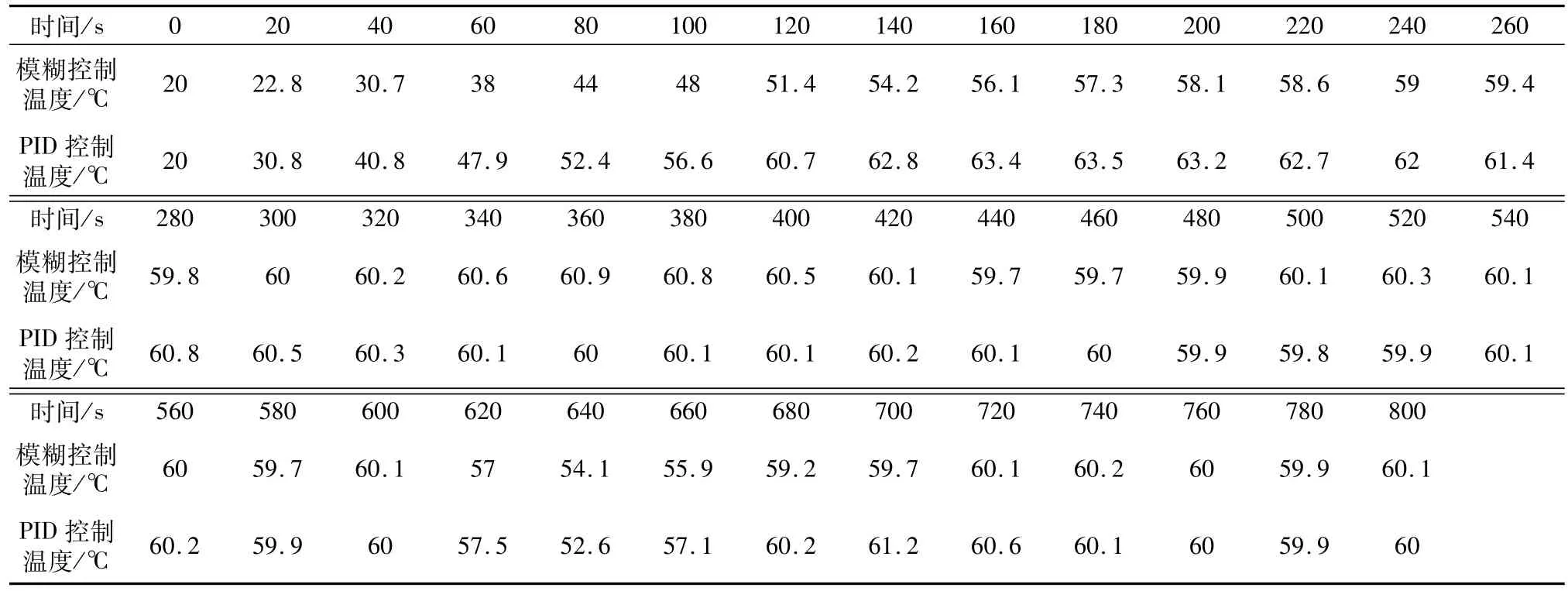
表1 模糊控制与PID控制作用下温度数据Table1 Temperature data under fuzzy control and PID control
根据测量数据绘制的模糊控制与PID控制作用下离体猪肝温升曲线,见图8。

图8 模糊控制与PID控制作用下组织温升曲线Fig 8 Temperature rising curve under fuzzy control and PID control
图8中,实线为模糊控制作用下组织温升曲线,热疗开始阶段,为了缩短到达模糊控制阈值温度的时间,射频输出功率较高,温升曲线斜率大,组织温度上升较快,可以看出,160 s内即上升至阈值温度56℃。到达阈值温度后,为了减小振荡,保证温度的稳步上升,射频输出功率较小,温升曲线斜率变小,5 min以后组织温度与目标温度的误差在1℃以内。整个模糊控制过程中,温度最大超调量为1℃,稳态精度为±0.4℃,升温比较平稳,温度波动小。
虚线为PID控制下组织温升曲线,120 s内温度即上升至目标温度60℃,但最大超调量达到3℃,虽然升温速度优于模糊控制系统,但过大的超调量影响了系统的稳定性。
治疗进行到600 s时,将电极针拔出较小距离,加入干扰信号,可以看出,模糊控制系统能更加平稳地将组织温度快速收敛至目标温度,且超调量小。
实验结果表明,与PID控制系统相比,模糊控制系统稳态性能好,具有较小的超调量,满足射频系统的温度控制精度。
模糊控制作用下,离体猪肝阻抗值初始时约为52Ω,治疗开始的前2 min略有下降,约降至42Ω,治疗7 min后阻抗值稳定在56Ω左右,实验结果表明,阻抗控制稳定性较好。
5 总结
针对肿瘤组织温度和阻抗的测量与精确控制在射频消融治疗系统中的重要性,我们设计了基于模糊控制的温度和阻抗监测系统,实时监测和控制射频热疗过程中肿瘤组织的温度和阻抗变化。系统采用光纤光栅温度传感器测量组织温度,运用电阻采样、互感器隔离的方式测量组织阻抗。
为了适应治疗过程中人体组织温度和阻抗的复杂性与动态性,系统选用模糊控制算法,设计了单片机模糊控制器对温度和阻抗进行控制,针对多参数模糊控制规则集结构复杂的特点,通过建立分层多规则集结构,降低了控制复杂度。经过离体实验验证,治疗温度上升速度快、过渡时间短且超调小,阻抗值较稳定,可以实现对肿瘤病灶均匀、平稳的加热治疗,对于临床肿瘤治疗具有较高的实用价值。

