TGF-β1通过抑制小胶质细胞活化对帕金森病大鼠神经保护作用及机制
郭建新 孙学平 李平 皇甫赟 张风娟
(河南医学高等专科学校 1医学系,河南 郑州 451191;2附属医院神经内科)
帕金森疾病(PD)属于慢性进展神经疾病,65~70岁发病率为1%,80岁以上发病率增加3%,严重影响老年患者生活质量〔1〕。目前治疗PD主要采用多巴胺替代治疗,临床效果好,可明显改善患者临床症状,但长期使用会产生较多副作用,且目前还未找到药物能够逆转PD的发生,因此探究PD的发生发展机制对于PD的预防、治疗具有一定的积极意义〔2〕。转化生长因子(TGF)-β1是一种具有免疫抑制和抗炎作用的多效性细胞因子,文献报道TGF-β1信号系统激活后对中枢神经系统具有保护作用,可抑制小胶质细胞活化〔3〕。Liu等〔4〕研究显示,经外源给予TGF-β1预处理对PD大鼠神经具有一定的保护作用,然而其具体作用机制目前尚不明确。本研究拟分析TGF-β1治疗对PD大鼠神经的保护作用。
1 材料与方法
1.1实验动物 SPF清洁级SD大鼠,8周龄,体重200~230 g,购于河南省医药科学研究院,许可证号:SYXK(豫)2016-0008,均在统一环境喂养,光照、黑暗交替12 h,自由饮水摄食,饲养温度23~25℃,相对湿度为50%~70%。正常喂养1 w后进行模型制备。
1.2试剂与仪器 6-羟基多巴胺(OHDA)、脂多糖(LPS)、阿普吗啡购于美国Simga公司;TGF-β1购于美国R&D公司;肿瘤坏死因子(TNF)-α,一氧化氮合酶(iNOS)酶联免疫吸附试验(ELISA)检测试剂盒购于北京中杉金桥公司;兔抗鼠络氨酸羟化酶(TH)单克隆抗体购于美国CST公司;CD11b单抗购于美国SANTA公司;蛋白提取试剂盒购于日本Takara公司;聚氰基丙烯酸正丁酯(BCA)检测试剂盒购于Sigma公司;十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)垂直电泳仪、蛋白凝胶成像仪均购于美国Bio-rad公司;荧光显微镜购于日本OLYMPUS公司。紫外分光光度仪购于Thermo scientific公司。
1.3PD动物模型制备〔5〕大鼠腹腔注射400 mg/kg 10%水合氯醛,取仰卧位,固定于立体定位仪中,参照《大鼠立体定位图谱》选取右侧脑部黑质坐标,A点:硬膜下7.6 mm,中缝右2.4 mm,前卤后方5.0 mm,B点:中缝右侧1.6 mm,前卤后方5.6 mm,硬膜下7.8 mm,采用微量注射器在A、B两点均注射4 μg/μl 6-OHDA 3 μl,注射速率1 μl/min,结束后留针10 min进行拔针。模型鉴定:腹腔注射0.5 mg/ml阿普吗啡,10 min后观察大鼠逆时针旋转次数,共观察30 min,旋转次数≥210次为模型制备成功。共64只大鼠模型制备成功。
1.4动物给药与分组 将大鼠分为对照(Control)组、PD组、TGF-β1 25 ng/μl组、TGF-β1 50 ng/μl组、TGF-β1 100 ng/μl组各12只。PD组:模型鉴定后经右侧纹状体内离体定向注射等量生理盐水。TGF-β1 治疗组:经右侧纹状体内离体定向注射25、50、100 ng/μl TGF-β1 5 μl。1次/d,连续注射1 w。
1.5大鼠行为学评估 观察大鼠行为改变,并进行阿扑吗啡(APO)旋转诱导实验,统计用药后30 min内大鼠旋转圈数,计算平均旋转圈数。
1.6标本采集 各组随机选取10只大鼠,腹腔注射10%戊巴比妥钠后固定于试验台,断头取脑,将大鼠脑组织置于4%多聚甲醛溶液中固定24 h,进行石蜡包埋制备脑组织石蜡切片4 μm。各组随机选取6只大鼠,腹腔注射10%水合氯醛麻醉后,打开腹腔采集腹主动脉血3 ml,3 000 r/min离心15 min,保存上层血清。
1.7免疫组化检测脑组织黑质中TH、CD11b表达 石蜡切片脱蜡、脱水、抗原热修复后,添加3%过氧化氢溶液消除内源性过氧化物酶活,磷酸盐缓冲液(PBS)清洗后,滴加山羊血清封闭,添加TH、CD11b一抗置于4℃冰箱中进行过夜,清洗后添加二抗,PBS溶液清洗后添加辣根过氧化物酶(HRP)标记卵酶链白素,加入二氨基联苯胺(DAB)显色液进行显色反应,蒸馏水清洗后,苏木素复染,随后在乙醇中脱水,滴加二甲苯进行透明处理,用中性树脂进行封片,置于显微镜下进行观察。每张切片挑选10个黑质部清晰视野,计算阳性染色细胞数比例。
1.8ELISA法检测T淋巴细胞TNF-α、iNOS水平 按照ELISA试剂盒检测大鼠血清中TNF-α、iNOS水平。
1.9蛋白免疫印迹(WB) 取出保存组织,添加放射免疫沉淀试验(RIPA)裂解液,提取组织总蛋白,BCA法检测蛋白浓度,SDS-PAGE垂直电泳分离目的蛋白,结束后将蛋白凝胶转移到聚偏氟乙烯(PDVF)膜上,5%脱脂牛奶封闭后添加人白细胞抗原(HLA)-G、β-actin一抗(稀释倍数1∶500)4℃孵育过夜,添加HRP标记IgG二抗(稀释倍数:1∶5 000)室温下孵育1 h,以β-actin蛋白表达作为内参,采用Image软件评估蛋白表达。
1.10大鼠小胶质细胞培养与活化 参考文献法培养小胶质细胞〔6〕:出生1 d乳鼠处死后获取大脑皮层,将海马、血管等去除后,剪碎,加入0.25%胰酶溶液消化后添加胎牛血清(FBS)终止消化,滤膜过滤后离心,添加完全培养液,连续培养14 d后振荡培养2 h,收集脱落上清细胞为小胶质细胞。经流式细胞仪检测小胶质细胞纯度比例均达95%以上,符合后续实验要求。取初代细胞继续培养7 d后添加10 mg/L LPS刺激活化小胶质细胞,随后添加2、5、10 ng/μl TGF-β1同时设置空白组,分为空白组、LPS组、TGF-β1 2 ng/μl组、TGF-β1 5 ng/μl组、TGF-β1 10 ng/μl组。
1.11小胶质细胞活性检测 各组细胞继续培养24 h后,加入噻唑蓝(MTT)孵育4 h,舍弃上清液,添加二甲基亚砜(DMSO)溶液,震荡后在490 nm下测定细胞培养孔内OD值。以未进行处理的细胞作为对照组,细胞活性抑制率=(实验组OD-空白组OD)/空白组OD×100%。
1.12免疫荧光检测小胶质细胞形态 各组细胞继续培养24 h,将细胞用CD11b荧光抗体标记,在荧光显微镜下检测细胞形态变化。
1.13细胞CD11b、TGF-β1、Smad3蛋白表达水平 收集培养后细胞,采用WB法检测细胞CD11b、TGF-β1、Smad3蛋白表达。
1.14统计学方法 采用SPSS22.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1大鼠行为学评估 在模型制备过程中未出现大鼠死亡,PD组大鼠表现为行动迟缓、活动量少、躬身、竖毛等,TGF-β1各组大鼠活动量有所增加,行动正常,竖毛较少,随着处理剂量的增加,大鼠恢复较好。与Control组〔(6.24±0.03)圈/min〕相比,PD组APO诱导圈数〔(10.82±0.49)圈/min〕显著升高(P<0.05);与PD组相比,TGF-β1 25、50、100 ng/μl组〔(9.44±0.65)、(8.26±0.51)、(7.03±0.62)圈/min〕显著降低(P<0.05)。
2.2各组血清中TNF-α、iNOS水平比较 与 Control组相比,PD组血清中TNF-α、iNOS水平显著升高(P<0.05);与PD组相比,TGF-β1 25、50、100 ng/μl组显著降低(P<0.05),见表1。

表1 各组血清中TNF-α、iNOS水平比较
与Control组比较:1)P<0.05;与PD组比较:2)P<0.05;同表2,表3
2.3黑质部神经元、小胶质细胞数量 与 Control组相比,PD组黑质部神经元数量显著减少,小胶质细胞数显著升高(P<0.05);与PD组相比,TGF-β1 25、50、100 ng/μl组黑质部神经元数量显著升高,小胶质细胞数显著减少(P<0.05),见图1、表2。

图1 免疫组化法检测黑质部神经元及小胶质细胞变化(×100)
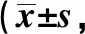
表2 各组黑质区神经元、小胶质细胞数量比较个/视野,n=10)
2.4各组黑质区TGF-β1、Smad3蛋白表达比较 与Control组相比,PD组TGF-β1、Smad3蛋白表达显著降低(P<0.05);与PD组相比,TGF-β1 25、50、100 ng/μl组显著升高(P<0.05)。见图2、表3。
2.5各组小胶质细胞控制率比较 与空白组〔(13.61±0.88)%〕相比,LPS组小胶质细胞抑制率〔(1.66±0.08)%〕显著降低(P<0.05);与LPS组相比,TGF-β1 2、5、10 ng/μl组〔(3.42±0.83)%、(6.76±1.04)%、(9.44±1.76)%〕显著升高(P<0.05)。

图2 黑质部组织TGF-β1、Smad3蛋白表达

表3 各组黑质区TGF-β1、Smad3蛋白表达比较
2.6小胶质细胞形态观察 与空白组相比,LPS组小胶质细胞胞体明显增大,细胞固缩,细胞被激活;TGF-β1 2、5、10 ng/μl组小胶质细胞胞体体积明显减小,胞体突起变细。见图3。

图3 荧光显微镜观察小胶质细胞形态变化(×200)
2.7各组细胞CD11b、TGF-β1、Smad3蛋白表达比较 与空白组相比,LPS组细胞TGF-β1、Smad3蛋白表达明显降低,CD11b蛋白表达显著升高(P<0.05)。与LPS组相比,TGF-β1 2、5、10 ng/μl组TGF-β1、Smad3蛋白表达明显升高,CD11b蛋白表达显著降低(P<0.05)。见图4、表4。

图4 细胞CD11b、TGF-β1、Smad3蛋白表达

组别TGF-β1 Smad3CD11b空白组1.04±0.761.22±0.230.24±0.06LPS组0.14±0.031)0.13±0.041)0.89±0.131)TGF-β1 2 ng/μl组0.23±0.042)0.39±0.052)0.74±0.122)TGF-β1 5 ng/μl组0.45±0.052)0.72±0.162)0.61±0.152)TGF-β1 10 ng/μl组0.56±0.072)0.98±0.192)0.36±0.062)
与空白组比较:1)P<0.05;与LPS组比较:2)P<0.05
3 讨 论
PD病理特征主要为黑质部多巴胺神经元丢失、变性,致使纹状体多巴胺水平降低,患者临床一般表现为行动缓慢出现静止性震颤。目前PD动物模型制备主要采用6-OHDA注射一侧纹状体,经神经元轴突末梢吸收后,6-OHDA损坏黑质部神经元,进而模拟早期PD临床病理表现〔7〕。本研究模型制备与以往PD模型制备结果相符合〔8〕,提示大鼠PD模型制备成功。TGF-β1是具有多功能生长调节蛋白,研究显示其在神经损伤、伤口溃烂修复再生等多病病理过程中发挥重要调控功能〔9〕。体外研究显示神经元培养时添加TGF-β1可显著提高存活率,促进雪旺细胞(SCs)细胞增殖,加速轴突髓鞘形成〔10〕。在中枢神经系统中添加TGF-β1可刺激星形胶质细胞产生,加速神经元生长、分化进程〔11〕。目前关于TGF-β1体内作用目前报道较少,本研究通过制备PD模型后给予外源TGF-β1治疗,结果表明TGF-β1对PD大鼠神经具有一定的保护作用,但具体作用机制尚不明确。小胶质细胞大量分布于脑皮层黑质部,研究证实小胶质细胞炎症反应与PD的发生密切相关〔12〕。Ouchi等〔13〕采用放射性追踪剂11CPK11195对PD者行正电子发射计算机断层扫描(PET)检查,结果显示神经元的变性缺失与小胶质细胞的激活有关。在脑部受损、出现炎症反应或受到免疫刺激后,黑质部小胶质细胞激活后上调细胞表面标志物,引发神经元缺失〔14〕。以上研究均显示黑质部神经元受损过程中,小胶质细胞活化发挥决定性作用。本研究免疫组化结果表明,外源给予TGF-β1能够抑制小胶质细胞的产生。为进一步探究TGF-β1对小胶质细胞活化抑制作用,本研究体外研究结果推测,TGF-β1能够抑制PD引发的小胶质细胞激活,进而发挥其对神经系统的保护作用,但对下游炎症因子是否有影响,目前尚不清楚。
研究显示,PD神经元损伤后可释放大量细胞坏死物,刺激小胶质细胞活化,产生大量环氧化酶(COX)-2及炎性因子TNF-α,进一步介导细胞毒性激活iNOS合成大量NO损伤神经元〔15〕。动物研究显示,在大鼠小胶质细胞培养过程中,LPS激活组细胞上清液中TNF-α、NO水平明显升高,添加促红细胞生成素(EPO)后可抑制NO生成,降低炎症反应〔16〕。本研究结果提示,TGF-β1可能通过降低TNF-α、iNOS水平,抑制炎症反应,发挥神经保护作用。近期有研究指出TGF-β1/Smads信号通路可能与PD的发生有关〔17〕。TGF-β1通过与膜受体结合后,使受体磷酸化,将信号转入细胞内,激活Samd3蛋白磷酸化,随后与Smad4形成复合物转入细胞核内,进而调控靶基因转录活性。体外研究显示,TGF-β1/Smad3信号通路参与谷氨酸介导神经元损伤〔18〕。Zhang等〔19〕研究显示,TGF-β1具有神经保护功能,体外培养神经元或胶质细胞时过表达TGF-β1可抵御神经损伤,中枢神经系统中研究显示过表达TGF-β1后可能对抗β淀粉蛋白诱导神经变性具有一定的抵御作用。动物研究显示Smad3基因缺陷型小鼠脑补神经前提细胞迁移受到明显阻碍,且神经系统发育异常〔20〕。Wang等〔21〕研究发现,Smad3基因缺陷型小鼠黑质部神经元缺失、变性数量明显降低。以上研究均提示TGF-β1/Smad3与神经损伤关系密切。本研究结果提示外源TGF-β1可激活TGF-β1/Smad3信号通路进而抑制小胶质细胞的活化,发挥神经保护功能。
综上,外源TGF-β1可能通过介导TGF-β1/Smad3信号通路抑制小胶质细胞活化,降低炎症因子表达,减轻PD大鼠神经损伤,保护神经功能。

