食源性相关腹泻患者粪弯曲菌检测结果分析
李宏杰 陈志杭 叶斌 葛荣跃 王海明
弯曲菌(Campylobacter spp)是一种重要的人兽共患病的病原体,是引起人胃肠道疾病最主要的病原体之一,使人致病的弯曲菌中99%是空肠弯曲菌,其与沙门菌、志贺菌并列为人类三大腹泻致病菌,并可带来其他一些疾病。空肠弯曲菌为苛养菌,常规的生化检测较为困难,临床多以经验性治疗为主,杨峰等[1]研究提示临床上在治疗急性腹泻时存在一定的用药不符和抗菌药物使用不正确的情况。作者应用多重聚合酶链式反应(PCR)检测200例食源性相关腹泻患者粪便标本中的弯曲菌,以了解与增菌培养分离法检测结果的关系,为临床诊疗与公卫服务提供技术支持。
1 材料与方法
1.1 菌株来源 对2015年1月至2017年12月本系统12家社区卫生服务中心就诊的食源性相关腹泻患者粪便(或肛拭子)标本采用直接分离与增菌分离相结合的方法常规培养分离获得200株致泻菌,其中空肠弯曲菌4株、结肠弯曲菌1株。
1.2 仪器与耗材 VITEK-2 compact全自动微生物分析系统(法国bioMérieux公司)及其苛养菌(NH)配套鉴定卡,基因扩增仪,荧光定量分析仪。
1.3 主要培养基和试剂 Cary-Blair运送培养基(杭州天和微生物试剂有限公司产品),改良木炭-头孢哌酮-去氧胆酸盐琼脂(CCDA)培养基,改良Campy-BAP弯曲菌培养基及药敏纸片(均为英国Oxoid公司产品),微需氧袋(法国bioMérieux公司产品)。2Taq PCR Master Mix与PCR Marker购自上海生工生物技术有限公司;弯曲菌核酸测定试剂盒(单重、二重与多重荧光PCR法)购自上海之江生物科技股份有限公司。
1.4 仪器校准及室内质控 仪器按厂家要求进行校准并按室内质控的要求完成室内质控。室内质控菌株在直接分离、增菌分离、血清学凝集试验和生化鉴定上与待检标本同步,空肠弯曲菌(ATCC33291)由浙江省临床检验中心提供。
1.5 检测方法 (1)标本采集:采集食源性相关腹泻患者粪便(或肛拭子)标本,用2支灭菌棉拭子沾取患者粪便后,分别插入2管Carry-Blair运送培养基中,尽快送实验室检测,样品采集遵循统计学要求。(2)多重PCR检测粪弯曲菌:多重PCR方法参照何蕊等的方法引物设计[2],单重、二重和多重PCR用相应试剂盒或自行引物组合设计进行荧光PCR检测。(3)菌株分离鉴定:①菌株分离培养:实验室收到待检粪便标本后立即接种于改良CCDA培养基(并用于PCR 检测),置微需氧袋(5%O2、10%CO2、85%N2)42℃48h,挑取可疑菌落再接种到改良CCDA培养基或哥伦比亚血琼脂进行纯培养,继续42℃微需氧培养24~48h;另1份待检粪便标本置微需氧袋42℃增菌培养24~48h后接种于改良CCDA培养基(并用于PCR检测),同直接分离培养法获取纯培养。②菌株常规生化鉴定:将疑似弯曲菌的纯培养物在VITEK-2 compact上使用配套苛养菌(NH)鉴定卡进行菌种鉴定。③菌株PCR鉴定:根据常规生化鉴定结果,再次以PCR(单重、二重与多重荧光PCR法)检测复核(也包括培养阴性的样本盲刮平板用PCR再次检测),单重PCR检测16S rRNA,二重PCR检测16S rRNA与map A基因,多重PCR检测16S rRNA、map A与ceu E基因。
1.6 菌株药敏试验 采用CLSI推荐使用的琼脂纸片扩散法即Kirby-Bauer(K-B)法。将被检菌制成0.5麦氏单位的菌悬液,均匀涂抹在厚度为4mm的Campy-BAP培养基上,42℃平衡10~15min,贴抗菌药敏纸片,置微需氧袋42℃孵育48h后按照CLSI标准判读结果。
1.7 统计学分析 采用SPSS 13.0统计软件。计数资料采用χ2检验(结合确切概率法)分析,P<0.05为差异有统计学意义。
2 结果
2.1 增菌前后弯曲菌检出率 粪便标本直接培养分离法的检出率为1.50%(3/200),PCR法(多重PCR、单重PCR或二重PCR)直接检测粪便标本弯曲菌的检出率均为2.50%(5/200)。由于阳性病例偏少,增菌培养前,二类方法的检出率无明显差异(χ2=0.5102,P>0.05)。增菌后,培养分离法的检出率为2.00%(4/200),PCR法的检出率为2.00%(4/200),二类方法的检出率无明显差异(χ2=0.0000,P>0.05)(见表 1),有1例未能分离出菌落但平板盲刮PCR法仍可检出。
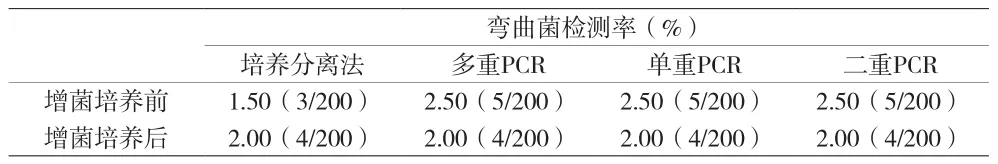
表1 200份粪便标本增菌培养前后弯曲菌的检出率
2.2 菌种鉴定结果 多重PCR的检出空肠弯曲菌4例,结肠弯曲菌1例(在二重PCR检测仅有16S rRNA荧光曲线,在多重PCR检测有16S rRNA和ceu E两条荧光曲线);增菌培养分离法菌种生化鉴定菌种结果与多重PCR一致。
2.3 菌株药敏结果 所有菌株对碳青霉烯类、氨基糖苷类和-内酰胺类/酶抑制剂复合制剂多敏感,对其他抗菌素可耐药。
3 讨论
在发展中国家,弯曲菌是婴幼儿感染性腹泻最常见的病原菌[3]。尽管弯曲菌的流行已引起各界广泛关注,但由于其暴发少,病死率低,加上培养条件苛刻,许多监测机构(尤其是基层结构)尚未建立起对弯曲菌的监测系统,缺乏有力的控制手段。因此探索适宜的空肠弯曲菌检测方法显得尤为重要。
由于阳性病例偏少,可能导致增菌培养前,二类方法的检出率无明显差异(χ2=0.5102,P>0.05),但PCR直接检测的阳性率还是有高于直接培养分离法的趋势。RantsiouK等[4]报道,在增菌前定量PCR的检测灵敏度明显高于培养分离法,定量PCR的检测率高达87%(42/48),而培养分离法的检测率31.25%(15/48)。这可能与标本中的目标菌含量太低(低于培养分离法的检测限)、“活的非可培养(viable but noncultureable,VBNC)”状态、营养与培养条件以及抗生素的使用等因素有关。同时,培养基和培养条件的不稳定改变也可能导致菌种生化鉴定失真。增菌可能有利于提高标本中低剂量成活目标菌的培养分离法的检出率。Lund等[5]实验时发现有11份鸡粪便标本直接接种CCDA平板鉴定结果为阴性,而增菌后再接种CCDA平板时鉴定结果则为阳性。而本资料使用的改良CCDA平板在粪便标本直接接种与增菌后培养分离法的检测率差异无统计学意义(χ2=0.1454,P>0.05),可能观察例数太少,但也说明提高弯曲菌选择性培养基性能的重要性,建议酌情使用改良CCDA平板或改良的Skirrow血琼脂平板等,并可直接接种。与此相反,增菌后可能导致PCR法的检出率有所降低,可能是由于增菌液显著稀释了部分标本中目标菌或目标菌的DNA相对浓度而导致检出率下降。
目前公认,PCR法检测弯曲菌的敏感度明显高于培养分离法,特异性强,简便快速。其中,多重PCR技术特异性更强,也可具有鉴别诊断的作用;培养分离法虽然操作繁琐,但仍是获取菌株鉴定、药敏的基本途径。因此,应根据检测目的、自身条件等因素选择合适的检测方法和分离程序。多重PCR比较适合于食源性相关腹泻患者粪弯曲菌的快速检测,也应重视培养分离法对鉴定与药敏的地位,努力优化选择性培养基及培养条件。在VITEK-2 compact全自动微生物分析系统苛养菌(NH)鉴定菌种数据库里,有空肠弯曲菌、结肠弯曲菌、胎儿弯曲菌等菌种供系统判定,能够满足临床需要。PCR法是目前对弯曲菌分离菌株进行鉴定的通用参比方法[6],实际工作中可以根据需要使用单一的或不同的基因组合来检测,以判定弯曲菌属种[7-8],尽可能保留16S rRNA基因检测在弯曲菌分子诊断与菌属种鉴定中的基础作用。而已经发展起来的环介导恒(等)温扩增(loop-mediated isothermal amplification,LAMP)技术[9]有望得到一致的认可与评价,工作中应做好LAMP检测多项单一指标的复合评判,为临床诊疗提供及时的有用的信息。

