不同品种苹果果胶含量及结构差异分析
曹风,刘璇,毕金峰,吴昕烨,张彪,刘嘉宁
不同品种苹果果胶含量及结构差异分析
曹风1, 2,刘璇1,毕金峰1,吴昕烨1,张彪1,刘嘉宁1
(1中国农业科学院农产品加工研究所/农业农村部农产品加工重点实验室,北京 100193;2大连工业大学食品学院,辽宁大连 116034)
【】比较分析不同品种苹果原料果胶结构的差异性,为品种识别提供帮助,为苹果相关产品的加工以及苹果副产物的利用提供理论数据基础。以来自全国7个产区的14个品种20份苹果样品为研究对象,由每份苹果的细胞壁物质(alcohol-insoluble residue,AIR)提取3种类型果胶:水溶性果胶(water-soluble pectin,WSP)、螯合性果胶(CDTA-soluble pectin,CSP)及碱溶性果胶(Na2CO3-soluble pectin,NSP),研究分析果胶的半乳糖醛酸(galacturonic acid,GalA)含量、酯化度、重均分子量(weight-average molar mass,Mw)、中性糖含量以及结构官能团,并进行主成分分析以及热图分析。不同品种苹果样本间果胶特性存在一定差异性。3种类型果胶含量以NSP半乳糖醛酸含量最多,WSP次之,CSP含量最少,最富含果胶含量的苹果品种是‘澳洲青苹’(215.75 mg GalA·g-1AIR),产自不同地区的‘富士’(栖霞、新疆、青岛‘烟6’、河北‘三优’)苹果的各果胶半乳糖醛酸含量有着较大的差异;‘秋锦’的WSP甲酯化度最高,CSP的甲酯化度偏高,且大多数为高酯化度果胶;WSP的乙酰化度均在3.5%以下;WSP的Mw在各品种苹果间差异性最为显著,辽宁‘华月’WSP的Mw最高;‘红将军’WSP的Mw/Mn高于其他品种,但其CSP的Mw/Mn低于其他品种;Mw/Mn在3种类型果胶间差异性较小;中性糖含量组成均以鼠李糖、阿拉伯糖、半乳糖3种单糖居多,岩藻糖、木糖、甘露糖呈微量状态,葡萄糖存在居多的原因可能是在果胶的提取过程中,有可溶性淀粉、糊精或低聚糖混杂;各果胶以同型聚半乳糖醛酸和鼠李聚半乳糖醛酸II型结构为主,且果胶侧链较多;主成分分析得出苹果样本间的主要差异性指标为WSP的半乳糖含量、阿拉伯糖含量、岩藻糖含量以及CSP的半乳糖含量、鼠李糖含量、中性糖比率(鼠李糖与半乳糖醛酸含量的比值)。不同品种苹果原料中3种类型果胶的含量及其结构存在一定的差异性,具有父本、母本等基因杂交关系的苹果品种的果胶结构特点间存在关联性,研究可为苹果育种与种植结构调整提供理论支持。
苹果品种;果胶;结构;差异性
0 引言
【研究意义】苹果营养价值高,有多种维生素、抗氧化剂以及果胶,居世界四大水果之首。据联合国粮农组织数据可知,我国是世界上最大的苹果生产国和消费国,苹果种植面积和产量均居世界首位,分别约占全球的45%和50%。苹果在我国有四大主产区:渤海湾、黄土高原、黄河故道和西南冷凉高地,其中黄土高原和渤海湾是世界上苹果最大产区,也是我国着力发展的优势区[1]。我国苹果品种也较丰富,有几百个品种,包含富士系、嘎啦系、元帅系等,‘红富士’是主栽品种,产量约占68.9%[2]。苹果的加工制品主要包括果汁、果醋、果干、罐头以及果酱果脯等。果蔬的质构特性主要受细胞壁中物质(果胶、纤维素、半纤维素等)影响[3]。这不仅体现在果干的脆度上[4],在罐头的贮藏过程中,罐头硬度的变化与细胞壁中果胶含量及其组成的变化也具有显著相关性[5]。果胶易溶于水,在罐头的制备及储藏过程中,果胶溶出,由于其凝胶性能,罐头汁液黏稠,口感更好[6]。果汁中果胶的分子量会影响果汁的絮凝[7],果胶的变化会影响果汁的混浊稳定性[8]。果醋中的果胶、淀粉等大分子会导致果醋在贮藏期间出现二次混浊,即有絮状、沉淀物存在[9]。果胶对加工品品质的影响是重要且复杂的,研究苹果原料中果胶的特性不仅有助于苹果加工原料的筛选,还对苹果加工制品品质的把控有指导作用。【前人研究进展】果胶是一种高分子碳水化合物,广泛存在于绿色植物的细胞壁中[10]。果胶还有各种保健功能,例如降低胆固醇、预防糖尿病、维持肠道健康等[11-12]。其基本结构是以由α-1, 4-糖苷键聚合而成的半乳糖醛酸(galacturonic acid,GalA)为主链,其他类型的中性糖作为侧链连接在主链上,侧链上的中性糖主要包括半乳糖(galactose,Gal)、鼠李糖(rhamnose,Rha)、阿拉伯糖(arabinose,Ara)、岩藻糖(fucose,Fuc)、木糖(xylose,Xyl)、甘露糖(mannose,Man)等。果胶分子根据其主链和支链结构的不同,分为4个结构区域:同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖I(rhamnogalacturonan-I,RG-I)、鼠李半乳糖醛酸聚糖II(rhamnogalacturonan-II,RG-II)和木糖半乳糖醛酸聚糖(xylogalacturonan,XG)[13]。果胶含量及其结构会随原料的种类、产地、成熟期、贮藏期和加工工艺的不同而不同[14]。各果胶结构的差异性主要体现在它们的分子量、酯化度及中性糖含量上[15]。刘凤霞等[16]高压处理芒果果浆后发现,水溶性果胶的分子质量分布无变化,而果胶半乳糖醛酸含量、酯化度均下降;王蓉蓉等[17]以我国6种枣果为原料,探究发现6种枣果中均以水溶性果胶含量最高,碱溶性果胶次之,螯合性果胶含量最低,3种类型果胶的中性糖组成及含量受枣果来源不同影响,果胶的分子质量分布受枣果品种来源和果胶类型两方面影响;NJOROGE等[18]研究发现豆类的3种类型果胶(水溶性果胶、螯合性果胶及碱溶性果胶)的结构及溶解性差异可能是导致豆类烹饪难易的差异原因之一。有关苹果中果胶的研究已有较多报道,KUMAR等[19]探究苹果渣中果胶对胰脂肪酶的体外抑制作用,发现抑制作用强弱依赖于果胶的来源及果胶的提取试剂类型;罗亚楠等[20]以苹果渣为原料,酸性水溶液为浸提剂,确定了果胶的最佳提取工艺条件为固液比1﹕13,温度85℃,pH 2.0,浸提时间1.5 h,使果胶提取率可以达到13%以上;CHO等[21]提出的苹果渣酸溶解过程中果胶产量和特性黏度数学模型(Arrhenious型方程;温度的指数函数)的测定系数分别为0.922和0.682,且其置信水平分别为97.0%和88.5%;HWANG等[22]采用不同螺杆速度的双螺杆挤出机分解苹果渣,后通过热水浸提苹果果胶,得出在110—170 kW∙h-1的机械能范围内可获得与酸提取相当的水溶性果胶产量及果胶特性黏度;田玉霞等[23]运用超滤膜分离出6种不同分子量的苹果果胶,研究发现分子量大于300 kD的果胶占大多数,各级果胶的半乳糖醛酸含量、酯化度及单糖组分均与分子量呈正相关关系。【本研究切入点】目前所做的研究大多是有关苹果果渣中果胶的研究,我国苹果种质资源丰富,针对多品种苹果原料中的果胶含量及其结构的报道较少,这限制了苹果种质资源的开发、苹果加工制品品质的提升以及苹果副产物的开发利用。【拟解决的关键问题】本研究以苹果为研究对象,在团队对苹果浊汁品质研究的基础上,从全国7个苹果产区选择14个品种20份具有差异代表性的苹果,分析不同品种苹果的果胶含量及其结构上的差异性,为合理开发利用资源,推动苹果产业发展提供参考。
1 材料与方法
试验于2017年3月至2018年5月在中国农业科学院农产品加工研究所进行。
1.1 试验原料
供试苹果共20份,于2016年采自全国7个不同产区,采收依据淀粉染色法确定果实成熟度,选取淀粉-碘指数在7—8的果实(分数范围1—8依次表示不成熟至成熟)。采后置于4℃冷库备用,取外观完整且无机械损伤样品进行试验。具体苹果品种见表1。

表1 苹果品种与产地
1.2 主要试剂
反-1, 2-环己二胺四乙酸一水合物(CDTA)及2, 4-戊二酮均购自Acros Organics公司;3-苯基苯酚、D-半乳糖醛酸、乙醇氧化酶及三氟乙酸均购自Sigma-Aldrich公司;溴化钾购自Pike Technologies Inc公司;K-ACETRM乙酸激酶法检测试剂盒购自爱尔兰Megazyme公司。
1.3 主要仪器与设备
A11 basic研磨机,T25高速分散机,RT高多点数显型加热磁力搅拌器,德国IKA公司;VORTEX-5旋涡混合器,海门市其林贝尔仪器制造有限公司;DU-20电热恒温油浴锅,上海一恒科学仪器有限公司;DAWN HELEOS-II多角度激光光散射/凝胶色谱联用仪,美国Wyatt公司;TENSOR27傅里叶红外仪,德国Bruker公司;ICS-5000+离子色谱仪,美国Dionex公司;Alphal-4Lplus真空冷冻干燥设备,德国CHRIST公司;UV-1800紫外分光光度计,日本Shimadzu公司。
1.4 试验方法
1.4.1 细胞壁物质的制备 参考SILA等[24]方法,稍作修改。取100 g鲜苹果切丁,液氮冷冻后研磨成粉,加入500 mL 95%乙醇,分散机分散1 min后浸泡2 h,抽滤,滤渣用300 mL 95%乙醇分散1 min后抽滤,滤渣再用300 mL丙酮浸泡10 min抽滤,最终得到的滤渣于40℃烘箱烘干12 h即得细胞壁物质(alcohol- insolubleresidue,AIR)。
1.4.2 细胞壁各组分分离 参考STOLLE-SMITS等[25]方法,取180 mL蒸馏水,加入1 g AIR搅拌煮沸5 min,冷却抽滤,定容至250 mL,蒸馏水透析72 h,冻干得水溶性果胶(water-soluble pectin,WSP);WSP萃取残渣中加入180 mL 0.05 mol∙L-1CDTA溶液(含0.1 mol∙L-1乙酸钾,pH 6.5),室温磁力搅拌15 min,28℃水浴摇床6 h,抽滤,定容至250 mL,透析72 h(前36 h用0.1 mol∙L-1的NaCl溶液,后36 h用蒸馏水),冻干得螯合性果胶(CDTA-soluble pectin,CSP);CSP萃取残渣中加入180 mL 0.05 mol∙L-1碳酸钠(含0.02 mol∙L-1四硼酸钠),4℃恒定搅拌16 h,28℃水浴摇匀6 h,抽滤,定容至250 mL,蒸馏水透析72 h,冻干得碱溶性果胶(Na2CO3-soluble pectin,NSP)。
1.5 指标测定
1.5.1 果胶含量测定 参考BLUMENKRANTZ等[26]方法,采用紫外分光光度法,含量以每克细胞壁物质中含半乳糖醛酸毫克数(mg GalA∙g-1AIR)表示。
样品水解:称取约10 mg WSP(CSP或NSP样品)于烧杯中,冰浴条件下,加入8 mL硫酸,磁力搅拌,逐滴加入2 mL蒸馏水,混合5 min,再逐滴加入2 mL蒸馏水,搅拌混合1 h,最后将样品定容至25 mL,每组试验3个平行。
测定:取0.6 ml水解后的样品或不同浓度的半乳糖醛酸标准溶液置于试管中,冰水浴条件下,加入3.6 mL 0.0125 mol∙L-1硫酸-四硼酸钠溶液,旋涡混合器混匀,100℃油浴5 min,冰水浴冷却,再加入60 μL 3-苯基苯酚溶液(0.15 g 3-苯基苯酚溶于100 mL 0.5%氢氧化钠),旋涡混合器混匀,520 nm下测定吸光度。对于空白样,其他步骤一样,最后将60 μL 3-苯基苯酚溶液替换成60 μL 0.5% 氢氧化钠溶液,520 nm下测定吸光度。
1.5.2 果胶甲酯化度的测定 参考SILA等[24]方法,采用紫外分光光度法,以甲醇作为标准物质测定果胶甲酯化度(degree of methoxylation,DM)。
样品水解:称取约20 mg WSP(CSP样品)于试管中。加入8 mL蒸馏水,超声10 min,加入3.2 mL 2 mol∙L-1氢氧化钠溶液,置于20℃震荡培养箱1 h,每10 min摇晃一次,再加入3.2 mL 2 mol∙L-1盐酸溶液,置于25℃震荡培养箱15 min,最后用0.0975 mol∙L-1(pH 7.5)的磷酸缓冲溶液定容至25 mL,每组试验3个平行。
测定:取1 mL水解后的样品或不同浓度的甲醇标准溶液置于试管中,加入1 U ∙mL-1乙醇氧化酶,旋涡混合器混匀,25℃水浴15 min,加入2 mL戊二酮溶液(含0.02 mol∙L-12, 4戊二酮、2 mol∙L-1乙酸铵、0.05 mol∙L-1乙酸),旋涡混合器混匀,58℃水浴15 min,冷却,旋涡混合器混匀,412 nm下测定吸光度。对于空白样,测定时加1 mL蒸馏水于玻璃试管中,其他步骤一样,最后加2 mL蒸馏水,412 nm下测定吸光度。
1.5.3 果胶乙酰化度的测定 参考LIU等[27]方法,通过酶试剂盒测定WSP中乙酸的浓度,WSP的乙酰化度(degree of acetylation,DAc)为乙酸摩尔量与GalA摩尔量的比率,并以百分比表示。
1.5.4 果胶单糖组成和含量的测定 参照ŠIMKOVIC等[28]方法,稍作修改。称取约10 mg WSP(CSP或NSP样品)于水解管中,加入2 mol∙L-1的三氟乙酸4 mL,于120℃水解1 h,真空浓缩至干,定容至一定体积,稀释至合适浓度,过0.2 μm滤膜后进样。分析柱为CarboPac PA20,流动相A为超纯水,流动相B、C分别为0.25 mol∙L-1氢氧化钠和1 mol∙L-1醋酸钠,流速为0.5 mL∙min-1,进样体积为10 μL,柱温为35℃,检测器为脉冲安培检测器。梯度洗脱程序如下:0—20 min:94% A和6% B;20—20.1 min:89% A,6% B和5% C;20.1—35 min:74% A,6% B和20% C;35.1—45 min:20% A和80% B;45.1—55 min:94%A和6% B。配置Gal、Rha、Ara、Glc、Fuc、Xyl及Man标准溶液,并绘制标准曲线,计算各单糖的含量。
1.5.5 果胶分子量的测定 参考NJOROGE等[18]方法,稍作修改,测定果胶重均分子量(weight average molecular weight,Mw)及数均分子量(number average molecular weight,Mn)。用0.1mol∙L-1硝酸钠溶液为溶剂配制质量浓度为1 mg∙mL-1的果胶溶液,过0.45 μm滤膜后进样。色谱柱为SHODEX SB-806M,流动相为0.1 mol∙L-1硝酸钠,流速为0.5 mL∙min-1,进样体积为200 μL,柱温为40℃。
1.5.6 果胶红外光谱 参考PARK等[29]方法,采用傅里叶红外光谱仪(fourier transform infrared spectroscopy,FTIR)进行扫描,溴化钾先于105℃烘干,取1 mg WSP(CSP或NSP样品)与100 mg溴化钾于玛瑙研钵中混匀研磨,压成厚3 mm的片状进行分析,扫描分辨率设置为4 cm-1,累计扫描64次,扫描波数范围4000—500 cm-1。
1.6 数据分析
本研究测定的果胶指标及编号见表2。本试验数据采用SPSS 21.0、SIMCA及Heml 1.0软件进行分析处理,试验分析图采用Origin 9.0软件绘制,显著性差异水平<0.05。

表2 果胶指标及其编号
表中I表示GalA/(Fuc+Rha+Ara+Gal+Xyl),II表示Rha/GalA,III表示(Ara+Gal)/Rha。下同
In the table, I means GalA/(Fuc+Rha+Ara+Gal+Xyl), II means Rha/GalA, III means (Ara+Gal)/Rha. the same as below
2 结果
2.1 不同品种苹果原料中不同类型果胶的分析
不同品种苹果原料中3种类型果胶的半乳糖醛酸含量、酯化度及分子量的均值分布如表3所示,可见各品种苹果间的果胶指标存在一定的差异性。最富含果胶含量的不是我国栽培最广的‘富士’苹果,而是适合榨汁的‘澳洲青苹’;另外,各品种苹果的3种类型果胶含量中,NSP含量最多,WSP含量次之,CSP含量最少。产自不同地区的富士(栖霞、新疆、青岛‘烟6’、河北‘三优’),各果胶半乳糖醛酸含量存在较大的差异,表明果实生长环境对果实的特征性物质含量有重要影响。
果胶的甲酯化度和乙酰化度是果胶多糖的重要结构特征,即被酯化的半乳糖醛酸残基在果胶分子中所占的比例,代表着果胶的凝胶特性。酯化度高的果胶凝胶速度快。通常按酯化度的程度分为高酯化度果胶(DE≥50)和低酯化度果胶(DE≤50)[30]。不同品种苹果及不同类型果胶的酯化度有一定的差异性,总体来看,CSP的甲酯化度偏高,且大多数为高酯化度果胶;与其他品种苹果相比较,‘秋锦’的WSP甲酯化度较高,‘秋锦’的CSP甲酯化度仅次于‘红将军’。所有品种苹果WSP的乙酰化度均在3.5%以下,乙酰化度最高的品种为‘秋锦’,最低的品种为辽宁‘华月’。
对于不同品种苹果3种类型果胶的Mw而言,WSP的Mw在各品种苹果间差异最为显著,重均分子量最高的是辽宁‘华月’(1.66×105Da),最低的是‘澳洲青苹’(31.63×105Da)。‘乔纳金’苹果CSP和NSP的Mw在所有苹果样品中均为最高,辽宁‘华金’的Mw是各品种苹果CSP中最低的(2.26×105Da),各品种苹果中辽宁‘秋锦’NSP的Mw最低。辽宁‘华月’和甘肃‘秦冠’两品种CSP的Mw同为2.79×105Da,Mw/Mn分别为1.68、1.64,‘华月’及‘秦冠’品种均由‘金冠’作母本杂交而来[31],二者分子量及多分散系数间差异性较小,可能与原料的基因调控有关。
而对于多分散系数Mw/Mn,值越大,说明其分子量分布较宽不集中,聚合物呈长短链混杂状态,聚合物的纯度不好。甘肃‘花牛’和山东泰安‘新红星’WSP的Mw/Mn仅相差0.01,且两者NSP的Mw/Mn同为2.14,‘新红星’和‘花牛’均属于‘红元帅’系[32],可见这二者基因上的联系,反映在了果实特征性物质的指标上。青岛‘烟6’与淄博‘红将军’WSP的Mw/Mn相差0.02,青岛‘烟6’为富士系,‘红将军’为富士芽变而来[33],两种苹果产地还同为山东,两者果胶结构有相似的特性,可能与其基因和生长环境有关。‘红将军’WSP的Mw/Mn最高,但其CSP的Mw/Mn最低。‘长密欧’不同类型果胶的Mw/Mn于各品种苹果间的分布规律与‘红将军’的相似,其在CSP中最低,在NSP中最高。栖霞‘富士’、新疆‘富士’、青岛‘烟6’、河北‘三优’均属不同产地的‘富士’品种,不同产地苹果所生长的气候环境不同,但这些品种之间CSP的Mw/Mn(1.58、1.51、1.53、1.47)差异性非常小,可能是同一品种下的共同特性。

表3 不同品种苹果原料中果胶指标均值分析
1—20为苹果品种序号,顺序与表1相同。下同
1—20 is the apple variety number, the order is the same as table 1. The same as below
2.2 不同品种苹果原料中不同类型果胶的红外光谱图的分析
利用FTIR对果胶进行4 000—500 cm-1的光谱分析结果如图1所示,由于20份苹果3种类型果胶的红外光谱没有明显的差异,图1仅列了栖霞‘富士’品种3种类型果胶的红外光谱图。红外光谱在3 600— 2 500 cm-1之间广泛的强吸收区域归因于半乳糖醛酸聚合物分子间和分子内氢键引起的O-H伸缩吸收,表明果胶的几个结构特征[34-35]。在约2 950 cm-1处的较弱吸收区域是指C-H吸收,包括CH、CH2和CH3拉伸及弯曲振动[36]。在所有研究的果胶样品中,都观察到C-H吸收区域,作为叠加在3 600—2 500 cm-1的宽O-H吸收带内。在约1 750 cm-1出现的强吸收,表示酯羰基(C═O)基团。羧酸基团显示出两条吸收带,一条在1 630 cm-1附近较强的不对称伸缩带和一条在1 400 cm-1附近较弱的对称伸缩带。由图观察到酯化度较大的果胶,其酯羰基的吸收强度大,而羧酸酯伸缩带的吸收强度低,NSP果胶酯化度非常低,在1 750 cm-1左右无明显吸收峰。在约1 200 cm-1处的吸收峰是不对称的C-O-C伸缩振动峰,表明有-O-CH3存在;1 000—1 200 cm-1的吸收峰是吡喃型糖环的醚键和羟基的吸收峰[37];900 cm-1附近的吸收峰是D-吡喃型葡萄糖的特征吸收峰,在3 300—3 500 cm-1(-NH2)处无双峰出现说明无蛋白存在[15]。
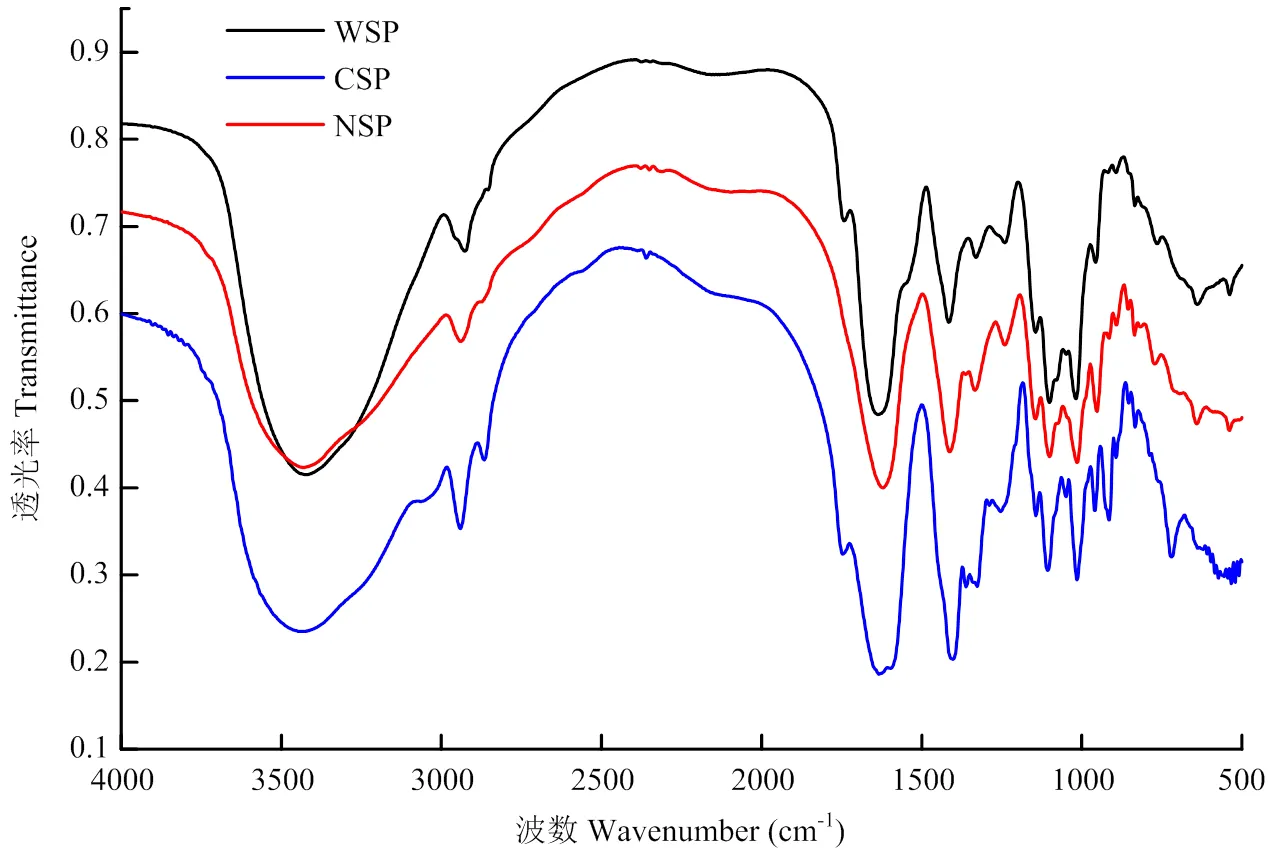
图1 栖霞富士苹果原料WSP、CSP及NSP的傅里叶红外光谱图
2.3 不同品种苹果原料中不同类型果胶的单糖组成分析
单糖是果胶的结构指纹,其组成及含量由离子色谱仪测定,图2是辽宁‘华月’苹果WSP的中性糖离子色谱图,其他样品的离子色谱图未详细列出,图3是Heml软件制作的20份苹果3种类型果胶中7种单糖含量的热图。通过热图可以更加直观地观察不同品种苹果及不同类型果胶间单糖含量的差异,图中每种苹果每个类型果胶的每个单糖含量用不同深浅颜色表示,红色越深代表某种单糖含量越多,蓝色越深表示某种单糖含量越少,绿色部分是单糖含量在检测限以下。
果胶分子的结构主链由150—500个α-D-半乳糖醛酸基通过1, 4糖苷键连接而成,在主链中相隔一定距离存在不同单糖构成的侧链。由图3可知,苹果品种间不同类型果胶的中性糖组成均以鼠李糖、阿拉伯糖、半乳糖3种单糖居多,岩藻糖、木糖、甘露糖呈微量状态,但是含量水平不尽一致。总体来看,3种类型果胶20份苹果的阿拉伯糖含量最多,CSP和NSP的大多数木糖及甘露糖微量到在检测限以下。从3种类型果胶7种单糖的每个含量来看,NSP中主要单糖含量最多。葡萄糖居多的原因可能是在果胶的提取过程中,有可溶性淀粉、糊精或者低聚糖混杂。
由热图结果可以发现,新疆‘富士’和辽宁‘秋锦’、甘肃‘花牛’和辽宁‘华金’、淄博‘红将军’和河北‘三优’富士这3组苹果在热图中各果胶7种单糖含量颜色较相近的数量较多,热图聚类分析中各组两个品种均聚为一类,这与3组苹果品种分别存在的基因关系相符合,即‘富士’是‘国光’为母本、‘红元帅’为父本杂交而来,‘秋锦’由‘国光’‘红元帅’‘红冠’等品种杂交而来,两者都含有‘国光’和‘红元帅’的基因[38];‘花牛’属于‘红元帅’系,‘华金’授粉品种包括‘华红’‘富士’‘红元帅’及‘金冠’,两者都有‘红元帅’基因;‘红将军’为‘富士’芽变而来,与‘三优’富士有着密切基因关系。
通过中性糖组成及含量计算得到中性糖比率,由表4可知,20份苹果3种类型果胶中,表征线性度的GalA/(Fuc+Rha+Ara+Gal+Xyl)在CSP和NSP中因木糖含量在检测限以下未作计算,由数据可知WSP的线性度在不同苹果样本间差异性较显著,最大的是‘澳洲青苹’品种;Rha/GalA基本均在0.05以下,苹果样本间差异性较小,说明果胶结构主要以HG和RG-II型为主;CSP的(Ara+Gal)/Rha属20份苹果3种类型果胶中较大值数量最多者,故可估计大多数苹果品种的CSP中连接到RG-I结构区域的鼠李糖侧链较长;Ara和Gal两种单糖含量较多,表明苹果果胶的侧链较多,在整个提取过程中果胶侧链未被水解。
2.4 不同品种苹果原料中果胶含量及其结构差异的分析
利用SIMCA软件进行PCA主成分分析,获得的得分图如图4所示。根据20份苹果的3种类型果胶的含量、酯化度、分子量及中性糖组成指标分析,发现有的品种特征较为类似,例如除特殊气候地区的新疆‘富士’,其他同品种不同产地的栖霞‘富士’、青岛‘烟6’及河北‘三优’苹果间的总特征差异性极小,这与之前它们CSP的Mw/Mn差异性非常小相符。另外,淄博‘红将军’与栖霞‘富士’、辽宁‘秋锦’和辽宁‘乔纳金’两组苹果在得分图中均有组内重叠,‘红将军’由‘富士’芽变而来,‘秋锦’和‘乔纳金’共同拥有‘金冠’基因,这些品种间的基因关联促进了此现象的发生;有的品种存在显著性差异,例如同是‘新红星’‘秦冠’‘金冠’,但不同产地的品种,在图中分布距离较远,可见不同产地的同一品种存在一定的差异,这与热图中品种间中性糖含量组成颜色呈现深浅不同的差别性相符。

图2 辽宁华月苹果WSP的中性糖离子色谱图

图3 不同品种苹果原料中果胶的中性糖组成热图
表4 不同品种苹果原料WSP、CSP及NSP的中性糖比率
Table 4 Neutral sugar ratios of WSP, CSP, and NSP of different apple varieties

表中“—”表示单糖含量在检测限以下,未进行中性糖比率计算。同列不同小写字母表示差异显著(<0.05)
“—“ means the monosaccharide content was below the detection limit and neutral sugar ratio was not calculated. Different lower-case letters in the same column show significant differences (<0.05)
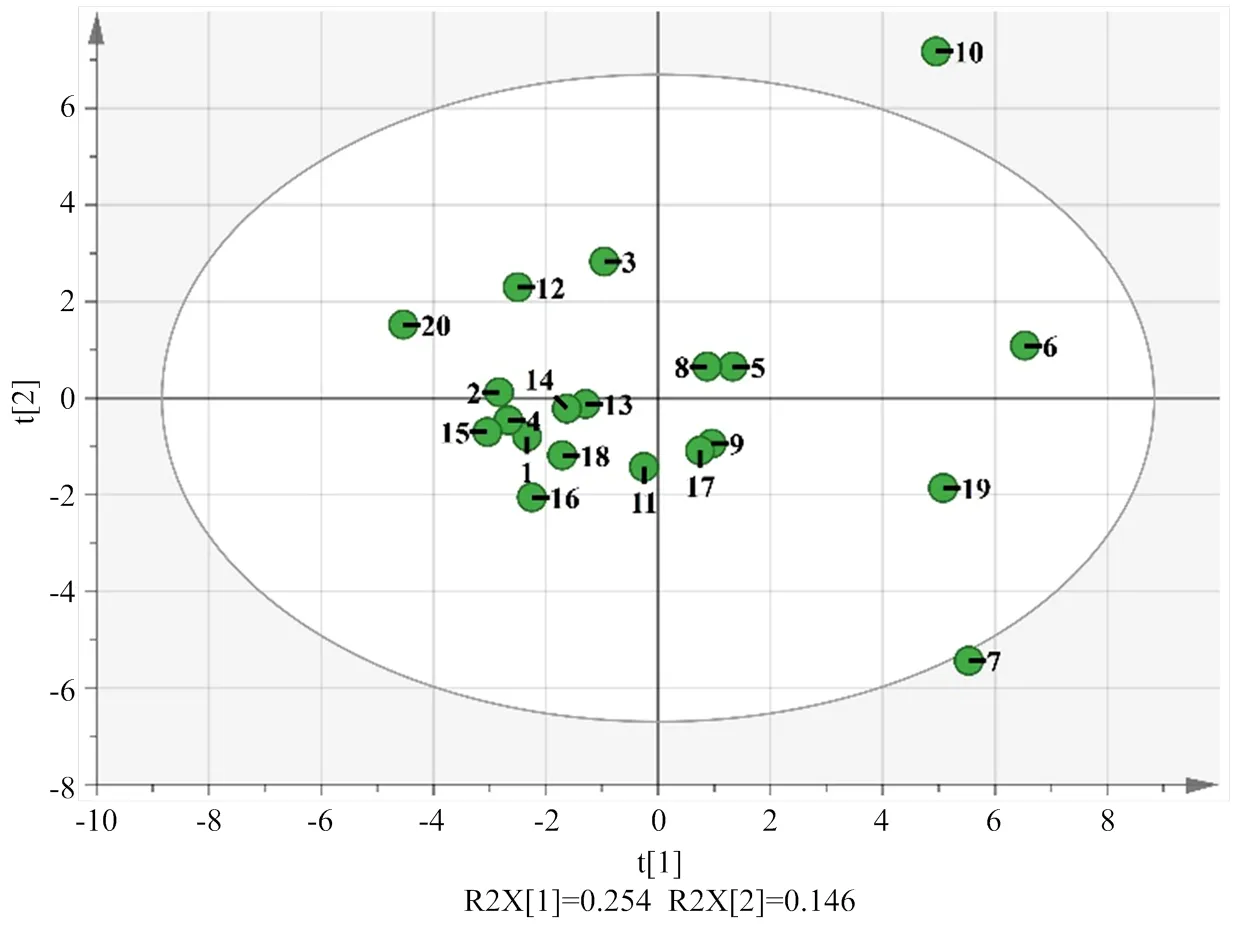
图4 不同品种苹果得分图
图5为不同品种苹果的果胶指标载荷图,图中p[1]对应解释得分图4中的t[1],即p[1]正向变量与得分图t[1]正向轴中样本的相关性呈正比,与t[1]负向轴中样本呈负相关。载荷图p[1]的绝对值越大,表明苹果品种间指标差异性越大。选定载荷图p[1]绝对值>0.25的果胶指标WSP-Gal、WSP-Ara、CSP-Gal、CSP-Rha、WSP-Fuc及CSP-II为苹果品种差异性分析的重要标识指标。结合前面对20份苹果果胶每个指标的分析,结果表明,WSP-Gal、WSP-Ara、CSP-Gal、CSP-Rha、WSP-Fuc及CSP-Rha/GalA这6个果胶指标在不同品种苹果间存在较大差异性,可作为区分20份苹果的差异性指标。
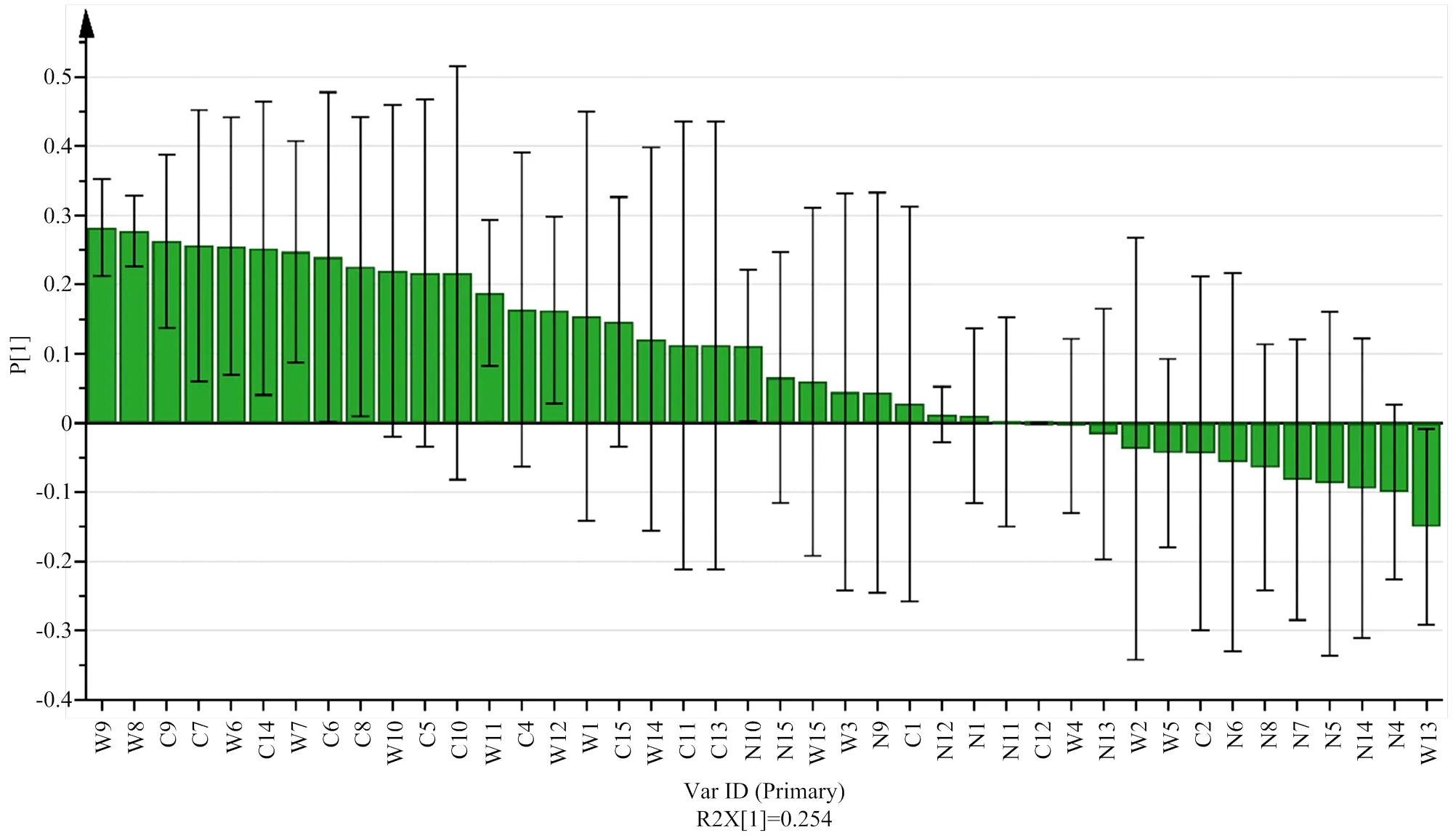
图5 不同品种苹果载荷图
3 讨论
本研究选取的来自全国七大主产地的不同主栽苹果品种,且探讨了3种类型的苹果果胶,是极大的创新点,研究结果可以用来构建苹果数据库,综合分析苹果特征性物质果胶的结构特点,为苹果中大分子物质结构的解析提供强有力的数据基础。
仅从单糖组分含量的表面数据分析果胶结构信息是单一的,单糖比率可以给出更深层次多方面的结构解析。果胶RG-I结构域是由多个重复的鼠李半乳糖醛酸二糖单元连接而成,在鼠李糖残基的C4位置可能发生阿拉伯聚糖、半乳聚糖或混合阿拉伯半乳聚糖的取代[25]。GalA/(Fuc+Rha+Ara+Gal+Xyl)可反映出果胶的线性度;Rha/GalA表征主链中RG类型结构区域在整个果胶所占比例,当Rha/GalA在0.05—1.00时,果胶结构主要为RG-I型,当Rha/GalA小于0.05时,果胶结构主要为HG和RG-II型;(Ara+Gal)/Rha是RG-I支链与Rha的比值,通过这个值可估计RG-I型果胶的侧链长度,值越大,链越长[39-40]。本研究PCA分析得WSP的Gal,WSP的Ara,CSP的Gal,CSP的Rha,WSP的Fuc及CSP的中性糖比率(鼠李糖与半乳糖醛酸含量的比值)是鉴别不同苹果样本的重要差异性指标。
本研究分析的果胶含量、酯化度、分子量及中性糖含量组成等指标已较全面地表征了苹果果胶的基本结构。研究结果表明NSP含量最多,WSP的DAc均在3.5%以下,中性糖含量组成均以Rha、Ara、Gal 3种单糖居多,与前人对苹果果胶的研究一致,但本试验也验证了苹果品种及产地对果胶含量的影响,发现苹果品种及产地对果胶乙酰化度、中性糖的含量组成及果胶结构域无明显影响。
本研究已印证我国不同主产区的不同主栽苹果品种的果胶含量高低,结合含果胶较多的苹果品种适宜加工成果汁、果酒、果酱等产品知识,研究结果为苹果加工制品的品质提升提供了数据基础,可帮助实现苹果加工品种专用化。例如富含果胶的‘澳洲青苹’是适宜制汁的品种,这与前人的研究以及现实生产相对应。原料果胶特征受品种、产地、成熟期等多因素的影响,一个试验取样很难兼顾多种因素,且目前对果胶精细结构的解析仍然是个世界难题。未来可针对单一品种不同产地或单一产地不同品种的苹果样本,不断扩大样本量,逐步开展系统研究。
4 结论
各品种苹果的3种类型果胶中,含量以NSP最多,WSP次之,CSP含量最少,最富含果胶含量的苹果品种是‘澳洲青苹’;‘秋锦’的WSP甲酯化度最高,CSP的DM偏高且大多数为高酯化度果胶;WSP的DAc均在3.5%以下,乙酰化度最高的苹果品种也是‘秋锦’;WSP的Mw于各品种苹果间差异性最为显著,辽宁‘华月’WSP的Mw最高;‘红将军’WSP的Mw/Mn最高,但其CSP的Mw/Mn最低;中性糖含量组成均以Rha、Ara、Gal 3种单糖居多,Fuc、Xyl、Man 3种单糖呈微量状态,通过中性糖比率分析可知各果胶结构主要以HG和RG-II型为主。
[1] 王盼. 苹果新品种的推广与保护建议. 果农之友, 2016(S1): 34-35.
WANG P. Suggestions on the promotion and protection of new apple varieties., 2016(S1): 34-35. (in Chinese)
[2] 程存刚, 赵德英, 宣景宏. 对我国苹果品种发展的几点建议. 北方果树, 2015(3): 52-53..
CHENG C G, ZHAO D Y, XUAN J H. Suggestions on the development of apple varieties in China.2015(3): 52-53. (in Chinese)
[3] Van Buren J P. The chemistry of texture in fruits and vegetables., 2010, 10(1): 1-23.
[4] 肖敏. 不同糖渗透处理和干燥方式对苹果脆片质构品质形成影响的研究[D]. 北京: 中国农业科学院, 2017.
XIAO M. Study on effects of osmotic dehydration with different saccharides arid drying methods on texture of dried apple chips [D]. Beijing: Chinese Academy of Agricultural Sciences, 2017. (in Chinese)
[5] ZHANG F S, DONG P, FENG L, CHEN F, WU J H, LIAO X J, HU X S. Textural changes of yellow peach in pouches processed by high hydrostatic pressure and thermal processing during storage., 2012, 5(8):3170-3180.
[6] 于铭章. 果胶对山楂加工的影响. 河北林果研究, 2009, 24(3): 309-310.
YU M Z. The effects of pectin on hawthorn processing., 2009, 24(3): 309-310. (in Chinese)
[7] SHOMER I, YEFREMOV T, MERIN U. Involvement of proteins in cloud instability of shamouti orange [(L.) Osbeck] juice., 1999, 47(7): 2623-2631.
[8] YEMENICIOGLOU A. Claud stabilization of naturally cloudy apple juices by heat treatments., 2000, 10(7): 278-282.
[9] 孟陆丽, 程谦伟, 易弋,熊炬. 果胶酶对百香果醋澄清作用的研究. 中国酿造, 2009, 28(12): 78-80.
MENG L L, CHENG Q W, YI G, XIONG J. Effect of pectinase on clarification of passion fruit vinegar., 2009, 28(12): 78-80. (in Chinese)
[10] WANG X, CHEN Q R, Lü X. Pectin extracted from apple pomace and citrus peel by subcritical water., 2014, 38(3): 129-137.
[11] ZHANG W B, XU P, ZHANG H. Pectin in cancer therapy: A review., 2015, 44(2): 258-271.
[12] OTLES S, OZGOZ S. Health effects of dietary fiber., 2014, 13(2): 191-202.
[13] PELLOUX J, RUSTÉRUCCI C, MELLEROWICZ E J. New insights into pectin methylesterase structure and function., 2007, 12(6): 267-277.
[14] 谢明勇, 李精, 聂少平. 果胶研究与应用进展. 中国食品学报, 2013, 13(8): 1-14.
XIE M Y, LI J, NIE S P. A review about the research and applications of pectin., 2013, 13(8): 1-14. (in Chinese)
[15] 赵光远, 刁华娟, 荆利强. 不同分子量和不同酯化度苹果果胶的研究. 食品与机械, 2011, 27(6): 47-50.
ZHAO G Y, DIAO H J, JING L Q. Studies on apple pectins of different molecular weight and different degree of esterification., 2011, 27(6): 47-50. (in Chinese)
[16] 刘凤霞, 王永涛, 廖小军. 高压和热处理对芒果浆粒度及水溶性果胶的影响. 食品科学, 2017, 38(5): 152-157.
LIU F X, WANG Y T, LIAO X J. Effect of high pressure processing and high-temperature short-time treatment on particle size and water soluble pectin of mango pulp., 2017, 38(5): 152-157. (in Chinese)
[17] 王蓉蓉, 李高阳, 单杨, 丁胜华. 不同品种枣果中果胶含量、中性单糖组成及分子质量分布. 中国食品学报, 2018, 18(6): 297-306.
WANG R R, LI G Y, SHAN Y, DING S H. Effect of various varieties jujube on the content, neutral monosaccharide composition and molecular weight distribution of pectin., 2018, 18(6): 297-306. (in Chinese)
[18] NJOROGE D M, KINYANJUI P K, MAKOKHA A O, CHRISTIAENS S, SHPIGELMAN A, SILA D N, HENDRICKX M E. Extraction and characterization of pectic polysaccharides from easy- and hard-to-cook common beans ()., 2014, 64: 314-322.
[19] KUMAR A, CHAUHAN G S. Extraction and characterization of pectin from apple pomace and its evaluation as lipase (steapsin) inhibitor., 2010, 82(2): 454-459.
[20] 罗亚楠, 于丽颖, 于晓洋. 苹果渣中果胶的提取及分析检测. 化学世界, 2015, 56(8): 450-452.
LUO Y N, YU L Y, YU X Y. Extraction and analysis of pectin in apple pomace., 2015, 56(8): 450-452. (in Chinese)
[21] CHO Y J, HWANG J K. Modeling the yield and intrinsic viscosity of pectin in acidic solubilization of apple pomace., 2000, 44(2): 85-89.
[22] HWANG J K, KIM C J, KIM C T. Extrusion of apple pomace facilitates pectin extraction., 1998, 63(5): 841-844.
[23] 田玉霞, 仇农学. 基于不同分子量级苹果果胶理化性质的研究. 农产品加工(学刊), 2009(3): 153-156.
TIAN Y X, QIU N X. Study on physico-chemical properties of apple pectin based on different molecular weights., 2009(3):153-156. (in Chinese)
[24] SILA D N, SMOUT C, ELLIOT F, LOEY A V, HENDRICKX M. Non-enzymatic depolymerization of carrot pectin: Toward a better understanding of carrot texture during thermal processing., 2006, 71(1): E1-E9.
[25] STOLLE-SMITS T, BEEKHUIZEN J G, RECOURT K, VORAGEN A G J, VAN DIJK C V. Changes in pectic and pemicellulosic polymers of green beans (L.) during industrial processing., 1998, 45(12): 4790-4799.
[26] BLUMENKRANTZ N, ASBOEHANSEN G. New method for quantitative determination of uronic acids., 1973, 54(2):484-489.
[27] LIU X, LIU J N, BI J F, YI J Y, PENG J, NING C Y, WELLALA C K D, ZHANG B Q. Effects of high pressure homogenization on pectin structural characteristics and carotenoid bioaccessibility of carrot juice., 2018, 203: 176-184.
[28] ŠIMKOVIC I, NUNEZ A, STRAHAN G D, YADAV M P, MENDICHI R, HICKS K B. Fractionation of sugar beet pulp by introducing ion-exchange groups.2009, 78(4): 806-812.
[29] PARK J K, KHAN T, JUNG J Y. Structural studies of the glucuronic acid oligomers produced by, strain., 2006, 63(4): 482-486.
[30] PINHEIRO E R, SILVA I M D A, GONZAGA L V, AMANTE E R, TEÓFILO R F, FERREIRA M M C, AMBONI R D M C. Optimization of extraction of high-ester pectin from passion fruit peel (flavicarpa) with citric acid by using response surface methodology., 2008, 99(13): 5561-5566.
[31] 杨振英. 黄色苹果新品种“华月”. 园艺学报, 2010, 37(11): 54.
YANG Z Y. A new yellow apple variety “Hua Yue”., 2010, 37(11): 54. (in Chinese)
[32] 张守江, 吴永锋. 几个适合在甘肃天水发展的元帅系品种介绍. 果农之友, 2007(10): 7.
ZHANG S J, WU Y F. Introduction of several Marshal varieties suitable for development in Tianshui, Gansu., 2007(10): 7. (in Chinese)
[33] 鲍敏达, 王娟. 红将军苹果在陇东的引种表现及栽培要点. 中国果树, 2008(5): 72.
BAO M D, WANG J. Introduction performance and cultivation points of Red General apple in Longdong., 2008(5): 72. (in Chinese)
[34] GNANASAMBANDAM R, Proctor A. Determination of pectin degree of esterification by diffuse reflectance fourier transform infrared spectroscopy., 2000, 68(3):327-332.
[35] NI W H, ZHANG X, BI H T, BEKOMO J I, JI L, SUNC X, FANGJ B, TAIG H, ZHOUY F, ZHAOJ M. Preparation of a glucan from the roots ofBge. and its immunological activity., 2009, 344(18):2512-2518.
[36] CAO W, LI X Q, LIU L, WANGM C, FANH T, LIC, LV Z G, WANGX J, MEIQ B. Structural analysis of water-soluble glucans from the root of(Oliv.) Diels., 2006, 341(11):1870-1877.
[37] DING X, FENG S, CAO M, LIM T, TANGJ, GUOC X, ZHANG J, SUNQ, YANGZ R, ZHAOJ. Structure characterization of polysaccharide isolated from the fruiting bodies of., 2010, 81(4):942-947.
[38] 巴巧瑞, 赵政阳, 高华, 王艳丽, 孙彪. 基于SSR和SRAP标记的苹果品种亲缘关系分析. 西北农林科技大学学报(自然科学版), 2011, 39(9):123-128.
BA Q R, ZHAO Z Y, GAO H, WANG Y L, SUN B. Analysis of genetic relationship of apple varieties based on SSR and SRAP markers., 2011, 39(9):123-128. (in Chinese)
[39] HOUBEN K, JOLIE R P, FRAEYE I, VAN LOEYA M, HENDRICKXM E. Comparative study of the cell wall composition of broccoli, carrot, and tomato: Structural characterization of the extractable pectins and hemicelluloses., 2011, 346(9):1105-1111.
[40] SCHOLS H A, VORAGEN A G J. Complex pectins: Structure elucidation using enzymes., 1996, 14:3-19.
Difference Analysis of Pectin Content and Structure from Various Apple Cultivars
CAO Feng1, 2, LIU Xuan1, BI JinFeng1, WU XinYe1, ZHANG Biao1, LIU JiaNing1
(1Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences/Key Laboratory of Agro-products Processing, Ministry of Agriculture and Rural Affairs, Beijing 100193;2School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, Liaoning)
【】The differences in pectin structure of different apple raw materials were compared and analyzed to give assistance for variety identification, so as to provide theoretical data basis for the processing of apple-related products and the utilization of apple by-products. 【】Twenty apple samples of fourteen cultivars from seven producing areas in China were researched. Three types of pectin were extracted from the alcohol-insoluble residue (AIR) of each apple, including water-soluble pectin (WSP), CDTA-soluble pectin (CSP) and Na2CO3-soluble pectin (NSP). The galacturonic acid (GalA) content, esterification degree, weight-average molar mass (Mw), neutral sugar content, and structural functional groups of pectin were analyzed, then the principal component analysis (PCA) and heat map analysis were performed. 【】The results showed that the content and structure of pectin were different in varying degrees. Among the three types of pectin, the content of NSP was the highest (determined with GalA as standard), followed by WSP and CSP. The most pectin-rich apple variety was the Granny Smith (215.75 mg GalA·g-1AIR). Fuji (Qixia, Xinjiang, Yan6-Qingdao and Hebei) from different regions had great differences in the contents of galacturonic acid. The DM of Qiujin was the highest among the WSP of various varieties of apples. CSP had relatively higher DM and the most of them were high DM pectin. The degree of acetylation of WSPs were all below 3.5%. The Mw of WSP was the most significant one among all apple varieties. The Mw of Huayue’s WSP showed the highest value. The Mw/Mn of Hongjiangjun’s WSP was the highest, but the Mw/Mn of Hongjiangjun’s CSP was the lowest one. Mw/Mn had a small difference between the three types of pectin. Through the heatmap analysis, Rhamnose (Rha), arabinose (Ara) and galactose (Gal) were three main neutral sugars, and fucose (Fuc), xylose (Xyl) and mannose (Man) were in trace amount. The reason for plenty of glucose might be due to the presence of soluble starch, dextrin or oligosaccharides during the extraction of pectin. The pectin structure mainly consisted of homogalacturonan and rhamnogalacturonan-II. The PCA showed that the main differential indexes of different apple cultivars were WSP-Gal, WSP-Ara, CSP-Gal, CSP-Rha, WSP-Fuc and CSP-Rha/GalA.【】There were certain differences among the content and structure of three types of pectin from various apple cultivars. Which were related to the pectin structural characteristics of apple varieties with parental and maternal crosses. The study could provide a theoretical support for the structural adjustment of apple breeding and planting.
apple cultivar; pectin; structure; difference
10.3864/j.issn.0578-1752.2019.13.011
2019-01-09;
2019-05-13
“十三五”国家重点研发计划(2016YFD0400201-4)
曹风,E-mail:caofengup@163.com。
毕金峰,E-mail:bjfcaas@126.com
(责任编辑 赵伶俐)

