马铃薯低温响应的ScmiR390-5p及其靶基因表达与结构分析
谢洁,王明,丁红映,李青,王万兴,熊兴耀,秦玉芝
马铃薯低温响应的及其靶基因表达与结构分析
谢洁1,王明1,丁红映1,李青1,王万兴2,熊兴耀2,秦玉芝1
(1湖南农业大学园艺园林学院,长沙 410128;2中国农业科学院蔬菜花卉研究所,北京 100081)
【】研究马铃薯富含亮氨酸重复序列(leucine-rich repeat receptor-like protein kinase LRR-RLK)类受体蛋白激酶基因受()调控响应非生物胁迫的机理。通过低温响应马铃薯miRNA测序分析与靶基因预测,发现通过调控1个可能的LRR类受体蛋白激酶基因对低温做出响应;利用实时荧光定量PCR技术(Quantitative Real-time PCR,RT-qPCR)验证和响应低温胁迫的表达情况;利用RLM-5′RACE确定作用于的切割位点;利用PCR技术克隆得到的DNA序列和CDS序列,生物信息学分析的结构和功能;利用RT-qPCR分析/在马铃薯各组织中的表达情况及其响应各种非生物胁迫的表达情况。RT-qPCR结果表明,低温诱导表达,的表达则受到低温的抑制,和的表达在低温胁迫下呈负相关性;RLM-5′RACE分析表明,作用于的切割位点是ATTCCT//CCTGAGTT,马铃薯/调控模块在低温响应中起作用。克隆结果表明的CDS序列长度为2 685 bp,编码894个氨基酸,DNA序列长度为3 549 bp,含有1个内含子、2个外显子、3′非编码区和5′非编码区,的靶位点位于CDS序列内部(960—981 bp,GGAACTATTCCTCCTGAGTTT)。生物信息学显示是1个富含亮氨酸重复序列(leucine-richrepeat,LRR)的类受体蛋白激酶基因,编码的蛋白属于跨膜分泌蛋白。马铃薯组织表达RT-qPCR分析显示,在叶中的表达量最高,根次之,茎中(地上茎、块茎和匍匐茎)表达量较低;而的表达情况与相反,其在叶中的表达最低,在茎中表达最高(匍匐茎>块茎>地上茎)。多种非生物胁迫结果显示,和表达在NaCl胁迫下呈负相关,受到NaCl胁迫诱导表达。与对照相比,ABA和6-BA处理下表达先下降之后呈波浪小幅回调;6-BA处理下表达持续升高,ABA处理下表达先上升后下降。GA3、PEG和IAA处理8 h时,的表达达到峰值,GA3、PEG和IAA处理都能诱导表达,但其变化趋势与相关性不强。具备编码LRR类受体蛋白激酶的核酸、氨基酸序列和结构基础,是的靶基因;/调控模块在马铃薯组织器官中具备明显作用;在转录后水平通过抑制马铃薯的表达对低温胁迫做出响应,同时,马铃薯调控模块在NaCl和6-BA胁迫响应中起作用,但不对ABA、GA3、IAA和PEG胁迫做出响应,和分别在转录水平受到ABA、GA3、IAA和PEG胁迫信号调控。
马铃薯;;;实时荧光定量PCR;RLM-5′RACE
0 引言
【研究意义】()家族是一个古老且高度保守的家族,广泛参与植物的生长发育、侧生器官极性形成、花器官形成及胁迫响应[1]。富含亮氨酸重复受体的蛋白激酶在参与植物抗逆性反应、发育调控及激素的信号转导等过程中发挥作用[2]。运用分子生物学手段探索胁迫相关基因的表达特征和受()调控的模式,对将来利用基因工程手段进行耐逆境马铃薯品种的选育与改良具有重要的意义。【前人研究进展】miRNA是一种转录后调控因子,通过对mRNA进行切割或造成翻译阻遏来抑制靶标基因的表达[3],实现对环境胁迫信号的响应[4-6]。研究表明进入RISC后通过“Two-Hit”(两个的靶向位点)的机制作用在上,诱导产生两个(靶向基因),这两个序列相似,都可以作用在上,对靶mRNA进行切割或翻译抑制使沉默[7]。植物在自然条件下经常受到冷、旱、NaCl、激素、重金属等多种非生物因素的胁迫,目前,对响应低温及各种非生物胁迫已有不少研究。木薯在低温胁迫下的表达量下降[8],高山冰缘植物高山离子芥中通过调控靶基因的表达对低温做出响应[9],在低温胁迫处理的甜杨幼苗叶片中表达升高,表达情况与在毛果杨受4℃低温处理后经微阵列分析获得的表达谱结果极为相似[10]。对烟草进行干旱胁迫和恢复浇水处理研究显示,在不同干旱条件下出现差异表达[11],表明可能参与植物的NaCl胁迫响应过程。研究人员通过分析NaCl胁迫下玉米冠根组织的降解组文库,检测到的靶标无机焦磷酸酶显著变化[12],在高粱[13]、烟草[14]、拟南芥[15]和大麦[16]等植物中都发现无机焦磷酸酶在NaCl胁迫下表达量发生改变,推测能通过调控无机焦磷酸酶的表达参与多种植物的NaCl胁迫响应;大豆研究中发现,还可以通过靶向作用于参与植物的NaCl胁迫响应[17]。激素胁迫同样影响的表达,BA能显著促进‘全明星’草莓试管苗中的表达;IAA也能显著提高其中的表达量[18]。Yoon等[19]研究指出,在高IAA浓度下(10 μmol·L-1或50 μmol·L-1)处理12—24 h,拟南芥的表达水平明显增加,而在低浓度(10 nmol·L-1)下处理相同时间,表达量没有显著差异。重金属胁迫是马铃薯生产过程中的重要影响因素之一,DING等[20]研究发现胁迫下过表达转基因株系中OsHMA和OsNramp的表达增强,促进了水稻地上部分镉积累量的增加。而亚麻中能编码转录本,推测通过调控亚麻植物的生长过程在Al胁迫中起作用[22]。本研究中的一个预测靶基因属富含亮氨酸重复受体的蛋白激酶,该类蛋白激酶是植物应答逆境和防御相关过程的重要酶类。LEE等[23]发现水稻中富含亮氨酸重复受体的蛋白激酶OsRLK1被低温和NaCl胁迫诱导表达,JUNG等[24]发现辣椒的CALRR1在高NaCl和脱落酸(ABA)等非生物胁迫下表达。【本研究切入点】/调控模块响应低温等非生物胁迫的研究目前还未见报道。本研究试图通过测序、RT-qPCR、克隆、RLM-5′ RACE等分子生物学手段探索马铃薯中/调控模块作用模式。【拟解决的关键问题】克隆、解析序列结构与功能,并研究/调控模块在低温、NaCl、6-BA、ABA、GA3、IAA和PEG胁迫下的响应情况,同时分析与在马铃薯不同组织中的调控关系。
1 材料与方法
1.1 植物材料
马铃薯GS393(LZ3.4),由美国威斯康星州马铃薯种质库(http://www.ars-grin. gov/npgs/acc/acc_queries.html)引进的耐寒马铃薯材料,耐-4℃低温,冷驯化后可耐-6℃。GS393组培苗按常规管理(19℃),出苗至茎抽生3—4节用于基因克隆和RLM-5′RACE试验。
1.2 试验处理
2016年12月,对60瓶生长期一致的组培苗进行冷驯化(5℃)及霜冻处理(-4℃),常规管理且生长期一致的组培苗作对照。进入冷驯化前所取混合样为CK;5℃驯化第1、2、3天的混合样为TLX1(对照为CLX1);5℃驯化第8、9、10天的混合样为TLX2(对照为CLX2);5℃驯化10 d后经-4℃霜冻处理的前1、2、3 h的混合样为TLH1(对照为CLH1);5℃驯化10 d后经-4℃霜冻处理的前7、8、9 h的混合样为TLH2(对照为CLH2)。2016年12月底播种,常规大田管理,于2017年4月分别取根、茎、叶、匍匐茎和块茎,进行及的各组织特异性表达分析。2017年11月对180瓶生长期一致的马铃薯GS393组培苗分别用100 mg∙L-1IAA、100 mg∙L-1ABA、100 mg∙L-16-BA、100 mg∙L-1GA3、11.7 g∙L-1NaCl和20 g∙L-1PEG胁迫处理,用于和的表达分析。以上试验均设置3次重复,取材后用液氮迅速冷冻,-80℃超低温冰箱中保存备用。
1.3 引物
利用Primer 5.0设计引物,由上海生工公司合成,其序列见表。
1.4 RNA的提取
总RNA的提取采用天根公司的多糖多酚植物总RNA提取试剂盒提取,的提取采用天根公司的miRcutemiRNA提取分离试剂盒。利用1.0%琼脂糖凝胶电泳检测总RNA的完整性,用德国eppendorf Biospectrometer® basic紫外可见光荧光分光光度计(eppendorf Biospectromete® basic,Germany)检测核酸的浓度和纯度。
1.5 RT-PCR
总RNA的反转录采用北京擎科新业生物技术有限公司的金牌逆转录试剂盒(GoldenstarTMRT6 cDNA Synthesis Kit),的反转录采用天根公司的miRcute增强型miRNAcDNA第一链合成试剂盒。
1.6 克隆
利用DNA凝胶回收试剂盒从琼脂糖凝胶中回收扩增片段,与pEASY®-T5Zero Cloning Vector载体连接,然后转化至大肠杆菌Trans-T1感受态细胞中,通过蓝白斑筛选PCR鉴定阳性克隆。DNA凝胶回收试剂盒购自北京擎科新业生物技术有限公司,pEASY®- T5Zero Cloning Kit载体购自泰思德公司,其他药品为国产分析纯。
1.7 实时荧光定量PCR
的RT-qPCR检测采用北京擎科新业生物技术有限公司的2×T5 Fast RT-qPCRMix,的RT-qPCR检测采用天根公司的miRcute增强型miRNA荧光定量检测试剂盒。使用ABI公司的7500定量PCR仪,96孔板和光学膜完成定量PCR反应。以rRNA基因作为管家基因,清水模板为阴性对照,采用2-△△Ct法计算相对表达量的高低。
1.8 RLM-5′ RACE
5′ RACE参照FirstChoice®RLM-RACE Kit试剂盒的方法进行,相应酶购自promega公司,接头引物由北京擎科新业生物技术有限公司合成。
1.9 序列测定及分析
测序工作委托北京擎科新业生物技术有限公司进行。利用NCBI (https://www.ncbi.nlm.nih.gov/)进行BLAST比对和基因编码区ORF的预测;使用SMART(http://smart.embl-heidelberg.de/)对进行结构域预测;使用portparam(http://web.expasy.org/ protparam/)工具分析SCLRRK1的理化性质;使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)对SCLRRK1进行跨膜区分析;使用signalP(http:// www.cbs.dtu.dk/services/SignalP-3.0/)对SCLRRK1的信号肽进行预测;使用NEBcutter(http://nc2.neb. com/NEBcutter2/index.php)对序列的限制性酶切位点进行分析;使用predictprotein(https:// www.predictprotein.org/)在线软件分析蛋白SCLRRK1的二级结构;使用SWISS-MODEL(http://www.swissmodel. expasy.org/)在线分析软件对SCLRRK1建模并获得三级结构模型。
2 结果
2.1 ScmiR390-5p负调控SCLRRK1并具有响应低温特性
2.1.1 马铃薯转录组及miRNA测序分析 采用Illumina HiSeqTM2500测序平台对样本进行转录组和miRNA高通量测序,以马铃薯(PGSC_DM_v4.03)为参考基因组,根据|log2 FC|≥1和FDR≤0.01比较、筛选差异表达基因(Differentially expressed genes,DEGs),与miRBase数据库进行比对—注释,将序列与miRBase中该miRNA成熟体序列进行无错配比对,比对上的序列定义为已知的miRNA。并以此为依据作为miRNA的表达量统计,进行DEGs分析。结果发现,低温驯化后期(8、9和10 d,图1-A)106个miRNA上调,11个miRNA下调。其中8个上调miRNA的靶基因表现为显著下调;3个上调miRNA的靶基因在转录组分析中表现为显著上调;11个下调miRNA的靶基因中有2个在转录组分析中表现为显著上调。进入霜冻处理,与对照材料比较,驯化后的材料霜冻处理早期(前1、2和3 h,图1-B)65个miRNA上调,238个miRNA下调。其中4个上调miRNA的靶基因在转录组分析中表现为显著下调;6个上调miRNA的靶基因在转录组分析中表现为显著上调。

表1 本研究所用引物序列
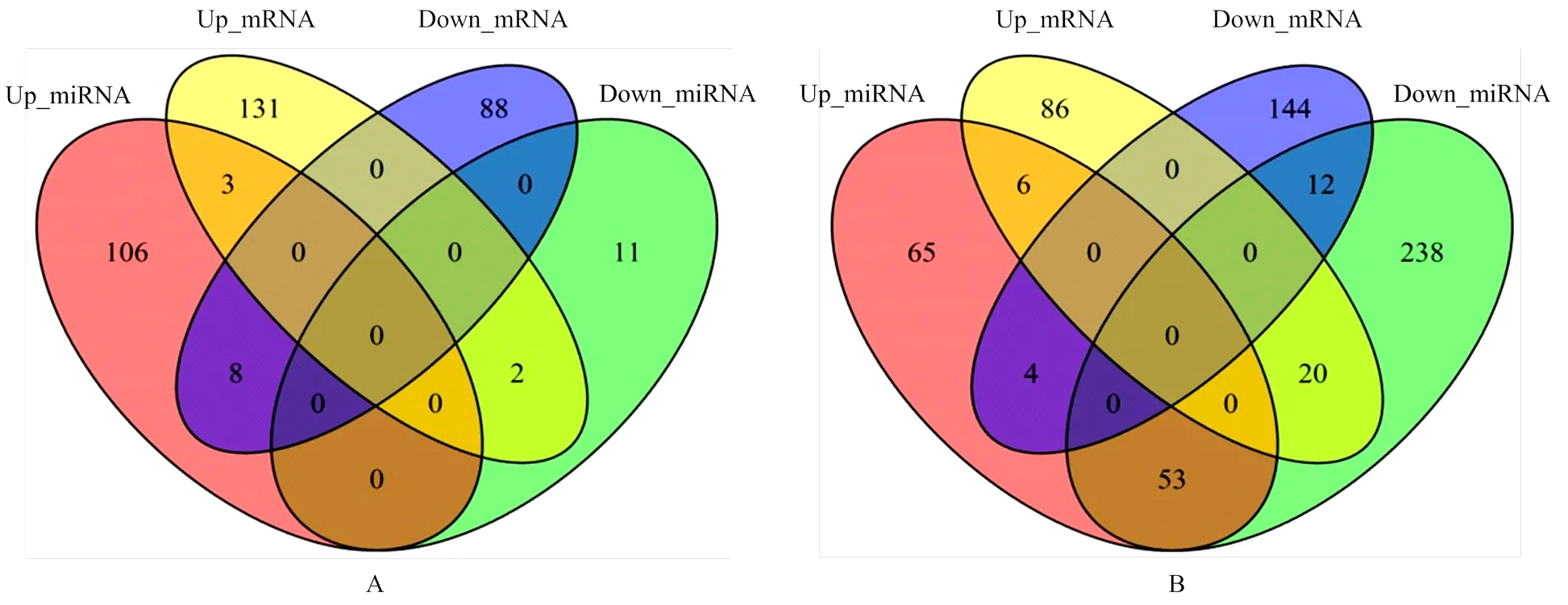
A: TLX2-CLX2; B: TLH1-CLH1
2.1.2靶基因预测 采用http://plantgrn. noble.org/psRNATarget/上的方法进行miRNA靶基因预测,并根据转录组测序结果分析其差异显著性与表达趋势,本研究关注的及其差异显著的靶基因表达情况见表2。因前期观察到驯化后期和进入霜冻前期都表现为上调,其预测靶基因()、和则表现为显著下调,本研究选定()作为先期靶向调控基因研究对象,进行基因克隆、靶向关系和胁迫响应分析。
2.1.3 低温胁迫下与的表达 通过生物信息学预测得到的靶基因(MG763883),RT-qPCR和半定量PCR结果如图2所示。随着低温5℃驯化时间的增加的表达量增加,靶基因的表达持续下降,与未经处理的GS393相比(CK),驯化后期的表达量仅0.05(图2-B,A为对照);未经驯化的材料在霜冻(-4℃)胁迫下的表达量持续上升,靶基因的表达下降,但下降幅度没有驯化胁迫明显(图2-C);驯化材料霜冻处理的表达下降,预测靶基因的表达持续上升,驯化材料霜冻处理后期的表达量达到272(图2-D)。结果表明,低温胁迫下与的表达量存在负相关性。
2.1.4 低温胁迫下可能通过结合的切割位点调控该基因表达 根据预测作用位点两翼设计两对引物,采用巢氏PCR扩增目的基因片段,如图3所示。靶基因扩增出明亮的产物料带,产物大小为415 bp,与预测结果一致,将上述PCR产物切胶回收直接与T载体连接,筛选鉴定阳性者送公司测序,克隆片段序列与预测结果一致,作用于靶基因的GGAACTATTCCT//CCTGAGTTT片段。与存在靶向关系,证明马铃薯低温胁迫响应中存在调控模块。

表2 不同处理间ScmiR390-5p及其差异显著的靶基因表达情况
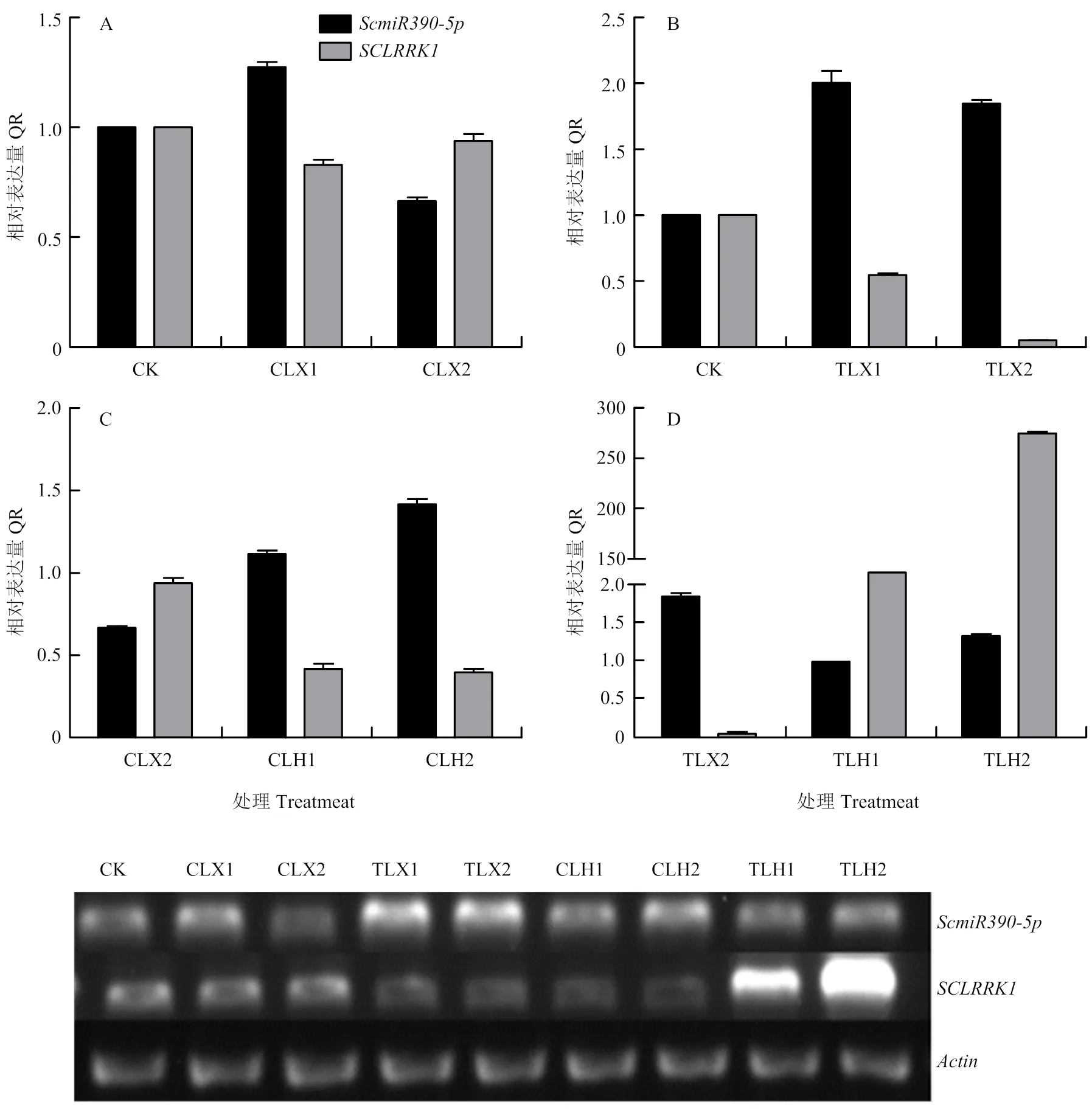
CK:未做处理样本取混合样;TLX1:5℃驯化第1、2、3天的混合样(对照CLX1);TLX2:5℃驯化第8、9、10天的混合样(对照CLX2);TLH1:5℃驯化10 d后经-4℃霜冻处理的前1、2、3 h的混合样(对照CLH1);TLH2:5℃驯化10 d后经-4℃霜冻处理的前7、8、9 h的混合样(对照CLH2)
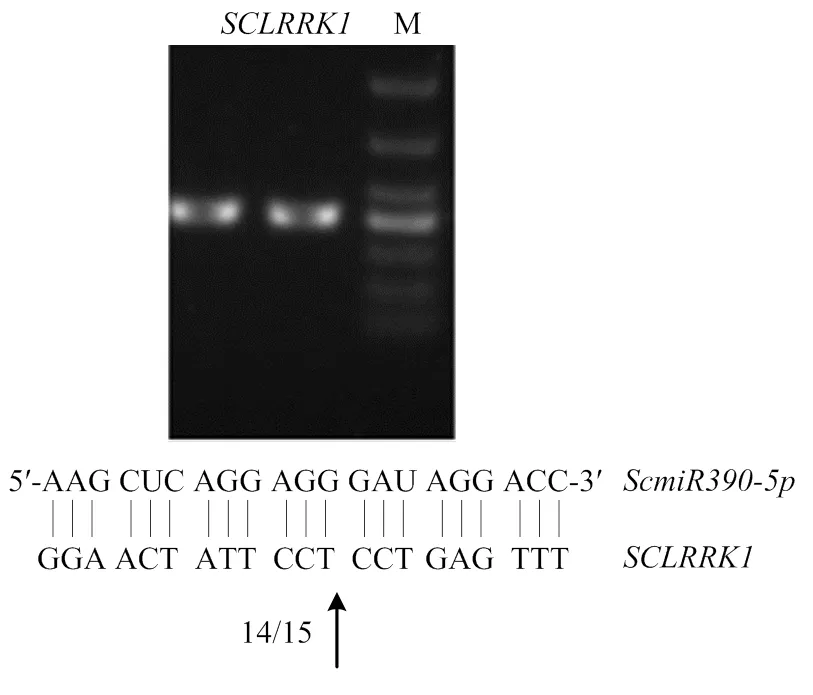
图3 ScmiR390-5p对SCLRRK1剪切位点的RLM–RACE验证
2.2 马铃薯SCLRRK1序列分析
2.2.1 马铃薯CDS序列分析 对NCBI的EST数据库中马铃薯EST数据库进行检索获得的序列信息。在CDS序列的两端设计引物,以马铃薯组培苗GS393的cDNA第一链为模板进行RT-PCR扩增,得到1条长度约2 685 bp的特异条带(图4-A),测序结果表明,该片段长度为2 685 bp,与马铃薯相关区段的同源性为99%,的靶序列处于CDS序列内部(960—981 bp,GGAACTA TTCCTCCTGAGTTT)。
2.2.2 马铃薯DNA序列分析 以马铃薯组培苗GS393的DNA为模板进行PCR扩增,得到1条约3 549 bp的特异条带(图4-B)。测序结果表明,该片段长度为3 564 bp,与马铃薯相关区段的同源性为95%。

图4 马铃薯SCLLRK1基因扩增结果
2.2.3的结构分析 采用portparam在线软件对的一级结构进行分析显示其分子质量约为223 kD,理论等电点pI为4.92,总共包括28 902个原子,分子式为C8300H13915N2687O3542S458。苏氨酸(Thr)的含量最高,达到32.18%。其不稳定指数为38.9,脂肪指数为28.31,根据Guruprasad方法表明SCLRRK1为稳定蛋白。总的亲水性平均系数为0.62,预测该蛋白属于疏水性蛋白。pedictprotein在线分析SCLRRK1的二级结构显示其α-螺旋占38.7%,延伸链占17.23%,β-折叠占8.28%,无规则卷曲占35.79%。SWISS-MODEL在线对SCLRRK1的三级结构进行分析。SCLRRK1整体呈现大螺旋的结构,主要由α-螺旋和无规则卷曲组成,α-螺旋和无规则卷曲中间有延伸链连接,含有少量的β-折叠,这与二级结构的预测结果基本一致。
2.2.4 SCLRRK1的功能域分析 通过在线ProtScale工具预测SCLRRK1的亲疏水性,SCLRRK1质氨基酸残基中氨基酸疏水性最大值为3.494,最小值为-2.526,疏水性氨基酸的数目大于亲水性氨基酸的数目,且在540—562位氨基酸(IVLAVIGSGLAVFVCVTVVVLLF)之间含有一个典型的疏水区域,可见SCLRRK1为疏水性蛋白(图5)。使用TMHMM在线分析软件对SCLRRK1进行跨膜区分析显示编码区序列存在明显的跨膜结构区域,1—539位氨基酸位于细胞膜表面,540—562位氨基酸之间形成一个典型的跨膜螺旋区,563—694位氨基酸位于细胞内,与该蛋白的疏水性区域分析结果基本一致,表明该蛋白可能是一个与细胞信号传导有关的膜受体蛋白(图6)。使用SignalP4.1server对马铃薯进行信号肽预测显示C score表示剪切位点分值(C值),S score表示信号肽分值(S值),Y score表示综合剪切位点分值(Y值)。的S平均值大于0.5,预测该基因为分泌蛋白且存在信号肽。从图7中可以明显看出N端信号肽,剪切点位于25和26位氨基酸之间。

图5 SCLRRK1亲水性/疏水性预测

图6 SCLRRK1的跨膜区预测
2.2.5 SCLRRK1的氨基酸序列分析 SMART结构域预测,结合氨基酸序列分析(图8),得知SCLRRK1是一类LRR型富含Ser/Thr/Tyr的蛋白激酶,第2—17个氨基酸和第566—576的氨基酸间含有两个低复杂度区域,第90—113个氨基酸、第114—137个氨基酸、第138—162个氨基酸、第210—234个氨基酸、第330—354个氨基酸和第426—451个氨基酸间含有6个LRR区域,是富含亮氨酸的重复序列,第540—562个氨基酸间含有一个跨膜结构域,第613—888个氨基酸间含有1个蛋白激酶基因STYKc域。克隆并完成系统分析后在NCBI上进行基因注册(MG763883),并命名为。

图7 SCLRRK1的信号肽预测

方框内为低复杂度区域;单下划线为LRR区域;双下划线为跨膜螺旋区;阴影部分为蛋白激酶基因STYKc域;椭圆内是ScmiR390-5p的识别位点
2.3 ScmiR390-5p和SCLRRK1的组织表达特异性
如图9所示,在叶中的表达量最高,根次之,在块茎和匍匐茎中的表达量较低;而的表达情况与相反,其在叶中的表达最低,在匍匐茎中的表达最高,块茎次之。该结果与调控模块中负调控关系相符。
2.4 马铃薯SCLRRK1的部分非生物胁迫响应
与对照相比,ABA和6-BA处理24 h时表达量最低,之后呈波浪小幅回调;6-BA处理8 h,达到表达峰值,之后40 h内维持高位水平,ABA处理36 h表达呈波浪上升到峰值后快速下降;GA3、PEG和IAA处理8 h即表达达到峰值,GA3、PEG和IAA处理都能诱导表达,但其变化趋势与相关性不强;在NaCl处理8 h时出现表达下降,之后回升(图10)。NaCl和6-BA胁迫处理的各时间点上,表达趋势都与相反,分析认为负调控在转录后水平对NaCl胁迫做出响应,即马铃薯调控模块在NaCl和6-BA胁迫响应中起作用,而在响应ABA、GA3、IAA和PEG胁迫时,和可能分别受到各自的转录水平调控。

图9 ScmiR390-5p和SCLRRK1在各组织中表达的实时荧光定量分析和半定量分析
3 讨论
已有研究表明在植物感受逆境胁迫而做出适应性调整过程中miRNA可以通过调控靶基因的表达来参与植物逆境的调控[25-26]。在逆境胁迫下,植物体内形成非生物胁迫因素、miRNA/靶基因、其他相关miRNA等多方面因素反馈环路网络[27-28]。/tasiRNA/ ARF在叶等器官的极性发育[29],特别对植物横向器官发育及生长时期的转变[30]等方面有重要调控作用,/TAS3/ARF2/ARF3/ARF4定量控制侧根生长的作用模式已经得到证实[31]。响应低温[8-10]及各种非生物胁迫[15-22]也有不少研究,但在响应非生物胁迫过程中的具体靶向(基因)报导多局限于生物信息预测阶段,随着研究的深入及技术不断发展,挖掘miRNAs的潜在靶基因及验证其功能对于阐明miRNAs调控机制意义重大。

图10 ScmiR390-5p和SCLRRK1在各种非生物胁迫下的实时荧光定量PCR分析
本研究通过对的靶基因进行生物信息学预测获得一个类酪氨酸型富含亮氨酸重复的类受体蛋白激酶靶蛋白,并通过RLM- 5′RACE验证了作用于的靶点,序列系统分析表明,主要包括胞内激酶域(cytoplasmic protein kinase domain)、胞外结构域(extracellular domain)和跨膜结构域(transmembran domain)[32]等多种信号识别传递途径中的关键组分,它们作为质膜受体能够感受外界刺激,通过磷酸化作用参与胞内信号传递。LRR型类受体蛋白激酶是植物中已知的最大的一类跨膜类受体蛋白激酶,其在植物生长发育激素信号转导以及胁迫反应中具有重要的调控功能。大部分LRR型类受体蛋白激酶的N-末端有信号肽(signal peptide)和亮氨酸拉基序(leucine zipper motif),胞外域包含多个LRR基序,每个基序都有保守序列lxxlxxlxxlx-lxxnxlvgxip,激酶域靠近C末端[33-38]。LEE等[23]发现水稻LRR类受体蛋白激酶Os-RLK1能够被低温诱导表达,余刚等[39]将得到的四翅滨藜LRK基因导入到酿酒酵母中,发现其在低温等胁迫下的存活率明显高于对照,表明其具有较好的耐低温等能力。本研究也发现在马铃薯低温胁迫条件下表达受到抑制,证实LRR型类受体蛋白激酶参与低温胁迫响应过程。研究同时发现低温诱导表达,表达与之负相关,即/模块对低温做出响应。另外,经过5℃冷驯胁迫处理10 d的马铃薯在进行霜冻处理,的表达量升高,与没进过冷驯化的材料表现出相反的表达模式,推测持续低温胁迫下/模块随着低温作用时间的延长可能存在反馈调节。进一步分析/模块的组织特异性,结果发现在叶中的表达量最高,根次之,在块茎和匍匐茎中的表达量较低;而的表达情况与相反。该结果暗示/模块也可能参与马铃薯器官发育,具体有待进一步深入研究证实。
富含亮氨酸重复的类受体蛋白激酶在其他非生物胁迫反应中也发挥着重要的作用,胞外串联排列的LRRs基序能够接受外来的信号,除了激素等小分子化合物以外,它还能接受一些小分子多肽类激素的信号。HONG等[40]从拟南芥植株克隆得到,在干旱或高NaCl胁迫下其表达量明显增高。本研究还发现负调控,在转录后水平对NaCl和6-BA胁迫做出响应,即马铃薯调控模块在NaCl和6-BA胁迫响应中起作用,而在响应ABA、GA3、IAA和PEG胁迫时,和可能分别受到各自的转录水平调控。
4 结论
RT-qPCR和半定量PCR表明,在低温胁迫下,负调控表达,RLM-5′RACE证实调控转录的切割位点是ATTCCT//CCTGAGTT。克隆获得的CDS序列和DNA序列,生物信息学分析表明是一类富含亮氨酸重复受体类蛋白激酶,属于典型的跨膜疏水性蛋白,存在多个胞外LRR结构域、1个单次跨膜区以及1个胞内激酶结构域。
/调控模块在马铃薯组织器官中具备明显作用;在转录后水平通过抑制马铃薯的表达对低温胁迫做出响应。同时,马铃薯调控模块在NaCl和6-BA胁迫响应中起作用。/调控模块不对ABA、GA3、IAA和PEG胁迫做出响应,和分别在转录水平受到上述信号调控。
[1] 谢洁, 王明, 李青, 潘妃, 熊兴耀, 秦玉芝. 植物的研究进展. 生物技术通报, 2018, 34(6): 1-10.
XIE J, WANG M, LI Q, PAN F, XIONG X Y, QIN Y Z. Research progress of plant miR390., 2018, 34(6): 1-10. (in Chinese)
[2] 马媛媛, 甘睿, 王宁宁. 植物富含亮氨酸重复序列型类受体蛋白激酶的生物学功能. 分子植物(英文版), 2005, 31(4): 331-339.
MA Y Y, GAN R, WANG N N. Biological functions of leucine-rich repeat class of receptor-like protein., 2005, 31(4): 331-339. (in Chinese)
[3] 魏强, 梁永宏, 李广林. 植物miRNA的进化. 遗传, 2013, 35(3): 315-323.
WEI Q, LIANG Y H, LI G L. Evolution of miRNA in plants., 2013, 35(3): 315-323. (in Chinese)
[4] Sunkar R, Li Y F, Jagadeeswaran G. Functions ofin plant stress responses., 2012, 17(4): 196-203.
[5] Khraiwesh B, Zhu J Y, Zhu J H. Role of miRNAs and siRNAs in biotic and abiotic stress responses of plants., 2012, 1819(2):137-148.
[6] Sunkar R. MicroRNAs with macro-effects on plant stress responses., 2010, 21(8): 805-811.
[7] Xia R, Xu J, Meyers B C. The emergence, evolution, and diversification of the-TAS3-ARF pathway in land plants., 2017, 29(6):1232-1247.
[8] 薄维平. 木薯耐寒相关microRNA的差异表达分析[D]. 海口: 海南大学, 2010.
BO W P. Analysis of differential expression of cold-tolerance related microRNA in cassava [D]. Haikou: Hainan University, 2010. (in Chinese)
[9] 党春艳. 高山离子芥低温胁迫调控的miRNAs及其靶基因的表达分析[D]. 兰州: 兰州大学, 2013.
DANG C Y. Expression anaysis of chilling-stress regulated minRNAs and targets in[D]. Lanzhou: Lanzhou University, 2013. (in Chinese)
[10] 孙润泽, 侯琦, 章文乐. 甜杨低温响应microRNAs的克隆与分析. 基因组学与应用生物学, 2011, 30(2): 204-211.
SUN R Z, HOU Q, ZHANG W L. Cloning and analysis of the low temperature stress-responsive microRNAs from., 2011, 30(2): 204-211. (in Chinese)
[11] Chen Q S, Li M, Zhang Z C, Tie W W, Chen X, Jin L F, Zhai N, Zheng Q X, Zhang J F, Wang R, Xu G Y, Zhang H, Liu P P, Zhou H N. Integrated mRNA and microRNA analysis identifies genes and small miRNA molecules associated with transcriptional and post-transcriptional-level responses to both drought stress and re-watering treatment in tobacco., 2017, 18(1):62-77.
[12] 翟立红. 玉米冠根和雄穗中microRNA及Argonaute基因表达的研究[D]. 武汉: 华中农业大学, 2013.
ZHAI L H. Characterization and expression and analysis of microRNA and argonaute genes in crown roots and tassel of maize [D].Wuhan: Huazhong Agricultural University, 2013. (in Chinese)
[13] 王宝山, 邹琦. NaCl胁迫对高粱根、叶鞘和叶片液泡膜ATP酶和焦磷酸酶活性的影响. 植物生理学报, 2000, 26(3): 181-188.
WANG B S, ZOU Q. Effects of NaCl stress on the tonoplast ATPase and PPase activity in roots, sheaths and blades of sorghum seedlings., 2000, 26(3):181-188. (in Chinese)
[14] 郭兆奎. 烟草吸钾相关基因克隆与表达调控研究[D]. 哈尔滨: 哈尔滨工业大学, 2008.
GUO Z K. The cloning and expression regulation of potassium uptake relative genes in[D]. Harbin: Harbin Institute of Technology, 2008. (in Chinese)
[15] 王波. 拟南芥和NaCl生植物灰绿藜液泡膜焦磷酸酶基因与TIR1基因表达相关性分析[D]. 乌鲁木齐: 新疆大学, 2007.
WANG B. Analysis on gene expression correlation between vacuolar H+-pyrophosphatase and TRANSPORT INHIBITOR RESPONSE1 (TIR1) inand halophyte[D]. Urumqi: Xinjiang University, 2007. (in Chinese)
[16] 佐拉. 野生大麦与栽培大麦耐NaCl性的生理及遗传差异研究[D]. 杭州: 浙江大学, 2014.
ZUO L. Physiological and genetic difference in salt stress tolerance in wild and cultivated barleys [D]. Hangzhou: Zhejiang University, 2014. (in Chinese)
[17] 吴冰月, 宋普文, 陈华涛. 2个大豆RNA依赖的RNA聚合酶基因和的克隆与分析. 南京农业大学学报, 2014, 37(3): 27-34.
WU B Y, SONG P W, CHEN H T. Cloning and expression pattern analysis ofandin soybean., 2014, 37(3): 27-34. (in Chinese)
[18] 李贺, 毛健鑫, 戚华彩. 草莓miR390基因及其启动子的鉴定与表达分析. 果树学报, 2014, 31(3): 362-336.
LI H, MAO J X, QI H C. Identification and expression analysis ofgene and its promoter from strawberry., 2014, 31(3): 362-336. (in Chinese)
[19] YOON E K, YANG J H, LIM J, KIM S H, KIM S K, LEE W S. Auxin regulation of the microRNA390-dependent transacting small interfering RNA pathway inlateral root development., 2010, 38: 1382-1391.
[20] DING Y F, YE Y Y, JIANG Z H, WANG Y, ZHU C. MicroRNA390 is involved in cadmium tolerance and accumulation in rice., 2016, 7(127): 235-244.
[21] 刘凉琴, 宋爱萍, 张永侠. 马蔺根系响应Cd胁迫的miRNA高通量测序分析. 植物资源与环境学报, 2016, 25(3): 1-11.
LIU L Q, SONG A P, ZHANG Y X. High throughput sequencing analysis on miRNA in root ofvar.response to Cd stress., 2016, 25(3): 1-11. (in Chinese)
[22] Dmitriev A A, Kudryavtseva A V, Bolsheva N L, Zyablitsin A V, Rozhmina T A, Kishlyan N V, Krasnov G S, Speranskaya A S, Krinitsina A A, Sadritdinova A F, Snezhkina A V, Fedorova M S, Yurkevich O Y, Muravenko O V, Belenikin M S, Melnikova N V. miR319, miR390, and miR393 are involved in aluminum response in flax (L.)., 2017, 2017: 4975146.
[23] LEE S C, KIM J Y, KIM S H, KIM S J, LEE K, HAN S K, CHOI H S, JEONG D H, AN G, KIM S R. Trapping and characterization of cold-responsive genes from T-DNA tagging lines in rice., 2004, 166(1): 69-79.
[24] JUNG E H, JUNG H W, LEE S C, HAN S W, HEU S, HWANG B K. Identification of a novel pathogen-induced gene encoding a leucine- rich repeat protein expressed in phloem cells of., 2004, 1676(3): 211-222.
[25] SUNKAR R, ZHU J K. Novel and stress-regulated microRNAs and other small RNAs from., 2004, 16(8): 2001-2019.
[26] KHRAIWESH B, ZHU J Y, ZHU J H. Role of miRNAs and siRNAs in biotic and abiotic stress responses of plants., 2012, 1819(2): 137-148.
[27] MENG Y J, SHAO C G, MA X X, WANG H Z, CHEN M. Expression-based functional investigation of the organ-specific microRNAs in., 2012, 7(11): e50870.
[28] DING Y F, TAO Y L, ZHU C. Emerging roles of microRNAs in the mediation of drought stress response in plants., 2013, 64(11): 3077-3086.
[29] GARCIA D, COLLIER S A, BYRNE M E, MARTIENSSEN R A. Specification of leaf polarity invia the trans-acting siRNA pathway., 2006, 16(9): 933-938.
[30] CHO S H, CORUH C, AXTELL M J. miR156 and miR390 regulate tasiRNA accumulation and developmental timing in., 2012, 24(12): 4837-4849.
[31] MARIN E, JOUANNET V, HERZ A, LOKERSE A S, WEIJERS D, VAUCHERET H, NUSSAUME L, CRESPI M D, MAIZEL A. miR390,TAS3 tasiRNAs, and their AUXIN RESPONSE FACTOR targets define an autoregulatory network quantitatively regulating lateral root growth., 2010, 22(4): 1104-1117.
[32] HANKS S K, QUINN A M, HUNTER T. The protein kinase family: Conserved features and deduced phylogeny of the catalytic domains., 1988, 241(4861): 42-52.
[33] 牛吉山. 植物和小麦蛋白激酶的研究现状. 西北植物学报, 2003, 23(1): 143-150.
NIU J S. Studies on plant and wheat protein kinases., 2003, 23(1): 143-150.
[34] Ullrich A, Schlessinger J. Signal transduction by receptors with tyrosine kinase activity., 1990, 61(2): 203-212.
[35] Stone J M, Walker J C. Plant protein kinase families and signal transduction., 1995, 108(2): 451-457.
[36] Mizuno S, Osakabe Y, Maruyama K, Ito T, Osakabe K, Sato T, Shinozaki K, Yamaguchi-Shinozaki K. Receptor- like protein kinase 2 (RPK 2) is a novel factor controlling anther development in., 2010, 50(5): 751-766.
[37] XU Z S, Xiong T F, Ni Z Y, Chen X P, Chen M, Li L C, Gao D Y ,Yu X D, Liu P, Ma Y Z. Isolation and identification of two genes encoding leucine-rich repeat (LRR) proteins differentially responsive to pathogen attack and salt stress in tobacco., 2009, 176(1): 38-45.
[38] HAN R, Jian C, Lv J Y, Yan Y, Chi Q, Li Z J, Wang Q, Zhang J, Liu X L, Zhao H X. Identification and characterization of microRNAs in the flag leaf and developing seed of wheat (L.)., 2014, 15: 289.
[39] 余刚, 李敬涛, 孙新华, 刘金亮, 潘洪玉. 四翅滨藜LRR类受体蛋白激酶基因在酵母中的表达及抗逆分析. 吉林大学学报(理学版), 2012, 50(6): 1257-1263.
YU G, LI J T, SUN X H, LIU J L, PAN H Y. Expression and functional characterization of an AcLRR gene fromin yeast., 2012, 50(6): 1257-1263. (in Chinese)
[40] HONG S W , JON JH, KWAK J M, NAM H G . Identification of a receptor-like protein kinase gene rapidly induced by abscisic acid, dehydration, high salt, and cold treatments in., 1997, 113(4):1203-1212.
Expression and Structural Analysis ofand Its Target Genes in Potato Response to Low Temperature
XIE Jie1, WANG Ming1, DING HongYing1, LI Qing1, WANG WanXing2, XIONG XingYao2, QIN YuZhi1
(1College of Horticulture and Landscape, Hunan Agricultural University, Changsha 410128;2Institute of Vegetables and Flowers, Chinese Academy of Agricultural Sciences, Beijing 100081)
The study was carried out to investigate the mechanism of potato leucine-rich repeat receptor-like protein kinase (LRR-RLK) receptor protein kinase SCLRRK1 regulated by() in response to abiotic stress.【】 By sequencing and analyzing potato miRNAs in response to low temperature conditions and predicting target genes, we found thatresponded to low temperatures by regulating a potential LRR-like receptor protein kinase gene. The expression levels ofandonwas determined by using RLM-5'RACE. The DNA sequence and CDS sequence ofwere cloned by PCR and the structure and function of SCLRRK1 were predicted by bioinformatics analysis. The expression levels of/【】 The results of RT-qPCR showed that the expression ofwas induced by low temperature, while the expression ofwas inhibited. There was a negative correlation between the expression of ScmiR390-5p and scrrk1 under low temperature stress. The result of RLM-5′RACE indicated that cleavage site ofonwas ATTCCT// CCTGAGTT, and potato/regulatory module was respond to low temperature. The cloning results indicated that the CDS ofwas 2 685 bp in length, encoding 894 amino acids, and the gene sequence was 3 549 bp containing 1 intron, 2 exons, 3' non-coding region and 5' non-coding region.target site was located atCDS (960-981 bp, GGAACTATTCCTCCTGAGTTT). Bioinformatics analysis showed that theencoded a leucine-richrepeat (LRR)-like receptor protein kinase, belonging transmembrane secreted protein. RT-qPCR analysis of potato tissue expression pattern showed that the expression level of thewas highest in the leaves, followed by roots, and relatively lowers in stem (terrestrial stem, tuber and stolon). Differently, the expression level ofwas the lowest in leaves and the highest in stems. The results under various abiotic stresses showed thatthe expression ofandwas negatively correlated, andwas induced by NaCl stress. Compared with the control, the expression ofwas decreased and then increased slightly after treatment with ABA and 6-BA. Thelevel increased continuously under 6-BA treatment, while the expression ofincreased first and then decreased under ABA treatment. The expression ofreached the peak after treatment with GA3, PEG and IAA for 8 h. The expression ofwas induced by GA3, PEG and IAA, but the change trend was not correlated to. 【】had the amino acid sequence and structural basis of nucleic acid to encode LRR-like receptor protein kinase, which was the target gene of;/regulatory module had a significant role in potato tissues;responded to low temperature stress by inhibiting the expression of potatoat the post-transcriptional level, while/regulated module played a role in salt and 6-BA stress response. The/regulatory module did not respond to ABA, GA3, IAA and PEG stress, and theandwere regulated by the above signals at the transcriptional level, respectively.
potato;;;quantitative real-time PCR; RLM-5′RACE
10.3864/j.issn.0578-1752.2019.13.009
2019-01-03;
2019-05-13
国家自然科学基金(31371683)
谢洁,Tel:0731-84618171;E-mail:358562505@ qq.com。
秦玉芝,Tel:0731-84618171;E-mail:qyuz@163.com
(责任编辑 赵伶俐)

