转OvBAN/bar双价基因的紫花苜蓿对虫蚀及除草剂的耐受性分析
董文科 ,陈春艳,马晖玲*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.河南科技大学农学院,河南 洛阳 471003)
紫花苜蓿(Medicagosativa)是栽培面积最广的多年生豆科牧草之一,其品质优良、营养成分丰富、适口性佳且易于栽培,被誉为“牧草之王”[1]。但随着苜蓿种植面积的不断扩大,苜蓿虫害日趋严重,其不仅减少牧草产量,降低饲草品质,且影响光合作用,传播病毒,降低苜蓿对水分和养分的利用率[2-3]。据报道,苜蓿虫害严重发生时草产量下降25%~50%[4]。然而,目前抗虫紫花苜蓿栽培品种较少,实际生产中主要以化学防治为主[5]。因此,利用基因工程手段培育综合性状优良的抗虫品种十分迫切。
目前,在抗虫基因工程中经常使用的基因主要包括苏云金芽孢杆菌杀虫晶体蛋白基因、蛋白酶抑制剂基因、植物凝集素基因和胆固醇氧化酶基因等[6]。尽管这些基因显著提高了作物的抗虫效果,但也会导致作物某些物质组分或含量发生非预期效应,并通过食物链的结构和信息联系对天敌昆虫的亚群落结构产生负面影响[7]。单宁是植物在系统发育过程中形成的一种天然的、对生态环境安全且能起到自我保护作用的多酚类次生代谢产物,主要存在于双子叶植物细胞壁或茎、叶、花和种子的液泡中[8]。研究表明,单宁具有抵御虫害的作用,其抗虫机理是能与昆虫体内的消化酶结合成复合体,沉淀蛋白质,抑制酶活性,从而降低昆虫对食物中蛋白质等营养物质的消化利用,抑制昆虫发育[9]。单宁根据化学结构特性不同可以分为水解单宁(hydrolyable tannin, HT)和缩合单宁(condensed tannins, CTs)[10],其中缩合单宁的含量与植物抗虫性密切相关[11]。缩合单宁生物合成途径主要包括公共苯丙烷代谢途径、类黄酮-花青素代谢途径和缩合单宁特异代谢途径,其中缩合单宁特异代谢途径决定缩合单宁的积累[12]。花青素还原酶(anthocyanin reductase, ANR)是该途径的关键酶,其由BANYULS(BAN)编码,它可将花青素立即催化合成2,3-顺式-黄酮-3-醇,之后将2,3-顺式-黄酮-3-醇进一步聚合为缩合单宁[13]。目前,已从拟南芥(Arabidopsisthaliana)[14]、蒺藜苜蓿(Medicagotruncatula)[15]、百脉根(Lotuscorniculatus)[16]和葡萄(Vitisvinifera)[17]等植物中成功克隆并证实BAN基因的功能。研究发现,紫花苜蓿BAN基因在荚果中表达量较高,导致紫花苜蓿缩合单宁主要积累在种皮中,而在植株中的含量较低,这也说明苜蓿体内存在缩合单宁合成途径,但植株中控制缩合单宁合成的BAN基因可能为隐性基因[18],而通过常规育种获得隐性纯合体的概率较低,所以目前还没有选育出植株中含有缩合单宁的紫花苜蓿新品种[8]。因此,通过转基因技术将花青素还原酶基因导入紫花苜蓿体内,有望增加苜蓿叶片中缩合单宁含量,提高抗虫性。
杂草对紫花苜蓿整个生育期的危害也是造成苜蓿产量和品质下降的重要因素[19]。随着苜蓿种植面积的不断扩大,人工和机械除草方式已无法快速达到除草效果,化学除草已成为目前消除苜蓿田杂草的主要方式。bar基因具有广谱性除草剂草铵膦抗性,通过基因工程手段已将bar基因导入小麦(Triticumaestivum)、水稻(Oryzasativa)、玉米(Zeamays)和马铃薯(Solanumtuberosum)等20多种作物中,并获得了相应的抗除草剂种质[20]。因此,将bar基因导入紫花苜蓿体内并配合相应的除草剂,能有效去除杂草,大大减少劳动力,提高苜蓿产量。
本研究在课题组前期从甘肃红豆草(Onobrychisviciaefolia. cv. Gansu.)中克隆并构建的OvBAN/bar双价基因及获得的转紫花苜蓿植株基础上,探索了其对苜蓿蚜虫的抗性,同时进行了除草剂抗性试验,以期筛选获得抗虫性强并具除草剂抗性的紫花苜蓿种质资源,并为抗虫转基因的研究提供新思路和新方法。
1 材料与方法
1.1 试验材料
供试转基因株系及受体“甘农3号”紫花苜蓿(M.sativa. cv. Gannong No.3),由甘肃农业大学草业学院提供,转基因材料利用农杆菌介导法获得[21],OvBAN基因双标记[绿色荧光蛋白(green fluorescent protein, GFP)标记基因和抗除草剂bar基因]表达载体由课题组陈春艳[22]从甘肃红豆草中克隆并构建。本试验于2018年6-10月在甘肃农业大学草业学院分子生物学实验室及温室中进行。
1.2 分子生物学鉴定
以含OvBAN的质粒为阳性对照,野生型紫花苜蓿为阴性对照,ddH2O为空白对照,提取的卡那霉素抗性植株基因组DNA为模板,以OvBAN的特异性引物(OvBAN-F1: 5′-CGCCCGGGATGGCCACCAATACGAAGCAATC-3′ 和OvBAN-R1: 5′-GCGAGCTCTTAGTTCTTCAGGGCCCCCTTAGTC-3′)进行PCR检测,PCR产物长度为1020 bp。
为了鉴定OvBAN基因是否整合并遗传到苜蓿以及在苜蓿中的拷贝数,对PCR阳性植株进行Southern blot检测。用EcoRⅠ过夜酶切基因组DNA,以地高辛随机标记的OvBAN基因全长作为探针,参照罗氏地高辛说明书(DIG DNA Labeling and Detection Kit, Roche),进行探针制备、转膜及固定、分子杂交和免疫检测。
1.3 OvBAN在转基因植株中的表达分析
1.3.1实时荧光定量(quantitative RT-PCR, qRT-PCR)分析 用RNAprep Pure植物总RNA提取试剂盒(TIANGEN)提取各转基因株系和野生型植株叶片总RNA,采用PrimeScriptTMII 1st Strand cDNA Synthesis Kit (Solarbio)试剂盒反转录成cDNA。以反转录的cDNA为模板,用LightCycler 96实时荧光定量PCR仪(Roche, 德国)进行实时荧光定量分析,试验设置3个重复。反应体系为20 μL,按照SYBR Select Master Mix (TaKaRa)反应说明,以紫花苜蓿甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因(GAPDH-F:5′-GTGGTGCCAAGAAGGTTGTTAT-3′和GAPDH-R:5′-CTGGGAATGATGTTGAAGGAAG-3′)为内参,用特异性引物(qRT-OvBAN-F2:5′-CGGTCCTTCTCTCACTCCAG-3′和qRT-OvBAN-R2:5′-ATGGATATCGAACCGGACAA-3′)对OvBAN基因进行特异扩增。采用两步法扩增,反应条件为94 ℃酶激活5 min, 然后95 ℃变性15 s,60 ℃退火1 min,40个循环。用2-ΔΔCt法[23]计算转基因紫花苜蓿相对于野生型紫花苜蓿OvBAN基因的相对表达量。
1.3.2花青素还原酶活性测定 粗酶液的提取:称取紫花苜蓿叶片0.5 g放入研钵中,加入液氮研磨组织破碎后加入2 mL预冷的磷酸缓冲液(pH 7.4)和2%聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP)充分研磨,然后转入离心管中,用2 mL缓冲液充分清洗研钵,转入离心管中,4 ℃下12000 r·min-1离心15 min,所得上清液即为粗酶提取液。取60 μL上清液,依次加入40 μL 20 mmol·L-1的抗坏血酸、50 μL 1.875 mmol·L-1的氯化氰定、1.315 mL 0.1 mmol·L-1的磷酸缓冲液(pH 7.4),最后加入75 μL 20 mmol·L-1NADPH启动反应,在340 nm处检测吸光度值的变化,对照为不含酶液的反应体系[24]。以每μg蛋白在1 min内酶反应体系与对照的吸光度下降的差值为一个花青素还原酶活单位(ΔOD·min-1·μg-1protein)。
1.3.3缩合单宁含量测定 采用正丁醇-盐酸法测定[25]。称取紫花苜蓿叶片0.5 g放入研钵中,加入液氮研磨组织破碎后加入3 mL含0.5%冰乙酸的70%丙酮,5000 r·min-1离心15 min,吸取上清液,沉淀用含0.5%冰乙酸的70%丙酮冲洗3次,合并上清液并定容至10 mL;取上清液2 mL,加入等体积的蒸馏水和三氯甲烷,震荡摇匀后5000 r·min-1离心10 min,吸取上清液,去除叶绿素,上清液既为缩合单宁提取液;取缩合单宁提取液1 mL,加入6 mL 95%的正丁醇-盐酸(V∶V, 95∶5),95 ℃下热解1 h,冷却后在555和600 nm处检测吸光度值;以矢车菊素为标准品绘制标准曲线。
1.4 转基因植株抗虫性分析
从甘肃农业大学牧草实训基地苜蓿田中采集到蚜虫,经鉴定为苜蓿蚜(Aphiscraccivora),在温度为(26±1)℃,时长为白天18 h/夜晚6 h,相对湿度为50%~60%的人工培养箱内饲养,选取1~2龄若虫作为待接蚜虫。选取OvBAN基因相对表达量较高的3株转基因苜蓿(L3、L5、L6)以及野生型苜蓿3株(WT3、WT5、WT6),将其相互对应分为3组,每组分别放置在独立的人工培养箱中。将待接蚜虫饥饿处理2 h后,接种到苜蓿植株顶部的嫩芽中,每株接种10只1~2龄若虫,接种后每2 d调查各植株上的蚜虫数量,连续调查7次。采用蚜量比值法[26]对各植株进行抗蚜性鉴定,根据蚜量比值的不同,可将抗蚜性分为5级,高抗(high resistance, HR):0~0.25;抗(resistance, R):0.26~0.50;中抗(medium resistance, MR):0.51~0.75;感(susceptible, S):0.76~1.25;高感(high susceptible, HS):1.25以上;蚜虫抑制率鉴定参照Deng等[27]的方法;具体公式如下:
蚜量比值=该材料第14天的蚜量/全部材料第14天的平均蚜量
蚜虫抑制率=[(野生型植株蚜虫数-转基因植株蚜虫数)/野生型植株蚜虫数]×100%
1.5 转基因植株对除草剂的耐受性分析
将市售10%的草铵膦除草剂用蒸馏水稀释至0.5%,用喷壶对转基因苜蓿和野生型苜蓿进行喷施,以所有叶片均喷施到草铵膦溶液并且液体自然滴落为止,10 d后观察各株生长状况。
1.6 数据分析
采用SPSS 19.0软件进行统计分析,采用ANOVA进行单因素方差分析,Duncan’s新复极差法进行多重比较;采用Microsoft Excel 2010进行绘图与数据处理。
2 结果与分析
2.1 转基因苜蓿的分子生物学鉴定
2.1.1转基因苜蓿的PCR检测 通过遗传转化初步筛选获得苜蓿转化植株9株,为了验证目的基因是否整合到“甘农3号”紫花苜蓿的基因组中,利用OvBAN基因的特异性引物进行PCR检测。结果显示阳性对照和4株转化植株扩增出约1020 bp的片段(图1)。初步表明,OvBAN基因已经整合到L3、L4、L5和L6植株的基因组中,PCR阳性率为44.44%。

图1 转基因苜蓿OvBAN基因的PCR检测 Fig.1 PCR detection of alfalfa transformant M: Marker 2000;+: 质粒DNA作为阳性对照;-: ddH2O为空白对照;WT: 野生型苜蓿DNA;L1~L9: 待检测植株DNA。下同。M: 2.0-kb plus DNA ladder;+: Plasmid DNA as the positive control;-: ddH2O as the blank control;W: Wild-type plant;L1-L9: DNA from putative transgenic alfalfa lines. The same below.
2.1.2转基因苜蓿的Southern blot检测 为了进一步验证PCR扩增结果的可靠性,利用OvBAN基因序列设计探针对4株PCR阳性植株进行Southern blot检测。检测结果表明,4株PCR阳性植株均出现杂交信号,其中2个品系为单拷贝、1个品系为双拷贝、1个品系为三拷贝,验证了PCR结果的可靠性,将这4株阳性植株认定为转基因植株(图2)。
2.1.3实时荧光定量(qRT-PCR)分析 qRT-PCR分析结果表明,OvBAN基因在转基因植株体内能够正常转录和表达,且OvBAN基因的相对表达量均显著高于野生型植株,但不同转基因植株间表达量存在差异(图3)。
2.1.4花青素还原酶活性及缩合单宁含量分析 对转基因植株的花青素还原酶活性进行测定发现,转基因植株花青素还原酶活性与野生型植株相比均显著提高(P<0.05),其中L6转基因植株花青素还原酶活性最高,较野生型植株提高了3.13倍(图4);而对各植株缩合单宁含量比较发现,L3、L5和L6转基因植株缩合单宁含量均显著高于野生型植株(P<0.05),而L4转基因植株与野生型植株相比差异不显著(P>0.05)(图4)。

图2 转基因苜蓿的Southern blot检测Fig.2 Southern blot analysis of transgenic plants M: Marker;+: 质粒DNA作为阳性对照;L3~L6:扩增为阳性的植株被消化的DNA。+: Plasmid DNA was used as the positive control;L3-L6: Digested DNA from transgenic lines.

图3 转基因苜蓿叶片中OvBAN基因的qRT-PCR检测Fig.3 qRT-PCR assays on OvBAN transcript in transgenic alfalfa leaves **表示转基因株系表达量与野生型苜蓿有极显著差异(P<0.01);*表示转基因株系表达量与野生型苜蓿有显著差异(P<0.05);t检验。** indicates extremely significant difference (P<0.01);* indicates significant difference (P<0.05);t test.

图4 转基因苜蓿叶片中花青素还原酶活性及缩合单宁含量的分析Fig.4 Analysis of anthocyanin reductase activity and condensed tannins content of transgenic alfalfa leaves不同小写字母表示在0.05水平上差异显著。Different lowercase letters indicate significant difference at 0.05 level.
2.2 转基因苜蓿抗蚜虫分析
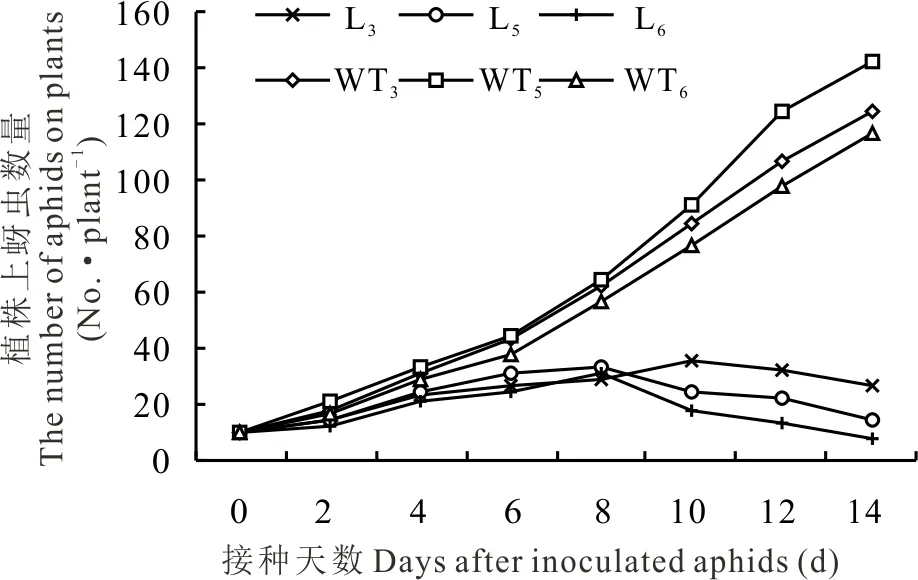
图5 转基因与野生型苜蓿植株上蚜虫数量的变化Fig.5 Changes in the number of aphids on transgenic and wild-type alfalfa
2.2.1转基因苜蓿与野生型苜蓿上蚜虫数量的变化 选取qRT-PCR检测和花青素还原酶活性及缩合单宁含量测定中表达量较高的L3、L5和L6转基因植株进行人工接虫后发现,野生型植株上蚜虫数量均随接种天数的增加而增加,而转基因植株上蚜虫数量均随接种天数增加而增长缓慢,在第8天后,L5和L6转基因植株上蚜虫数量呈下降趋势,而L3转基因植株上蚜虫数量在第10天时开始下降(图5)。人工接虫第21天后,野生型植株上的蚜虫数量远远超过转基因植株上的蚜虫数量(图6)。
2.2.2转基因苜蓿与野生型苜蓿抗蚜性鉴定 用蚜量比值法对转基因植株进行抗蚜性鉴定,结果表明,L5和L6转基因植株蚜量比值分别为0.21和0.11,抗蚜等级为高抗;L3转基因植株蚜量比值为0.37,抗蚜等级为抗;而野生型植株蚜量比值均大于1.25,表现为高感蚜虫(表1)。

图6 转基因与野生型苜蓿在人工接虫21 d后蚜虫的分布情况Fig.6 Distribution of aphids on transgenic and wild-type alfalfa after 21 days of artificial inoculation of aphids
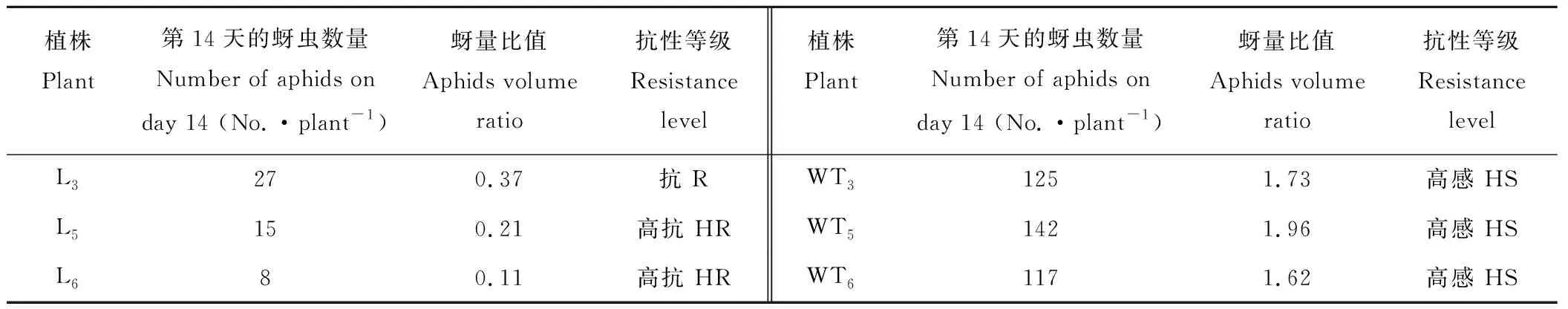
植株Plant第14天的蚜虫数量Number of aphids on day 14 (No.·plant-1)蚜量比值Aphids volume ratio抗性等级Resistance level植株Plant第14天的蚜虫数量Number of aphids on day 14 (No.·plant-1)蚜量比值Aphids volume ratio抗性等级Resistance levelL3270.37抗 RWT31251.73高感 HSL5150.21高抗 HRWT51421.96高感 HSL680.11高抗 HRWT61171.62高感 HS
注:L3、L5、L6为转基因株系;WT3、WT5、WT6为野生型株系。下同。
Note: L3, L5and L6are transgenic lines; WT3, WT5and WT6are wild type strains. The same below.
2.2.3转基因苜蓿对蚜虫的抑制率 L3、L5和L6转基因植株在第14天时的蚜虫抑制率分别为78.40%、89.44%和93.16%,与蚜量比值表明的抗蚜结果基本一致(表2)。
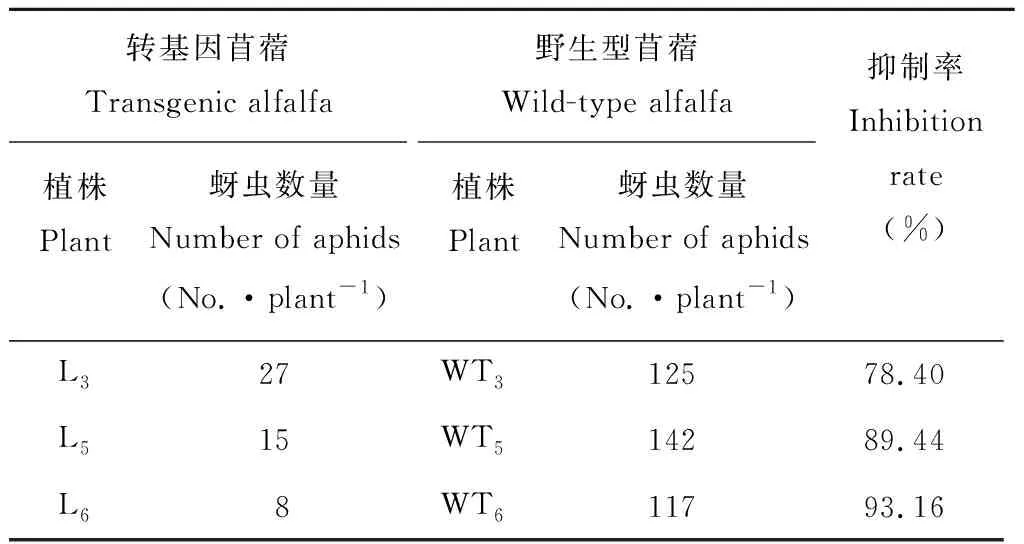
表2 转基因苜蓿对蚜虫的抑制率Table 2 Inhibition rate of transgenic alfalfa to aphids

图7 转基因苜蓿对除草剂的耐受性分析Fig.7 Herbicide tolerance analysis of transgenic alfalfa
2.3 转基因苜蓿对除草剂的耐受性分析
用0.5%的市售草铵膦溶液喷施各株系,10 d后野生型植株叶片萎蔫,茎秆枯黄,最终全部死亡;而转基因植株除个别叶片枯黄脱落外,绝大多数叶片和茎秆长势良好,没有出现死亡现象(图7)。表明抗除草剂bar基因已整合到苜蓿基因组中,并稳定表达。
3 讨论与结论
虫害是影响农业生产的重要因素,利用转基因技术将外源杀虫基因导入农作物中,使作物获得抗虫性已成为基因工程研究的重要内容。随着转基因作物种植面积的不断扩大,生态安全问题已受到越来越多的关注,而转基因作物对非靶标昆虫的影响就是关注的焦点之一[28]。有研究报道,植物凝集素基因(如GNA,ACA基因)在水稻、小麦和马铃薯等作物中表达可以强烈抑制蚜虫的生长发育[28-30],但随后的研究发现,某些凝集素会影响非靶标昆虫及哺乳动物肠胃中的抑制酶降解,产生毒害作用[31]。也有研究报道,转苏云金芽孢杆菌(Bacillusthuringiensis)基因的作物其花粉飘落到家蚕或蝶类昆虫的寄主植物上,也可能会对它们的生长发育造成一定影响[31]。植物中存在着相当丰富的天然抗虫活性物质,其中如单宁类化合物、萜烯类化合物以及黄酮类化合物等次生代谢物质对植物抗虫性有重要的作用[32-33]。次生代谢物质是植物代谢的终端产物,通过降解或合成产生,不会再次对代谢过程起作用,因此植物次生代谢物质在植物抗虫性的研究中具有重要的生态学意义。武予清等[32]研究发现棉花(Gossypiumspp.)叶片单宁-黄酮类化合物对棉铃虫生长发育有显著抑制作用,其中缩合单宁、芸香苷的抑制作用较强。陈巨莲等[33]研究表明次生代谢物对麦蚜的行为存在影响,认为单宁、丁布和香豆素等次生代谢物与小麦的抗蚜性密切相关。
植物单宁一般被认为是有效的化学防御物质,能与昆虫中肠中的蛋白质分子结合形成稳定的交叉链,抑制酶活性,影响中肠对蛋白质、氨基酸等营养成分的吸收与利用,单宁还可以与淀粉形成络合物而影响昆虫对淀粉的消化吸收[34]。林凤敏等[35]研究了不同棉花品种(系)的主要次生代谢产物与其对绿盲蝽(Lyguslucorum)的抗性关系,发现苗期顶叶中的缩合单宁含量与棉花对绿盲蝽的抗性存在显著正相关,缩合单宁含量较高的棉花品种(系)可以减轻或抑制绿盲蝽的危害程度。沈法富等[36]将单宁含量较高的罗布麻(Apocynumvenetum)DNA导入棉花子房,选育出兼抗棉铃虫和棉蚜的棉花种质,检测表明抗虫种质单宁含量较野生型棉花增加了136.70%,显著抑制了初孵棉铃虫的生长和发育。但也有学者认为单宁与抗虫性无关,如莫建初等[37]研究发现单宁类物质对油桐尺蠖(Buzurasuppressaria)的生长发育无显著影响;武德功等[38]通过对4种不同抗蚜性紫花苜蓿品种受豌豆蚜(Acyrthosiphonpisum)胁迫后单宁含量的动态变化研究发现,抗虫品种的单宁含量在整个危害胁迫过程中与感虫品种差异不显著,表明单宁含量与苜蓿的抗虫性不相关。而本试验中对缩合单宁含量较高的转基因植株和野生型植株进行人工接虫后发现,野生型植株上蚜虫数量均随接种天数的增加而不断增加,而转基因植株上蚜虫数量均随接种天数增加而增长缓慢并在后期呈下降趋势,说明苜蓿缩合单宁的增加对蚜虫产生了拒食或忌避作用,这与武德功等[38]的研究结果不一致,原因可能是因为紫花苜蓿叶片中单宁类物质含量较少,不同品种苜蓿的单宁含量差异不明显并且没有达到抵御虫害的含量范围,而过表达的OvBAN基因显著提高了苜蓿的单宁含量,使单宁成为与抗虫性相关的主要因素。
利用基因工程手段将抗虫次级代谢产物合成的相关基因导入植物中,可能会获得环境友好的抗虫植物,为抗虫转基因研究注入新的活力。然而由于植物次生代谢产物受多基因控制,目前对于其在植物抗虫育种中的研究和应用较少。但是在深入研究这些次生代谢产物合成的相关催化酶和主控基因的基础上进行定位和克隆抗性基因,并利于转基因技术将其运用于抗虫育种中的潜力巨大,这也对于未来农业可持续发展具有特别重要的意义。目前,植物类黄酮和萜类代谢产物相关基因和抗虫性关系的研究也已有报道[39-40]。本研究以培育抗臌胀病苜蓿新品种为初衷,利用农杆菌介导法将双价基因OvBAN/bar导入紫花苜蓿体内,通过对抗性苗进行分子生物学检测,得到3株表达量较高的转基因植株。在试验过程中发现转OvBAN/bar基因苜蓿的抗虫现象,因此对植株进行人工接虫处理。通过对蚜虫数量变化进行研究表明,转OvBAN/bar基因可以提高紫花苜蓿的抗虫性,验证了其具有抗虫效果,这也为培育抗虫转基因苜蓿新品种提供了新基因、新方法和新思路。
——“单宁”

