甘露糖浸种对干旱胁迫下白三叶种子萌发及抗旱性的影响
曾伟航,程碧真,彭燕,李州
(四川农业大学动物科技学院草学系,四川 成都 611130)
在全球变暖背景下,干旱等极端气候事件发生明显增加[1],世界各地干旱受灾面积和频次也呈逐步增加的趋势[2]。在影响植物生长的诸多环境因子中,水分条件尤为重要,水是种子萌发必不可少的重要条件之一。干旱胁迫严重影响植物的形态结构和生理生化,也显著抑制种子的萌发[3]。干旱胁迫下,植物的生长和功能往往会受到抑制,使植物体发生氧化性损伤、代谢紊乱和DNA断裂等,直至植物死亡[4]。付咪咪等[5]研究发现高质量分数(10%~25%)的PEG会对黄秋葵(Abelmoschusesculentus)种子萌发产生抑制作用,且抑制作用会随干旱胁迫程度的加深而显著增强,当干旱胁迫达到一定程度时(20% PEG),黄秋葵种子的萌发会完全受到抑制,即不能萌发。Liu 等[6]研究发现干旱对小麦(Triticumaestivum)种子萌发具有显著的抑制作用,15% PEG胁迫下6个品种的小麦种子发芽率、发芽指数、胚芽鞘和胚根长度及重量均显著低于对照。胡晓艳等[7]的研究也发现,马蹄金(Dichondrarepens)和结缕草(Zoysiajaponica)的发芽率和发芽势随干旱胁迫强度的增加呈显著下降趋势。可见,不同植物种子在萌发过程中对干旱胁迫的耐受性有所不同,研究不同种子萌发时对干旱胁迫的耐受性对发展节水农业及指导生产具有重要意义。
白三叶(Trifoliumrepens)又称白车轴草,属于豆科(Leguminosae)三叶草属(Trifolium),是我国长江以南广泛栽培应用的优良豆科牧草之一,具有产量高、牧草品质优良、生物固氮能力强、为各种畜禽所喜食等优点[8]。但白三叶喜冷凉湿润气候,适宜生长生态幅度较窄,耐旱性弱,因此干旱成为限制白三叶推广栽培应用的重要逆境因子。在众多方法中,种子浸种预处理是提高作物种子萌发及抗逆性最简单有效的方法。张艳等[9]研究表明,15% PEG胁迫显著降低了白三叶种子的发芽率和发芽势,但400 mg·L-1甜菜碱浸种后能明显提高PEG干旱胁迫下白三叶种子的萌发,缓解干旱胁迫造成的伤害。本研究前期的试验也表明,30 μmol·L-1的亚精胺(spermidine,Spd)浸种预处理能显著提高PEG干旱胁迫下白三叶种子的萌发,进一步对相关机制研究发现,在PEG胁迫下,Spd能促进种子淀粉代谢及增强种子萌发过程中多种抗氧化酶活性,从而提高种子的渗透调节能力和抗氧化防御[10]。
甘露糖(mannose,MAS)是一种广泛存在于植物体内的单糖,为多种多糖的组成成分,常以游离状态的形式存在于植物体中。已有研究表明,甘露糖与植物抗性密切相关。例如,Hameed等[11]研究表明在黄化小麦幼苗叶片中,1% MAS处理能提高小麦叶片的过氧化氢酶(catalase,CAT)活性、过氧化物酶(peroxidase,POD)活性和抗坏血酸过氧化物酶(aseorbate peroxidase,APX)活性,延缓叶片衰老。He等[12]研究显示,位于细胞质中的DoGMP1蛋白催化GDP-甘露糖(guanosine diphosphate mannose,GDP-mannose)的合成,且DoGMP1转基因拟南芥(Arabidopsisthaliana)植株中MAS含量比野生型显著增加。在盐胁迫下,DoGMP1转基因拟南芥种子表现出较高的萌发和生长,DoGMP1可能通过上调水溶性糖和抗坏血酸(ascorbic acid,ASA)降低细胞内活性氧(reactive oxygen species,ROS)的积累,从而提高盐胁迫耐受性。Ai等[13]研究也发现在干旱和盐胁迫下,编码GDP-甘露糖焦磷酸化酶(GDP-mannose pyrophosphorylase,GMPase)的PpGMP转基因烟草(Nicotianatabacum)具有较高的耐盐性和抗旱性、较高的种子萌发率、较好的生长性能、较高的ASA含量、更稳定的氧化还原状态、更高的超氧化物歧化酶(superoxide dismutase, SOD)活性和更低的丙二醛(malondialdehyde,MDA)及H2O2水平。但截至目前,有关MAS对干旱胁迫下白三叶种子萌发的影响报道甚少,MAS浸种是否能提高干旱胁迫下白三叶种子的萌发还有待研究。因此,本试验以生产中广泛应用的白三叶品种‘拉丁诺’(Ladino)为供试材料,研究不同浓度的MAS浸种对干旱胁迫下白三叶种子萌发的影响,筛选能提高干旱胁迫下白三叶种子萌发的最适MAS浓度,并进一步从生理及分子水平揭示MAS诱导提高种子在干旱胁迫下萌发可能涉及的生理生化过程,旨在为提高白三叶种子萌发期抗逆性提供新方法,并为白三叶较好的栽培管理提供有效依据。
1 材料与方法
1.1 供试材料
本试验以‘拉丁诺’白三叶(T.repenscv.‘Ladino’)为供试材料,于2017年在四川农业大学草业工程试验室进行,种子来源于四川百绿时代园林绿化有限公司。
1.2 试验设计
随机选取成熟健康的白三叶种子,经0.5%的次氯酸钠溶液浸泡消毒10 min后用蒸馏水充分洗净。消毒洗净后的种子先用蒸馏水浸泡1 h。然后分成6组,分别浸泡在浓度为0(蒸馏水,对照)、0.5、1.0、2.0、5.0和10.0 mmol·L-1的甘露糖溶液中2 h。浸种过程均在避光条件下进行。
取上述6组浸泡后的种子,每组分别置于0(对照)和18% PEG溶液润湿的有双层滤纸的洁净培养皿中进行发芽试验(每个培养皿中所加蒸馏水和18% PEG溶液等量)。试验共计12个处理,每个处理6个重复,每个培养皿放置50粒种子。为防止培养皿溶液干燥,每天将种子转移到新的铺有0或18% PEG润湿的双层滤纸的培养皿中(同上操作)。发芽试验均在光照培养箱中进行,白天温度23 ℃,夜晚温度19 ℃,时长各为12 h,相对湿度70%。
1.3 测定指标与方法
1.3.1种子发芽测定 连续培养观察7 d,每天定时统计种子萌发数,以胚根长度与白三叶种子等长视为发芽。
发芽率(%)=n/N×100
式中:n为发芽种子总数;N为供试种子总数。
发芽势(%)=发芽3 d种子发芽数/种子总数×100
发芽指数GI=∑Gt/Dt
式中:Gt为发芽数;Dt为相应发芽天数。
平均发芽时间=∑(D×n)/∑n
式中:D为从种子置床起计算的天数;n为相应各天的发芽数。
种子发芽第7天时,将每一个处理随机选取3个重复,每个重复随机抽取10株完整健全的幼苗用直尺测量胚芽长和胚根长。
1.3.2生理生化指标测定 随机选取成熟健康的白三叶种子,经0.5%的次氯酸钠溶液浸泡消毒10 min后用蒸馏水充分洗净。消毒洗净后的种子先用蒸馏水浸泡1 h。然后分成2组,分别浸泡在浓度为0(蒸馏水,对照)或2.0 mmol·L-1的甘露糖溶液中2 h。浸种过程均在避光条件下进行。将上述两组处理过的种子分别置于0(对照)和18% PEG溶液润湿的有双层滤纸的洁净大培养皿中进行发芽试验(每个培养皿中所加蒸馏水和18% PEG溶液等量)。本试验共4个处理,每个处理4个重复,分别为:1)处理1:CK(蒸馏水浸泡,蒸馏水发芽);2)处理2:CK+MAS(2.0 mmol·L-1MAS浸泡,蒸馏水发芽);3)处理3:PEG(蒸馏水浸泡,18% PEG发芽);4)处理4:PEG+MAS(2.0 mmol·L-1MAS浸泡,18% PEG发芽)。
于发芽7 d时将已发芽的种子用蒸馏水迅速冲洗干净,并用纸吸干表面水分,测定根系活力、电解质渗透率(electrolytic leakage,EL)、MDA含量、SOD活性、CAT活性、POD活性、游离脯氨酸(free proline,Pro)、可溶性糖(soluble sugar,WSC)、淀粉(starch)、超氧阴离子(O2·-)产生速率、H2O2含量、淀粉酶活性等生理指标。每个生理指标均从每个重复中称取0.1 g进行测定。采用TTC还原法测定根系活力[14]; 采用常规的电导率仪法测定EL[15];采用硫代巴比妥酸法测定MDA含量[16]; 采用核黄素-NBT法测定SOD活性[17]; 采用紫外吸收法测定CAT活性[18]; 采用愈创木酚显色法POD[18];采用茚三酮比色法测定Pro含量[14];采用蒽酮乙酸乙酯比色法测定WSC和淀粉含量[14]; 参照郝建军等[19]的方法测定O2·-产生速率;参照Uchida等[20]的方法测定H2O2含量;采用3,5-二硝基水杨酸法测定淀粉酶活性[21]。
1.3.3基因表达分析 试验设计同1.3.2,从每个重复中称取0.1 g籽苗冻存于液氮中,用于提取植物RNA。
采用实时荧光定量(qRT-PCR)检测抗氧化酶基因表达,使用天根总RNA提取试剂盒提取白三叶籽苗总RNA,TAKARA反转录试剂盒反转录RNA合成cDNA第一链,利用TOYOBO荧光定量PCRmix进行荧光定量PCR,PCR扩增程序如下:在95 ℃ 变性5 min,在58 ℃(β-Actin,Cu/ZnSOD,FeSOD,CAT)或64 ℃(MnSOD,POD)退火45 s,40个循环,通过加热从60到95 ℃的扩增子以获得熔解曲线。基因转录水平的计算公式2-ΔΔCt采用Xia等[22]的计算方法。引物由华大基因公司合成,引物序列见表1。

表1 引物序列及其相应基因库序列号Table 1 Primer sequences and their corresponding GeneBank accession numbers of the analyzed genes
1.4 统计分析
用Microsoft Excel 2013软件进行处理数据与作图,结果用平均值±标准差表示,用SPSS 20.0软件进行统计分析,用Duncan法进行多重比较。
2 结果与分析
2.1 甘露糖浸种对干旱胁迫下白三叶种子发芽特性及根系活力的影响
由表2可知,与蒸馏水浸种处理(CK)相比,干旱胁迫下种子的发芽率、发芽势、发芽指数明显降低,平均发芽时间增长。而经过0.5~5.0 mmol·L-1的甘露糖浸种能显著(P<0.05)提高种子的发芽率。其中2.0 mmol·L-1浸种处理的上述发芽指标均显著好于其他处理。而当甘露糖浓度达到10.0 mmol·L-1时,其各项发芽指标均小于未经甘露糖浸种的处理。由此可知,白三叶种子发芽过程中对干旱胁迫非常敏感,甘露糖浸种能在一定程度上促进种子发芽,表现为低浓度促进而高浓度抑制的特点。经筛选最适宜的甘露糖浸种浓度为2.0 mmol·L-1。
在根系长度和根系活力的变化上,与CK相比,CK+MAS处理的幼苗长明显增加而根长没有显著差异(图1A)。但在PEG胁迫下根长茎长均显著降低,其中PEG+MAS的根长显著高于PEG处理组,而茎长没有明显差异(图1B,C)。甘露糖预处理也显著提高了白三叶种子在PEG胁迫下发芽时的根系活力(图1D)。

表2 甘露糖浸种对干旱胁迫下白三叶种子发芽的影响Table 2 Effect of the pretreatment of mannose on white clover seed germination under drought stress
注: 同列不同字母表示差异显著(P<0.05)。
Note: Different small letters in the same column indicate significant difference atP<0.05 level.

图1 甘露糖浸种对干旱胁迫下白三叶种子发芽的茎长、根长和根系活力的影响Fig.1 Effect of the pretreatment of mannose on stem length, root length and root viability on white clover seed germination under drought stress 不同字母表示在0.05水平上差异显著(P<0.05)。下同。Different letters indicated significant difference at P<0.05 level.The same below.
2.2 甘露糖浸种对干旱胁迫下白三叶种子发芽淀粉代谢及渗透调节的影响
从图2A中可以看出,PEG诱导的干旱胁迫显著抑制了种子发芽过程中淀粉的分解,PEG处理组的种子淀粉含量显著高于CK和PEG+MAS。正常条件下MAS浸种能显著提高淀粉的分解。在PEG胁迫下,MAS浸种也能显著缓解干旱胁迫导致的淀粉分解抑制,PEG+MAS的α-淀粉酶活性、β-淀粉酶活性和总淀粉酶活性均显著高于其他处理组(图2B~D)。
与CK相比,PEG胁迫下的白三叶种子发芽时的可溶性糖含量显著增加,此时PEG和PEG+MAS处理组可溶性糖含量分别是CK和CK+MAS的2.5和2.2 倍,但PEG+MAS与PEG组的可溶性糖含量没有显著差异(图3A)。同时,游离脯氨酸在PEG胁迫下也急剧升高,PEG+MAS上升幅度最大,显著高于PEG处理组(图3B)。而种子的渗透势在PEG胁迫下急剧降低,PEG+MAS显著低于PEG处理组(图3C)。
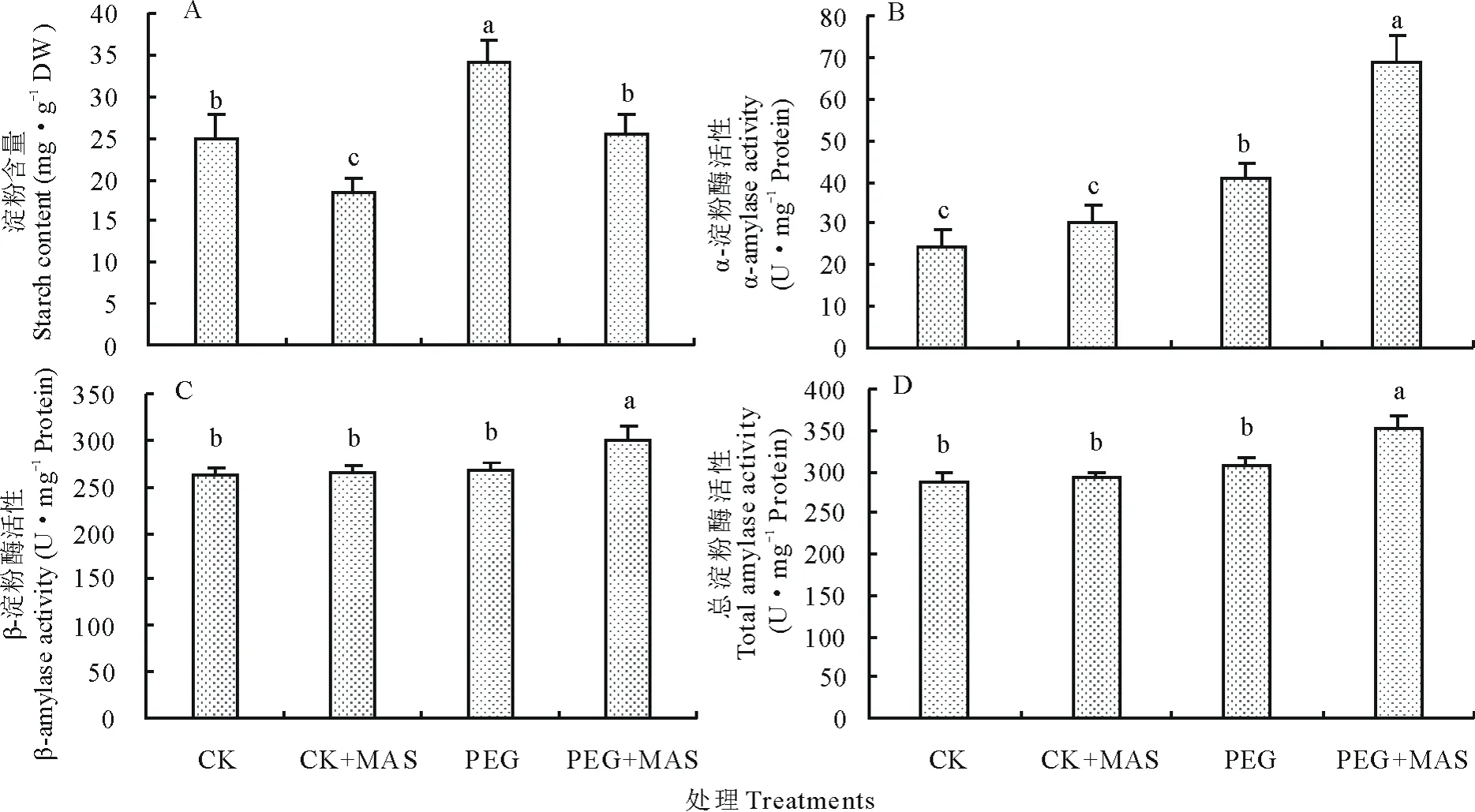
图2 甘露糖浸种对干旱胁迫下白三叶种子发芽淀粉及淀粉酶活性的影响Fig.2 Effect of the pretreatment of mannose on starch and amylase activity of white clover under drought stress

图3 甘露糖浸种对干旱胁迫下白三叶种子发芽可溶性糖、游离脯氨酸和渗透势的影响Fig.3 Effect of the pretreatment of mannose on soluble sugar content, free proline and osmotic potential of white clover under drought stress
2.3 甘露糖浸种对干旱胁迫下白三叶种子发芽氧化伤害及抗氧化防御的影响
从图4可以看出,正常条件下甘露糖预处理对白三叶种子发芽时体内的活性氧、丙二醛和电解质渗透率没有显著影响,即低浓度的甘露糖浸种对白三叶种子发芽没有显著胁迫影响。与CK相比,PEG胁迫下种子的活性氧、丙二醛和电解质渗透率均显著提高,细胞氧化伤害程度加大。但PEG+MAS相对于PEG处理维持了显著降低的超氧阴离子、过氧化氢、丙二醛和电解质渗透率,降低的百分比分别为26.0%,25.9%,19.7%和16.1%。
从总抗氧化水平上看,PEG胁迫有效提高了种子发芽时总抗氧化能力,而PEG+MAS的总抗氧化能力比PEG处理高出15.0%,达到显著水平(图5A)。白三叶种子在PEG胁迫下的SOD和POD活性显著降低,但PEG+MAS的SOD和POD活性显著高于PEG(图5B,C)。白三叶种子在PEG胁迫下的CAT活性显著高于对照,但PEG+MAS与PEG处理组之间在CAT活性上没有显著差异(图5D)。白三叶种子发芽过程中的FeSOD和CuZnSOD基因在PEG胁迫下相对表达量均升高,但PEG+MAS与PEG处理间差异不明显。在MnSOD和POD的基因表达水平上,PEG+MAS比PEG处理分别高出了170%和307%,差异显著。在PEG胁迫下,白三叶种子的CAT基因表达均显著降低,且PEG+MAS与PEG处理间没有显著差异(图6)。
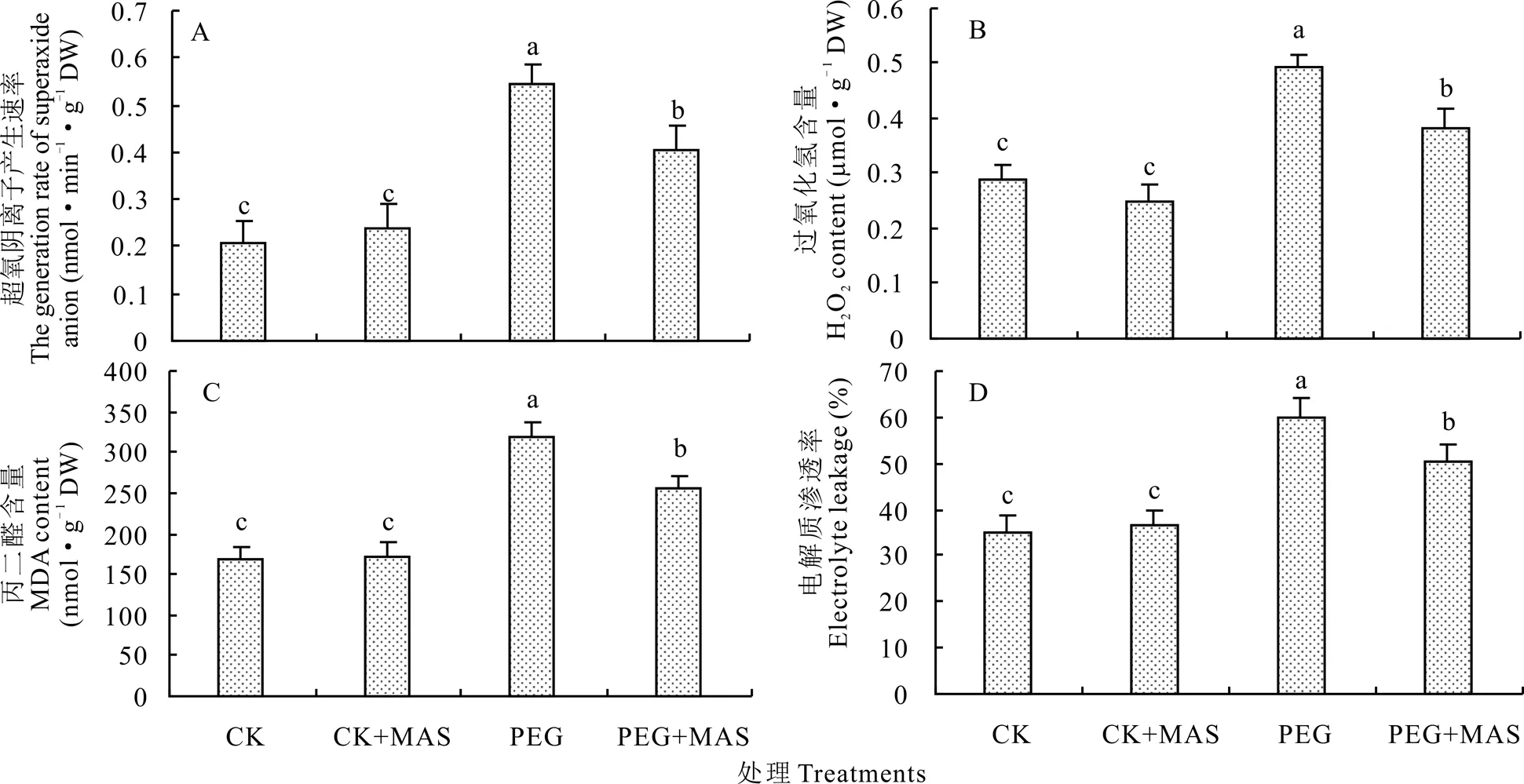
图4 甘露糖浸种对干旱胁迫下白三叶种子发芽活性氧、丙二醛和电解质渗透率的影响Fig.4 Effect of the pretreatment of mannose on reactive oxygen species, MDA content and electrolyte leakage of white clover under drought stress

图5 甘露糖浸种对干旱胁迫下白三叶种子发芽总抗氧化能力和抗氧化酶活性的影响Fig.5 Effect of the pretreatment of mannose on total antioxidant capacity and antioxidative enzyme activities of white clover under drought stress
3 讨论
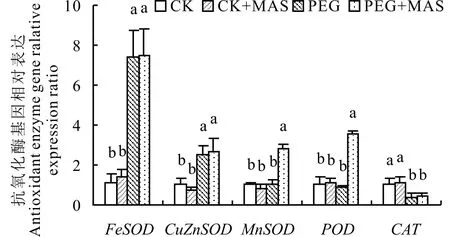
图6 甘露糖浸种对干旱胁迫下白三叶种子发芽抗氧化酶基因表达的影响Fig.6 Effect of the pretreatment of mannose on gene expression of antioxidant enzyme of white clover under drought stress
干旱是影响植物正常生长并使作物产量降低的主要非生物胁迫之一,前人的研究已证实植物体内广泛存在的单糖甘露糖(MAS)与植物抗逆性关系密切。Hameed等[23]研究发现干旱条件下,甘露糖预处理提高了小麦种子发芽的渗透调节能力和抗氧化酶活性,提高种子萌发抗性。本试验结果发现,较低浓度(0.5、1.0、2.0和5.0 mmol·L-1)的MAS浸种预处理均能显著提高白三叶种子在18% PEG胁迫下的发芽率,但高浓度(10.0 mmol·L-1)的MAS却对种子产生毒害作用,进一步降低了种子在PEG胁迫下的发芽,说明MAS提高白三叶种子发芽期抗旱性的效应类似于其他植物生长调节剂,具有低浓度促进而高浓度抑制的特点。在种子萌发过程中,淀粉酶是催化淀粉水解的一类关键酶,几乎存在于所有植物中,参与种子淀粉分解和转化的淀粉酶主要有α-淀粉酶和β-淀粉酶[24]。种子萌发时,淀粉酶将淀粉分解成小分子糖类供幼苗生长[25]。李文娆等[26]通过对水分胁迫下紫花苜蓿(Medicagosativa)和高粱(Sorghumbicolor)种子萌发特性研究表明,水分胁迫通过限制种子吸水而抑制了种子内萌发活性物质的生成、转化和运输(即淀粉水解生成可溶性糖,代谢过程受到抑制)等,继而严重影响了种子的萌发活力,导致种子萌发速率和数量显著下降。早期的研究发现,亚精胺浸种预处理能显著缓解PEG胁迫导致的白三叶种子萌发抑制,这与亚精胺提高PEG胁迫下种子萌发过程中的淀粉代谢有关[27]。在本试验中,PEG诱导的干旱胁迫显著抑制了白三叶种子萌发过程中淀粉的分解,但与未经MAS预处理的种子相比较,MAS预处理提高了白三叶种子在PEG胁迫下的淀粉酶活性,从而有效缓解了PEG导致的淀粉代谢抑制。有趣的是在本试验中,PEG胁迫下经MAS预处理和未经MAS预处理的种子在发芽时可溶性糖含量没有显著差异,可能是由于种子发芽后期MAS诱导淀粉分解的可溶性糖用于维持种子在PEG胁迫下的生长,因为在干旱胁迫下MAS预处理后的种子生长更为良好(发芽后籽苗更大、根系更长)。
干旱胁迫下根系细胞受到伤害,代谢发生紊乱,将直接导致根系活力的下降[28]。郎冬梅等[29]研究发现,添加外源葡萄糖处理后山定子(Malusbaccata)幼苗根系活力显著提高。本试验中2.0 mmol·L-1MAS浸种提高了干旱胁迫下种子发芽时的根系活力,一定程度上增强了根的吸水能力。此外,在根系吸水过程中渗透调节能力发挥重要作用,因此植物较强的渗透调节能力常常与其较强的抗旱性呈正相关。可溶性糖和游离脯氨酸是植物体内重要的有机渗透调节物质,它们无毒且水合力强,可以保持细胞与环境渗透平衡,防止植物体内水分散失,并对酶、蛋白质及生物膜起保护作用[30-31]。刘艳等[32]研究发现甘草(Glycyrrhizauralensis)幼苗组织中渗透调节物质可溶性蛋白、游离脯氨酸、可溶性糖含量在干旱胁迫下均显著增加,提高了植株的吸水和保水能力,有效抵御干旱逆境。吴旭红等[33]研究结果表明,0.6和0.9 mmol·L-1的外源亚精胺处理显著提高了渗透胁迫下南瓜(Cucurbitamoschata)叶片的可溶性糖和脯氨酸含量,维持了较高的渗透缓冲和调节能力。李艳等[34]研究表明,壳寡糖处理油菜(Brassicanapus)幼苗,在干旱胁迫下其叶片游离脯氨酸含量显著增高。本试验结果显示,干旱胁迫下种子萌发时大量积累可溶性糖和游离脯氨酸,通过降低细胞渗透势缓解干旱胁迫伤害。而对比干旱胁迫下MAS浸种预处理和未预处理两个试验组发现,MAS浸种处理显著提高了白三叶种子在PEG胁迫下游离脯氨酸的积累,PEG+MAS的渗透势也显著低于PEG处理组。说明2.0 mmol·L-1的MAS浸种使得白三叶种子发芽时积累了大量的游离脯氨酸并降低细胞渗透势,从而提高白三叶种子的吸水保水能力,一定程度上维持了白三叶种子在干旱胁迫下的萌发能力。
当植物遭受干旱胁迫时,植物体内活性氧(ROS)大量积累,膜脂发生过氧化作用,膜的透性增加,从而导致植物细胞功能受损,严重时致使植株死亡[4]。抗氧化防御系统是植物体内维持ROS平衡的重要解毒系统,能降低植物细胞在干旱胁迫等非生物或生物胁迫下ROS的过量积累,以维持细胞良好的生理代谢功能。SOD是抵御活性氧的第一道防线,它能将超氧阴离子歧化生成H2O2和无毒的氧[35]。POD和CAT能进一步将H2O2催化生成O2和水,从而减轻ROS在细胞内的积累[36]。研究发现,抗氧化酶基因的表达是植物响应干旱胁迫的重要分子机制[37]。Wang等[38]研究表明水稻(Oryzasativa)过量表达MnSOD基因能有效减轻PEG胁迫引起的氧化伤害,转基因水稻抗旱性显著高于野生型。本试验中正常水分条件下MAS预处理的白三叶在发芽过程中活性氧成分、MDA含量和EL水平均未发生变化,说明2.0 mmol·L-1MAS没有对白三叶造成胁迫伤害。PEG胁迫下白三叶种子在发芽过程中活性氧显著增多,而MAS浸种预处理的白三叶种子在PEG胁迫下的SOD和POD的活性增强,活性氧和MDA显著降低。抗氧化酶的基因表达与酶活基本一致,MAS预处理的白三叶种子在PEG胁迫下MnSOD和POD基因表达量显著升高,但MAS浸种对CAT活性及其基因表达没有产生显著影响。因此,低浓度的MAS浸种通过提高白三叶种子SOD和POD的活性及其基因表达从而提高了白三叶种子在PEG胁迫下的抗氧化能力,进而有效缓解了活性氧对膜的伤害,提高了种子在发芽过程中的抗旱性。有趣的是干旱胁迫下CAT基因表达显著下调,但CAT酶活显著升高,推测酶活性的影响不仅仅受基因转录水平的直接调控,也受细胞水分状态例如渗透调节和渗透保护的影响。
综上所述,18% 的PEG干旱胁迫下白三叶种子发芽受到严重抑制,淀粉代谢减慢。而较低浓度的MAS浸种预处理能显著提高干旱胁迫下白三叶种子的萌发。进一步的研究发现,MAS浸种预处理使得种子在干旱胁迫下萌发时维持较好的淀粉代谢,积累更多的游离脯氨酸,渗透势显著降低,且显著提高根系活力,从而增强了种子发芽时的吸水保水能力。此外,干旱胁迫下白三叶种子发芽时活性氧升高,膜脂过氧化加剧,种子发芽受到严重影响。而MAS浸种预处理能显著提高干旱胁迫下种子发芽时总抗氧化能力、SOD和POD活性及其基因表达,增强抗氧化防御系统,从而有效缓解了活性氧积累对细胞膜的氧化损伤,提高抗逆性。

