围封条件下荒漠草原两种植物群落土壤理化性状与酶活性的研究
李国旗,赵盼盼,邵文山,靳长青
(1.宁夏大学西北土地退化与生态恢复国家重点实验室培育基地, 宁夏 银川 750021;2.宁夏大学西北退化生态系统恢复与重建教育部重点实验室,宁夏 银川 750021)
荒漠草原介于沙漠与草原之间,是旱生性最强的草原生态系统之一[1],处于干旱半干旱的农牧交错区,植被稀疏,多呈斑块状分布,风蚀严重,土壤贫瘠且稳定性差,生态环境脆弱[2]。围栏封育是当前退化生态系统恢复与重建过程中的重要方式之一,在全球范围内广泛采用[3]。围栏封育后的效果从宏观上看主要表现为植被恢复,而微观上则表现为土壤的理化性状和土壤酶的改变。土壤酶是一种由土壤微生物代谢或土壤动物、植物残体分解产生的生物催化剂,在土壤生态系统物质循环和能量流动中发挥重要作用[4-5]。土壤酶活性在一定程度上表征了土壤中各种生物化学过程的强度和方向[6-7],对土壤养分的变化具有重要影响[8-9],可以作为评价土壤质量[10-11]、土壤肥力[12]等生态环境效应的重要指标。目前国内外关于土壤酶活性的研究较多,但不同研究区域的结果并不一致。谈嫣蓉等[13]对青藏高原东缘高寒草甸土壤酶活性的研究表明,围栏封育显著降低土壤脲酶活性,显著提高磷酸酶活性。高凤等[14]对青藏高原高寒草地的研究结果表明,实施围栏封育后土壤酶活性均有所变化,但差异不显著。Hewins等[15]对加拿大西部草地土壤酶活性研究结果发现,围栏封育样地的土壤酶活性均大于放牧样地。对荒漠草原4种常见植物群落土壤酶活性的研究,证明苦豆子(Sophoraalopecuroides)与沙芦草(Agropyronmongolicum)群落的土壤理化性质和酶活性均存在差异,但对二者的相关性研究尚少有报道[16]。本研究拟通过对荒漠草原两种植物群落在围封条件下土壤理化性状与酶活性相关性的研究,从微观层面揭示围栏封育对荒漠草原生态修复的积极作用,为科学评估退牧还草的生态效应和生态恢复措施提供理论依据。
1 材料与方法
1.1 研究区概况
试验区位于宁夏东部盐池县(E 106°30′-107°48′,N 37°04′-38°10′),位于毛乌素沙地西南部半干旱农牧交错区,是黄土高原向鄂尔多斯台地的过渡地带,属于典型的中温带大陆性季风气候,年均温7.1 ℃,年日照时数为2864 h,年降水量250~300 mm,且大部分集中在6-9月,年蒸发量在2600 mm左右,年无霜期165 d,生长期短、干旱少雨、风沙大,自然条件较为恶劣。土壤类型主要为灰钙土,肥力差[16]。
多年生豆科植物苦豆子是一种很好的固沙植物,它在生态平衡的维护、土地沙漠化和水土流失的防治过程中起着独特的有益作用[17]。禾本科植物沙芦草是荒漠草原地带植被之一,不仅具有极高的饲用价值,且具有极强的耐旱、耐寒和抗风沙能力,也是一种良好的固沙植物,在生态环境改善过程中具有重要意义。本试验的苦豆子样地选在宁夏盐池县沙边子试验站,沙芦草的样地选在盐池县四墩子试验站。这些样地自2000年以来一直处于封育状态。

表1 样地基本情况Table 1 The characteristics of the samples plots
1.2 调查取样方法
于2016年7月底,植物生长最旺盛时期,在研究区选取实施围栏封育的以禾本科植物沙芦草和豆科植物苦豆子为优势种的草地类型,以其围栏外的沙芦草群落、苦豆子群落作为对照。在每个样地内沿着对角线随机选取6个5 m×5 m的大样方,在大样方中采取5点采样法,各设5个1 m×1 m的小样方,分别按0~10 cm、10~20 cm 和20~40 cm取土,将同一大样方中5个小样方的同层土样混合,装入塑料袋,两样地总计36个土样带回实验室。将土样去除草根和砾石等杂物,在室内自然风干后过筛,进行土壤酶活性和土壤理化性质的测定。
1.3 试验方法
采用常规分析法测定土壤理化性状[18]以及土壤酶活性[19](表2)。

表2 土壤理化性质和土壤酶活性的测定方法Table 2 The methods of soil physical and chemical properties and soil enzyme activity
1.4 数据处理
采用 Microsoft Excel 2010进行数据整理及图表制作,采用SPSS 17.0软件进行统计分析。其中围栏内外数据差异采用配对T检验分析比较,同一样地不同土层间的差异采用单因素方差分析和最小显著差异法(LSD)进行分析比较。所有数据均为3次重复的平均值。
2 结果与分析
2.1 围栏内外两种植物群落土壤理化性状
由表3可知,围栏对沙芦草群落与苦豆子群落的土壤理化性状产生不同程度的影响。两种植物群落土壤含水量均表现为围栏内大于围栏外,0~10 cm土层显著(P<0.05)。两种植物群落围栏外的土壤容重在各土层之间无显著差异(P>0.05),而在围栏内0~10 cm层出现了最小值,显著低于10~20 cm 和20~40 cm土层(P<0.05),与围栏外相比,围封显著降低了两种植物群落0~10 cm土层的容重。沙芦草群落土壤pH值在围栏内表现为随土层加深先增后降,在围栏外为递减的变化趋势,pH值的变化在0~20 cm土层显著(P<0.05),围封后,土壤pH值在0~10 cm土层显著降低,而在10~20 cm和20~40 cm土层显著提高(P<0.05);苦豆子群落中土壤pH值在围栏内随土层加深而降低,而围栏外随土层加深显著升高。与围栏外相比,围栏内的土壤pH值在0~10 cm土层显著升高,20~40 cm土层显著降低(P<0.05)。土壤有机碳在沙芦草群落表现为围栏外大于围栏内,围栏内0~10 cm土层显著高于10~20 cm和20~40 cm土层(P<0.05);苦豆子群落土壤有机碳均随土层加深而减少,围封显著增加了土壤有机碳含量(P<0.05)。沙芦草围栏内群落和苦豆子围栏内外群落的土壤全氮含量均表现为随土层加深而减少,苦豆子群落围栏内的全氮含量显著高于围栏外。而沙芦草群落围栏内0~10 cm全氮显著高于10~20 cm 和20~40 cm土层(P<0.05);围栏外则反之。两种植物群落围栏内土壤全磷含量在围栏内均表现为随土层加深而降低,沙芦草群落0~10 cm土层显著高于10~20 cm和20~40 cm土层,而苦豆子群落在3个土层的变化不显著(P>0.05)。沙芦草群落围栏内外的土壤碱解氮含量均为20~40 cm土层最高,显著高于0~10 cm土层(P<0.05),围栏封育具有使碱解氮含量降低的趋势;苦豆子群落围栏内碱解氮含量在0~10 cm土层显著高于10~20 cm和20~40 cm土层。土壤速效磷含量在两种植物群落土壤中均表现为0~10 cm土层中最高,随土层深度增加而降低。
2.2 围栏内外两种植物群落的土壤酶活性
由图1可知,围栏封育对沙芦草群落与苦豆子群落的土壤酶活性可产生不同程度的影响。在沙芦草群落中,土壤过氧化氢酶活性在围栏内、外随土层的加深均表现为先降后增的变化趋势,10~20 cm与20~40 cm层间差异显著;与围栏外相比,围栏内土壤过氧化氢酶活性有所减弱,但差异不显著(P>0.05)。土壤磷酸酶活性在沙芦草群落围栏内随土层加深呈倒“V”型,20~40 cm出现最小值,其活性在围栏外有所变化,但均无显著差异(P>0.05);通过配对T检验发现,围封显著降低了沙芦草群落20~40 cm层的土壤磷酸酶活性(P<0.05)。土壤蔗糖酶活性在沙芦草群落围栏内随土层加深而呈现显著减弱的变化趋势,围栏外在10~20 cm层出现最低值,显著低于0~10 cm;围封显著提高了沙芦草群落0~10 cm层的土壤蔗糖酶活性(P<0.05)。土壤脲酶活性在沙芦草群落围栏内、外随土层的加深均呈“V”型,围栏外各土层间差异均显著;围封显著降低了沙芦草群落土壤脲酶活性(P<0.05)。
苦豆子群落中,随土层的加深,围栏外土壤过氧化氢酶活性在10~20 cm土层出现最小值,围封显著提高了10~20 cm土层的过氧化氢酶活性(P<0.05)。围栏外土壤磷酸酶活性随土层加深呈“V”型,10~20 cm显著低于0~10 cm和20~40 cm,而围栏内土壤磷酸酶活性在20~40 cm土层出现最大值;与围栏外比,苦豆子群落围栏内土壤磷酸酶活性在0~10 cm、20~40 cm土层显著降低(P<0.05)。苦豆子群落围栏内、外土壤蔗糖酶活性均随土层加深而减弱,且各土层间差异显著(P<0.05);与围栏外相比,围封显著提高了围栏内0~10 cm土层土壤蔗糖酶活性(P<0.05)。苦豆子群落围栏内土壤脲酶活性变化趋势与其土壤蔗糖酶活性的变化趋势一样,各土层间差异显著,围封显著提高了土壤脲酶活性(P<0.05)。


图1 两种植物群落围栏内外土壤酶活性Fig.1 The soil enzyme activities in inside and outside the fence of two plant communities 不同大写字母表示在围栏内和围栏外处理间差异显著(P<0.05),不同小写字母表示同一样地不同土层间差异显著(P<0.05),误差线为标准差。 Different capital letters mean significant differences between enclosed and unsealed treatments (P<0.05), different lowercase letters mean significant differences in the different soil layers under same community, the bars represent standard deviation.
2.3 土壤酶和土壤理化性质的相关分析
沙芦草、苦豆子群落围栏内、外的土壤理化性状和土壤酶活性之间相关性不同(表4)。沙芦草群落中,土壤过氧化氢酶活性与土壤容重和pH值呈显著负相关关系(P<0.05),相关系数分别为-0.537和-0.539,与土壤有机碳、全氮、碱解氮含量呈显著正相关,相关系数分别为0.570、0.512和0.552 (P<0.05);土壤磷酸酶活性与土壤有机碳含量呈显著正相关关系,相关系数为0.477 (P<0.05);土壤蔗糖酶活性与碱解氮含量呈极显著负相关关系,相关系数为-0.786(P<0.01);土壤脲酶活性与土壤有机碳、全磷、速效磷含量极显著正相关,相关系数分别为0.722、0.665和0.835(P<0.01)。苦豆子群落中,土壤过氧化氢酶活性与土壤有机碳、速效磷含量表现为显著正相关,相关系数分别为0.540和0.491(P<0.05);土壤磷酸酶活性与土壤含水量和全磷含量呈极显著负相关关系(P<0.01),相关系数分别为-0.614和-0.666,与土壤有机碳和全氮含量达到了显著负相关关系,相关系数分别为-0.542和-0.567(P<0.05) ;土壤蔗糖酶活性与土壤有机碳、全磷、全氮、碱解氮和速效磷含量均达到了极显著正相关关系,相关系数分别为0.873、0.726、0.858、0.870和0.918(P<0.01),而与土壤容重达到了极显著负相关关系,相关系数为-0.754(P<0.01),与土壤pH值呈显著负相关关系,相关系数为-0.523;土壤脲酶活性与土壤有机碳、全磷、全氮、碱解氮、速效磷含量均为极显著正相关关系,相关系数分别为 0.940、0.896、0.956、0.900和0.922,而与土壤容重达到了极显著负相关关系,相关系数为-0.810 (P<0.01)。
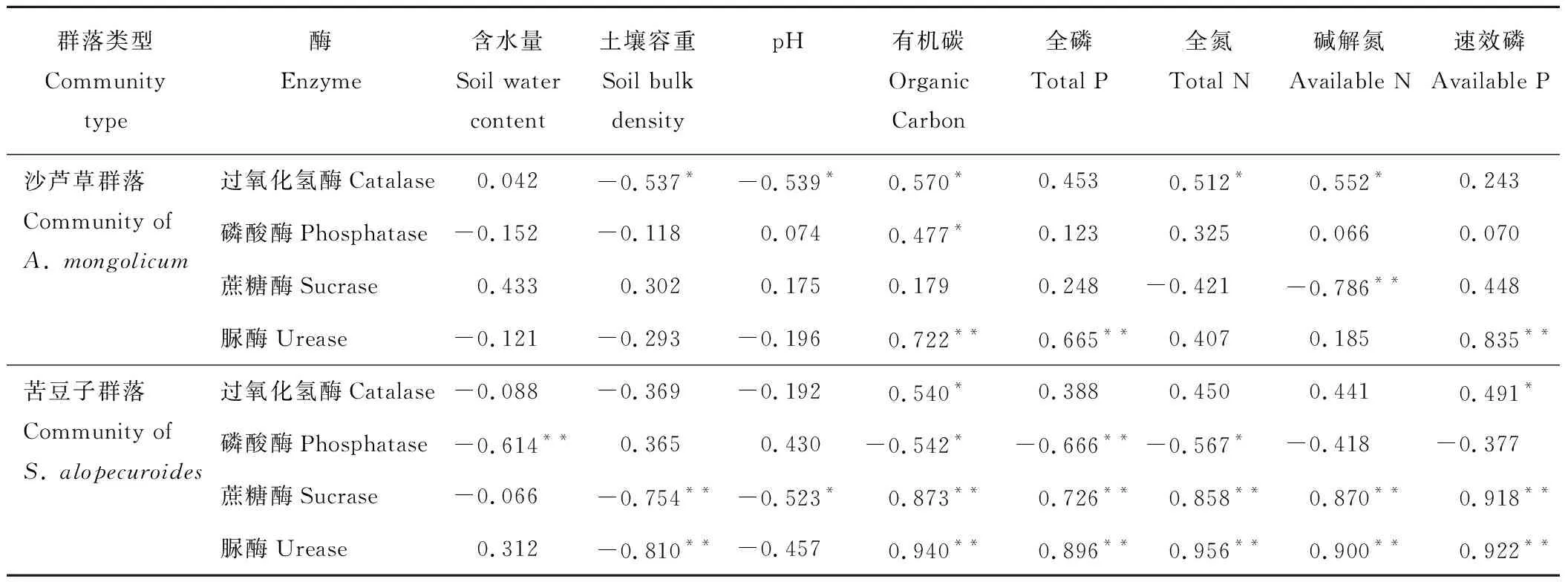
表4 两种植物群落围栏内外土壤理化性质和土壤酶活性的相关分析Table 4 Correlation analysis between soil physiochemical character and enzyme activities in inside and outside the fence of two plant communities
注:** 表示在 0.01水平上极显著相关(P<0.01),* 表示在 0.05水平上显著相关(P<0.05)。
Note: ** show highly significant correlation at the 0.01 probability level, * show significant correlation at the 0.05 probability level.
3 讨论
3.1 围封对两种植物群落土壤理化性状的影响
研究表明,围封可以促进荒漠草原退化植被与土壤的恢复,并使土壤养分得以富集[20-21]。植被覆盖度、生长状况及土壤水分的蒸发是影响土壤含水量的重要原因[22]。本研究结果表明,围栏封育后,两种植物群落 0~10 cm土层的土壤含水量显著提高(P<0.05),而20~40 cm土层无显著变化(P>0.05),与前人的研究结果一致[23],究其原因,主要是因为围栏封育样地植被恢复良好,较高的覆盖和大量凋落物的积累有效减少了土壤水分的蒸发。此外,围栏封育后两种植物群落表层土壤(0~10 cm)容重均显著降低,深层20~40 cm土壤无显著变化,这与已有的研究结果一致[24-26]。因为围栏封育不仅排除了家畜的践踏,直接减小了对表层土壤的压力,而且排除外界干扰后,植被恢复过程中根系的生长使土壤疏松从而降低了土壤容重[26]。本研究中,两种植物群落土壤pH值的变化有一定差异,围封后沙芦草群落表层(0~10 cm)土壤pH值显著降低,而深层土的碱性增强,说明围封后更多凋落物的分解可以改善表层土壤的酸碱度[27],而深层土壤pH值升高可能是因为土壤中的盐碱物随水分下渗的原因[16]。苦豆子群落围栏内表层(0~10 cm)土壤pH值显著升高,一方面因为苦豆子自身具有耐盐碱性;另一方面可能与苦豆子含有大量的生物碱类物质有关[28]。
两种植物群落土壤养分对封育的响应有所不同。最新的研究结果也证实了围封能够显著增加土壤的微生物碳和微生物氮[29]。围封后,苦豆子群落土壤有机碳、全氮、全磷、碱解氮、速效磷均显著提高,尤其在0~20 cm土层土壤养分明显增加,这与已有的研究结果一致[23,30]。这是由于围封后有更多的生物量归还土壤,其腐烂降解后提高土壤养分含量,并且作为重要绿肥的苦豆子具有固氮功能。在沙芦草群落中,与围栏外相比,围封处理后0~10 cm土层土壤有机碳、全磷及全氮含量均有所增加,而土壤碱解氮、速效磷含量则显著降低,与白永飞等[31]的研究结果相同。这可能与家畜啃食过程中产生大量粪尿有关,牲畜的排泄物中含有大量的硝态氮使得围栏外硝态氮来源增加,而围栏内只能通过氮素的硝化过程获得硝态氮[32];也有可能与放牧致使根系向地表聚集有关[13]。
3.2 围封对两种植物群落土壤酶活性的影响
围封不仅是一种促进退化草原恢复的有效措施,而且对土壤酶活性的变化也有很大影响。与围封草地相比,未围封的草地由于被牲畜践踏,生物结皮破碎[33],微生物的生物量和活性减小[34],过氧化氢酶活性表示土壤氧化过程的强度,一定程度上反映了土壤微生物学过程的强度[35]。
土壤脲酶直接参与土壤氮素循环,可以提高含氮的利用率。土壤磷酸酶促进有机磷化合物的分解,其活性可以表征土壤磷的供应状况[36-37]。土壤蔗糖酶能够促进多种低聚糖的水解,其活性和土壤中有机质的累积和腐殖化程度密切有关,很好地反映了微生物学活性强度和土壤肥力水平[38]。近几年,关于围封对土壤酶活性的相关研究越来越多,研究证实封育显著提高了土壤蔗糖酶、磷酸酶活性[39],土壤脲酶活性随草地的恢复显著提高,土壤过氧化氢酶活性在未围封草地最为活跃[22];封育显著提高了表层(0~10 cm)土壤碱性磷酸酶活性、过氧化氢酶活性和次表层(10~20 cm)土壤脲酶活性,而显著降低了土壤表层蔗糖酶活性[40]。 在本研究中,与围栏外相比,沙芦草群落围栏内表层(0~10 cm)土壤蔗糖酶活性显著提高,土壤脲酶活性显著降低,20~40 cm层的土壤磷酸酶活性显著降低,土壤过氧化氢酶活性无明显变化;苦豆子群落中,围封显著提高了10~20 cm层土壤过氧化氢酶活性和土壤蔗糖酶活性、土壤脲酶活性,而土壤磷酸酶活性有显著降低趋势。以上研究结果表明围栏封育对不同植物群落土壤酶活性的影响是不同的,究其原因,可能有以下3个方面的原因:一是两种植物本身的特性不同(豆科固氮,禾本科为优良牧草)[41-42],植物种类和组成不同,其根系分泌物和枯落物的质和量就不同,从而引起土壤酶活性的差异[43];二是可能与围封后大量凋落物的还田,苦豆子与沙芦草不同的分解难易程度对土壤的透气性、呼吸强度的产生不同的变化有关[44];第三,也可能是土壤质地、土壤养分不同造成的[29]。
3.3 土壤酶活性与土壤理化性质的相关分析
关于围封后植物群落土壤酶活性与土壤理化性质研究,发现土壤酶活性与土壤有机质、全氮、速效磷含量之间具有显著的相关关系,其活性可以较好表征草原退化与恢复状况[45]。斯贵才等[46]在高雄县高寒草原的研究显示,土壤有机碳、有机氮、土壤含水量均与土壤酶活性呈显著或极显著相关,因此这些指标可以指示退化草地修复状况。本研究中发现土壤酶活性与土壤理化性状之间存在不同程度的相关关系,总体来看,苦豆子群落土壤酶活性与土壤理化性状之间的相关性较沙芦草群落的高,苦豆子群落中土壤蔗糖酶和土壤脲酶活性与土壤养分均极显著正相关,而磷酸酶活性与之呈负相关;沙芦草群落中脲酶活性与土壤有机碳、全磷、速效磷含量均为极显著正相关关系,而过氧化氢酶活性与土壤有机碳、全氮、碱解氮含量之间呈显著正相关关系。这与赵帅等[45]的研究结果并不是完全一致,这种差异的出现可能与研究区的土壤质地有关,也可能是植物群落不同的原因所致。说明不同酶活性与土壤理化性状间的相互作用机制共同影响并决定着土壤演化方向,因为土壤酶对促进碳、氮、磷等有机化合物的生物地球化学循环以及加速成土过程起着主要的作用。
4 结论
荒漠草原围封后,沙芦草和苦豆子两种典型植物群落在10 cm内的表层土壤的含水量和土壤养分(全氮和全磷)增加,土壤容重显著降低,过氧化氢酶、蔗糖酶、脲酶和磷酸酶这4种土壤酶的酶活性变化没有表现出明显的规律性。两种植物群落的土壤酶活性与土壤理化性状间相关性各异,但两种植物群落中的脲酶活性与其土壤有机碳、全磷、速效磷含量之间存在极显著正相关关系。

