三碘甲状腺原氨酸对B细胞成熟分化的机制研究
曹 欣,陆婷婷,胡 蕴,李国庆,程 亮,刘晓梅,毛晓明
0 引 言
Graves′病是常见的器官特异性自身免疫性疾病,目前普遍认为其发病是遗传和环境因素共同作用,但确切发病机制尚未阐明。研究发现环境因素的变化会引起甲状腺激素的波动,抑郁往往伴随甲状腺激素水平下降,而精神紧张或情绪激动会引起甲状腺激素水平的升高[1-2]。在Graves′病的治疗过程中也发现,甲状腺激素水平在一定程度上也决定了Graves′病的病理进展及转归,抗甲状腺药物最主要的作用是抑制甲状腺激素合成,药物治疗后近一半的患者可以痊愈,并且高甲状腺激素水平与药物治疗后甲亢复发密切相关[3-4],抗甲状腺药物治疗过程中出现反复甲减可以减少停药后甲亢的复发[5]。因此,甲状腺激素水平的升高可能在Graves′病的发病、病理进展以及转归中起重要作用。但甲状腺激素是否会引起免疫功能的变化目前仍不清楚。体液免疫异常在Graves′病发病中起重要作用,B淋巴细胞激活并合成、分泌促甲状腺激素受体抗体(Thyrotrophin receptor antibody,TRAb)是Graves′病发病的中心环节,本研究通过皮下注射三碘甲状腺原氨酸(Triiodothyronine,T3)诱导小鼠高T3状态,观察甲状腺激素对B细胞活化的影响作用及机制。
1 材料与方法
1.1 材料
1.1.1 试剂APC-鼠抗人B220、PE-鼠抗人CD138、PE-Cy7-鼠抗人IgM、PE-鼠抗人IgD、PE-Cy7-鼠抗人IgG(美国BD公司)、大鼠抗BAFF抗体(英国abcam公司)、小鼠脏器淋巴细胞分离液(天津灏洋生物公司)、TRIzol(美国Life公司)、抗大鼠二抗(CST公司)、实时荧光定量逆转录聚合酶链式反应(Reverse transcription-polymerase chain reaction,RT-PCR)试剂盒(日本Takara公司)、引物(生工生物工程(上海)股份有限公司)、BCA蛋白提取试剂盒(美国sigma公司),T3(大连美仑生物技术有限公司)。
1.1.2 仪器分选型流式细胞仪(美国BD公司)、实时荧光定量PCR仪7500型(美国ABI公司)、酶标仪680型(美国BIO-RAD公司)、高速低温离心机(德国Eppendorf公司)、紫外分光光度计(德国Eppendorf公司)、化学发光检测仪Modular Analytics E170 analyzer(德国Roche Diagnostics GmbH公司)
1.1.3 实验动物采用SPF级6~8周龄雌性C57BL/6J小鼠,实验动物合格证号:SCXK(苏)2002-0031,由南京市第一医院提供。小鼠置于湿度45%~50%,温度(22±4)℃左右环境中饲养,自由采光。将小鼠随机数字表法分为对照组(n=30)和T3组(n=50),分别予对照组和T3组小鼠每天皮下注射200 μL等渗盐水和等量5 μg/10 g T3,以固定量的饲料和饮水喂养小鼠,6周后称量小鼠剩余饲料和饮水,计算小鼠的饮食量和饮水量。
1.2 方法
1.2.1 qPCR检测脾组织细胞BAFF miRNAs的表达用Trizol法提取小鼠脾组织RNA,Miscript RT反转录试剂盒反转录miRNA cDNA,实时荧光定量PCR仪扩增内参和目的基因BAFF,通过2-△△Ct计算脾组织中BAFF的相对表达量。(内参及目的基因 的 基 因 序 列 :Mouse β -actin F:5′-AGAGGGAAATCGTGCGTGAC-3′,R:5′-CAATAGTGATGACCTGGCCGT-3′; MouseBAFFF:5′-CCACCGTGCCTCTGTTTTTG-3′,R:5′-CTTCTGCGGAGTGATGGGAT-3′)。
1.2.2 流式细胞术检测浆细胞及B细胞表达抗体的比例T3注射6周后取小鼠外周血、骨髓、新鲜脾,淋巴细胞分离液分离单个核细胞。加入APC标记的B220抗体、PE标记的CD138、PE-Cy7标记的IgM、PE标记的IgD抗体,PE标记的IgG抗体,流式细胞仪检测每份标本中B220+CD138+,B220+IgM+IgD+细胞的比例。
1.2.3 Western blot方法测定BAFF表达提取脾组织蛋白,BCA蛋白定量试剂盒测定蛋白浓度,根据标准曲线计算出蛋白浓度。进行SDS-PAGE电泳、转膜、室温封闭,一抗4℃孵育过夜,二抗孵育曝光、显影,软件分析比较各组BAFF蛋白相对表达量。
1.2.4 HE染色及免疫组化分别取对照组、T3组小鼠喂养6周后甲状腺和脾标本,固定,常规石蜡包埋,连续切片,厚度5 μm,常规HE染色。将石蜡切片进行脱蜡、水化、封固、加入大鼠抗BAFF单克隆抗体,加二抗、显色、冲洗、复染、脱水、透明、封固,观察对比两组小鼠甲状腺以及脾BAFF表达。
1.2.5 ELISA法测定血浆BAFF水平分别取对照组、T3组小鼠喂养6周后血浆,按照试剂盒说明书ELISA测定血浆中BAFF水平。
1.3 统计学分析采用SPSS 22.0软件进行统计分析,定量资料以平均数±标准差(xˉ± s)表示,2组间计量资料数据比较采用独立样本t检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 高T3对小鼠饮食、饮水以及体重的影响结果显示,注射T3 6周后,T3组小鼠血浆T3水平、饮食、饮水均较对照组明显升高(P<0.01)。见表1。
2.2 高T3对小鼠脾的影响PCR法以及Western blot检测结果表明,T3组小鼠单个核细胞BAFF的相对 mRNA 以及蛋白表达(2.03±0.52、0.50±0.03)较对照组(1.06±0.19、0.05±0.01)升高(P<0.01),见图1。HE染色结果表明,T3组小鼠较对照组小鼠脾体积明显增大,白髓区明显增大,且出现白髓区融合。小鼠脾称重表明,T3组小鼠脾重量[(0.137±0.042)g/只]高于对照组[(0.093±0.03)g/只],差异有统计学意义(P<0.01)。免疫组化结果显示,T3组小鼠脾单个核细胞BAFF表达明显增加。见图2。流式细胞仪检测显示,T3组小鼠脾浆细胞数量以及B细胞中表达抗体比例较对照组增加(P<0.05),见图3,表2。
表1 各组小鼠体重、饮食以及饮水量变化Table 1 Changes in body weight,diet,and water intake in each group(xˉ±s)
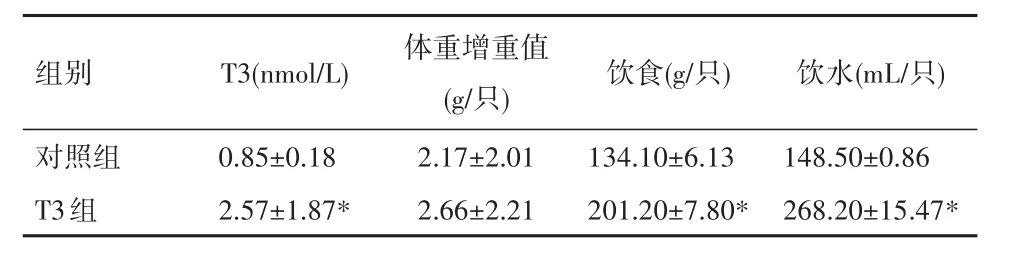
表1 各组小鼠体重、饮食以及饮水量变化Table 1 Changes in body weight,diet,and water intake in each group(xˉ±s)
与对照组比较,*P<0.01
?

图1 Western blot检测小鼠脾BAFF蛋白水平表达Figure1 Expression of BAFF protein level by western blot

图2 镜下观察高T3对小鼠脾的影响(免疫组化×100)Figure 2 The effects of high T3 on mouse spleen by microscope(IHC ×100)

图3 流式细胞术检测各组小鼠脾浆细胞和B细胞表达抗体比例Figure 3 Proportion of spleen plasma cells and B cells antibodiesexpressingineachgroupbyflowcytometry

表2 各组小鼠脾和外周血中浆细胞比例和B细胞中表达抗体比例的比较(xˉ±s,%)Table 2 Proportion of spleen and peripheral blood plasma cells and B cells antibodies expressing in each group(xˉ±s,%)
2.3 高T3对小鼠骨髓以及外周血的影响流式细胞仪检测结果表明,T3组小鼠骨髓浆细胞比例以及抗体表达较对照组明显增加(P<0.05),见图4,外周血浆细胞比例以及抗体表达较对照组降低(P<0.05),见图5,表2。ELISA检测结果表明,T3组小鼠外周血 BAFF水平[(7.61±1.72)pg/mL]较对照组[(5.98±0.78)pg/mL]明显升高(P<0.01)。

图4 流式细胞术检测小鼠骨髓浆细胞和B细胞表达抗体比例Figure 4 Proportion of bone marrow plasma cells and B cells antibodies expressing in each group by flow cytometry

图5 流式细胞术检测小鼠外周血脾浆细胞和B细胞表达抗体比例Figure 5 Proportion of peripheral blood plasma cells and B cells antibodies expressing in each group by flow cytometry
2.4 高T3对小鼠甲状腺的影响HE染色结果显示,T3组小鼠甲状腺出现滤泡上皮细胞融合,滤泡内甲状腺球蛋白染色变浅,提示甲状腺球蛋白含量降低。免疫组化结果显示,T3组小鼠甲状腺单个核细胞BAFF表达水平增加,见图6。

图6 镜下观察高T3对小鼠甲状腺的影响(HE×100)Figure 6 The effects of high T3 on mouse thyroid by microscope(HE ×100)
3 讨 论
许多基因变异或多态性与Graves′病相关,如CTLA4、PTPN22、FOXP3、CD25、CD40、Tg 等[6-7],但遗传因素在Graves′病中的实际价值目前仍停留在疾病发病风险的预测,因此探究环境因素引起Graves′病的机制在预防或治疗Graves′病更为重要。研究显示,T3对免疫系统的影响具有多效性,且具有促进树突状细胞成熟以及免疫应答的作用[8]。同时,T3也可以调节T细胞由胸腺向外周淋巴器官的归巢[9]。目前,关于T3对B细胞成熟分化机制的研究相对较少。
TRAb与促甲状腺激素受体合,持续性刺激甲状腺滤泡细胞合成及分泌超生理量的甲状腺激素,从而导致Grave’s病的发生发展。TRAb是B细胞分泌的一种抗体,而B细胞主要介导体液免疫,在骨髓中未成熟的B细胞产生IgM[10-11],随着B细胞的进一步成熟,细胞表面出现IgD,同时IgM和B220的表达上调。在这个阶段,B细胞离开骨髓进入血液循环和外周淋巴器官,如脾,最终成熟的B细胞主要合成IgG[12-13]。在外周淋巴器官中,活化的B细胞进一步分化为浆细胞,并伴随着几种膜分子表达的变化,包括在细胞表面上调的B220和初次表达CD138[14-16]。B细胞的成熟分化异常被认为是触发自身免疫连锁反应、引起自身免疫疾病发生及发展的关键,因此B细胞有希望成为治疗自身免疫性疾病的重要靶点[17]。
BAFF是肿瘤坏死因子家族成员,它在中性粒细胞、单核细胞、树突细胞及活化的T淋巴细胞中都有表达[18],其他如慢性淋巴细胞性白血病(B—CLL)和多发性骨髓瘤(MM)中的少量B细胞也可以合成和分泌BAFF[19],但是在正常人的B细胞上无BAFF表达。而BAFF受体主要表达于B细胞表面,BAFF与B细胞表面BAFF受体的结合过度刺激B细胞,通过增加B细胞增殖、减少凋亡以及阻断自身反应性B细胞的抑制作用,从而促进了自身抗体的产生,因此参与B细胞成熟并分化成浆细胞的过程[20-22]。有文献报道,Graves′病患者血浆BAFF水平明显高于正常人组和甲状腺结节组,而免疫治疗后BAFF水平下降,表明BAFF参与了甲亢的发生发展[23-25]。Graves′病患者BAFF与血清TRAb及T3水平呈明显的正相关,提示BAFF介导B细胞激活的过程在Graves′病的发病中起重要作用[24,26]。本研究发现,小鼠注射T3后,虽然饮食、饮水明显增加,但是小鼠总体重量无明显变化,然而其脾重量和体积明显增加,表明T3可以减轻小鼠体重,增加脾重量和体积。注射T3后,小鼠骨髓和脾中的浆细胞和产生自身抗体的B细胞比例明显增加,而外周血浆细胞以及产生自身抗体的B细胞比例降低,这表明,T3能导致骨髓以及脾浆细胞增殖,增加产生自身抗体的数量并加强外周血浆细胞向骨髓以及脾的募集。BAFF作为B细胞的激活因子,注射T3后,小鼠外周血、脾中单个核细胞表面的BAFF表达量明显增加,进一步证实T3能够刺激B细胞激活。HE染色以及免疫组化结果显示,T3组小鼠甲状腺滤泡结构出现融合,其单个核细胞表面的BAFF表达增加,表明T3参与激活了甲状腺内B细胞,并导致甲状腺滤泡结构改变。
本研究发现,T3能促进B细胞在脾和骨髓中的分化。Arpin等[27]的研究表明阻断T3受体可导致B细胞增殖分化减少,与本项研究结果一致。Flavia等[28]研究发现,T3治疗小鼠脾ELISA检测自身抗体的量明显增加,与我们研究产生自身抗体的B细胞数量增加的结果一致。注射T3后,小鼠脾重量明显增加,脾白髓区明显增大并且脾白髓区出现明显的融合,该现象可能与T3造成脾B细胞多克隆激活有关[28-29]。本研究首次发现高T3水平可以导致脾以及外周血单个核细胞表面BAFF表达明显增加¬。文献报道,Graves′病患者体内BAFF的表达水平与TRAb和B细胞的数量成正相关,与我们研究一致,表明BAFF可能参与T3对脾B细胞的刺激[26]。本研究中,外周血流式细胞术分析结果显示,高T3可导致外周血浆细胞以及表达自身抗体的B细胞比例降低。而Flavia等[28]的研究结果与我们相反,他们发现T3注射两周后小鼠外周血浆细胞比例升高,这可能与我们延长了T3注射周期(延长至6周),从而导致外周血的浆细胞募集作用有关,长时间高水平T3注射后小鼠可出现外周血浆细胞向其他免疫器官的迁移[30]。Graves′病患者甲状腺滤泡细胞数量增加,这可能与甲状腺滤泡结构功能损伤的机制有关。通过小鼠甲状腺免疫组化以及HE染色结果表明,T3可导致小鼠甲状腺滤泡细胞的增加和融合,并且我们发现甲状腺滤泡内TG减少,这可能表明高T3造成甲状腺滤泡结构和功能损伤。
目前存在的关于甲状腺自身免疫性疾病的治疗都各有利弊,因此寻找新的治疗方法,更深入的探究疾病的发生机制显得尤为重要[31]。本研究发现高T3可以激活BAFF,并刺激B细胞增殖分化,本实验旨在探究高水平T3对小鼠免疫系统的影响,虽然小鼠本身并未形成有效的甲亢模型,但是对于未治疗甲亢的预后以及治疗后甲状腺激素居高不下的患者的疾病发展机制以及治疗方向提供相关的理论基础,对于深入研究Graves′病的发生与发展机制提供了新的思路。

