微波辅助提取银耳多糖工艺优化及其流变、凝胶特性
杨嘉丹,刘婷婷,张闪闪,曹宸瑀,王大为*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
银耳(Tremella fuciformis)又名白木耳,雪耳[1],是一种经济价值高,营养丰富的药食两用菌,具有滋补生津、润肺养胃之功效[2]。银耳多糖来源于银耳子实体、孢子、发酵液中分离纯化得到的带有分支的杂多糖,具有抗肿瘤、抗氧化[3]、降低血脂[4]、促进伤口愈合[5]、增强免疫力[6]等功效。由于多糖普遍具有相对较大的分子质量,通常以主链伴以侧链的形式存在,同时它具有多个羟基和空间折叠结构,故其具有其他物质所不具有的加工特性和流变性质[7]。许多天然存在的多糖由于其在不同条件下的独特流变性质而被用作增稠剂[8]、胶凝剂[9]和乳化剂[10]。虽然银耳多糖的分子构型、构象和生物活性[1]已经得到了广泛研究,但是在水溶液中的动态流变学特性方面的研究依然非常有限,其凝胶特性目前鲜见相关报道。张姗姗等[11]将银耳多糖浸提液作为部分乳化剂和增稠剂的替代,添加到花生蛋白饮料中提高了饮料稳定性和质构特性。祁营利[12]探究了银耳全粉的流变学特性和其作为一种增稠剂的效果。Zhang Yakun等[13]利用热水浸提法提取了银耳多糖,并研究了银耳多糖的流变学特性及其与肌原纤维蛋白的相互作用,发现银耳多糖在低脂肪肉制品加工中具有广阔的应用前景。传统的银耳多糖提取方法多为热水浸提法,该法耗时长、成本高、提取率低[14]。
近年来,微波技术用于天然植物有效成分的提取已有大量报道,它具有快速、高效、安全、提取率高、节能等特点[15]。本研究中采用微波辅助法提取的银耳多糖,其黏度增加,表现出更好的流变特性和凝胶特性,有利于将银耳多糖乃至银耳全粉最大化地应用于食品工业中替代部分胶体的使用,例如果冻、软糖制品等。这为银耳在食品工业中的应用提供一定理论依据。
1 材料与方法
1.1 材料与试剂
银耳采购于沃尔玛超市,冷水清洗除杂后60 ℃烘干,粉碎后过筛得到不同粒度的银耳粉备用。无水乙醇、三氯甲烷、正丁醇(均为分析纯) 北京化工厂。
1.2 仪器与设备
UWave-1000微波紫外超声波三位一体合成萃取反应仪上海新仪微波化学科技有限公司;UV2100紫外-可见分光光度计 美国UNICO公司;RE-3000旋转蒸发器上海亚荣生化仪器厂;Alpha1-4LDplus真空冷冻干燥机德国Marin Christ公司;IR Prestige傅里叶变换红外光谱仪日本岛津公司;DHR-3流变仪 美国TA公司;TA/XT Plus质构仪 英国Stable Micro Systems公司;DF-II型集热式磁力搅拌器 江苏金坛荣华仪器制造有限公司。
1.3 方法
1.3.1 微波辅助提取银耳多糖
准确称取所需粒度的银耳粉10 g,按相应的液料比加入蒸馏水,在一定时间和功率下进行微波辅助提取。将提取液离心(4 000 r/min,20 min)收集上清液,上清液脱蛋白(1/5 Sevag试剂,正丁醇-氯仿(1∶4,V/V),振荡20 min),浓缩,醇沉(4 倍体积分数95%乙醇溶液,12 h,4 ℃),离心(4 000 r/min,20 min)得到的沉淀经冷冻干燥后即为银耳多糖。
1.3.2 单因素试验
选取液料比、粒度、微波功率、微波时间为考察因素。提取温度95 ℃,液料比设定为30∶1、40∶1、50∶1、60∶1、70∶1(mL/g),粒度设定为60、80、100、120、140 目,微波功率设定为250、300、350、400、450 W,微波时间设定为0.5、1.0、1.5、2.0、2.5 h,以银耳多糖提取率为考察指标进行实验。每组单因素试验做3 组平行。单因素试验中不变的因素设定为液料比60∶1(mL/g)、粒度100 目、微波功率300 W、微波时间1.0 h。
1.3.3 正交试验优化
根据单因素试验结果,对1.3.2节中的4 个单因素各取3水平,进行正交试验,确定银耳多糖的最佳提取工艺参数,因素与水平如表1所示。

表1 正交试验因素与水平Table 1 Factors and their levels used in orthogonal array design
1.3.4 银耳多糖提取率计算
标准曲线的绘制:以葡萄糖标准品绘制标准曲线[16]。以葡萄糖质量浓度为横坐标,吸光度为纵坐标,得到线性回归方程为y=0.010 5x+0.088 5,R2=0.996 5。
银耳多糖提取率的测定:将银耳多糖提取液稀释到一定质量浓度,吸取1 mL于具塞试管中,按照标准曲线制作步骤操作,于波长490 nm处测定吸光度,由标准曲线计算出粗多糖的质量浓度,按下式计算多糖提取率:
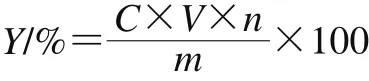
式中:Y为多糖提取率/%;C为标准曲线上得出的银耳多糖的质量浓度/(mg/mL);V为样品体积/mL;n为稀释倍数;m为银耳粉质量/g。
1.3.5 傅里叶变换红外光谱分析
参照李晋等[17]方法,称取银耳多糖2 mg,加入200 mg烘干至恒质量的KBr,置研钵中研磨均匀,用电动压片机压片,在4 000~400 cm-1范围进行红外扫描。
1.3.6 流变特性测试
称取银耳多糖20、100、200、300、400 mg,分别溶于20 mL蒸馏水中,60 ℃水浴锅内搅拌至完全溶解,得到质量浓度分别为1、5、10、15 mg/mL和20 mg/mL的银耳多糖溶液。
使用具有40 mm平行板的流变仪研究银耳多糖质量浓度和温度对其溶液黏度的影响,及不同温度(5~40 ℃)和角频率(0.1~100 r/s)下,不同质量浓度的银耳多糖溶液的动态黏弹性行为。测量储能模量(G’)和损耗模量(G’’)并将其绘制为角频率的函数。
1.3.7 凝胶特性测试
称取银耳多糖1 000、1 250、1 500、1 750、2 000 mg,分别溶于50 mL蒸馏水中,60 ℃水浴锅内搅拌至完全溶解,然后立即转移至冷水(4~10 ℃)中,得到质量浓度为20、25、30、35 mg/mL和40 mg/mL的银耳多糖凝胶。质构分析之前于4 ℃冰箱内贮存过夜。
使用质构仪在室温下进行凝胶的质构分析。分析参数如下:P/36R不锈钢圆柱形探头,测前试速率和测中速率为1.0 mm/s,测后速率为10.0 mm/s,压缩程度25%,触发力5.0 g。每组实验平行3 次进行。
1.3.8 溶解性测试
称取一定量的银耳多糖放入烧杯中,加定量蒸馏水,在60 ℃用磁力搅拌器搅拌,记录多糖完全溶解所需时间。
1.4 数据处理
实验数据采用Excel进行绘图,SPSS 16.0进行统计分析。
2 结果与分析
2.1 单因素试验结果
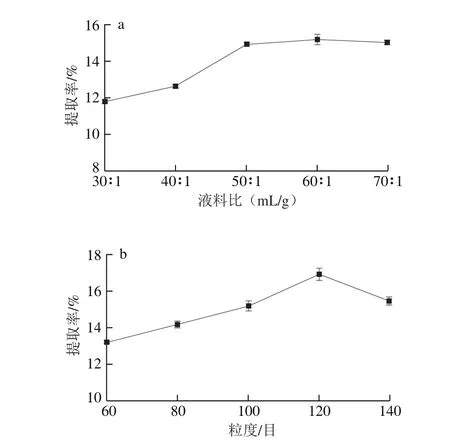
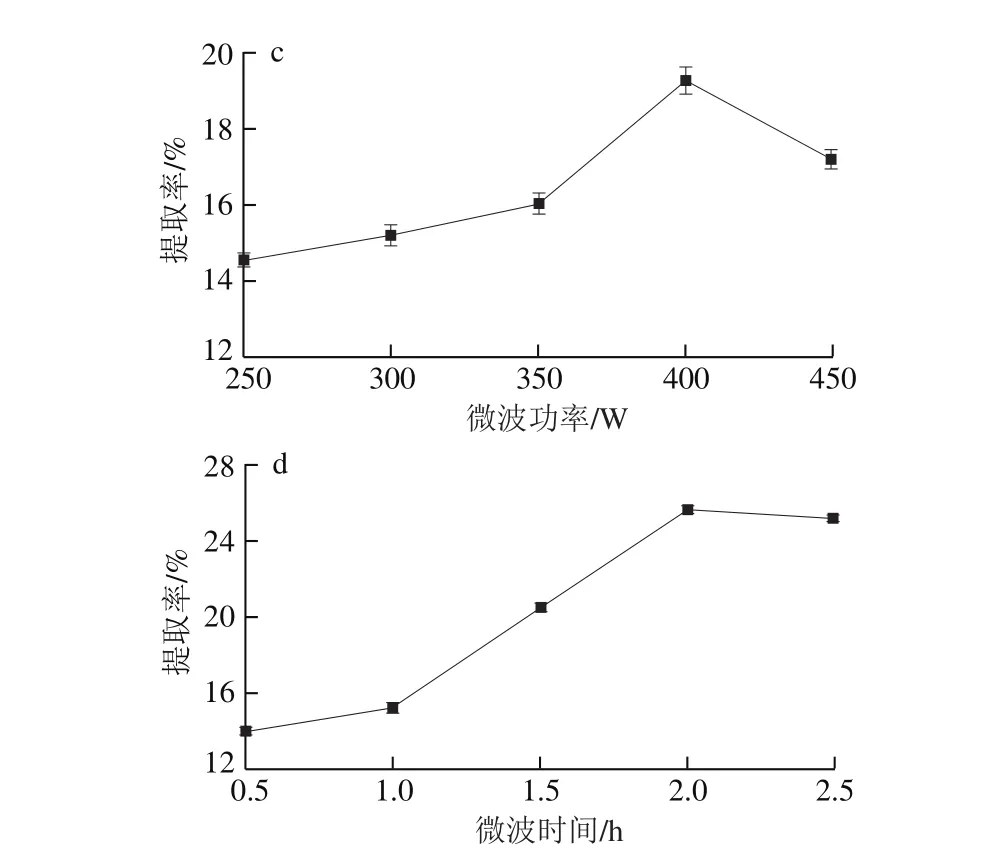
图1 液料比(a)、粒度(b)、微波功率(c)及微波时间(d)对银耳多糖提取率的影响Fig. 1 Effects of liquid/material ratio (a), raw material particle size (b),microwave power (c) and radiation time (d) on the extraction efficiency of polysaccharide from T. fuciformis
由图1a可知,液料比在30∶1~60∶1(mL/g)时,银耳多糖的提取率呈现上升的趋势,当液料比大于60∶1(mL/g)时,银耳多糖提取率呈现稳定趋势。适量的增加溶剂有利于提升银耳多糖的提取率[18],当银耳多糖充分溶出后,继续增加溶剂使得后续浓缩和沉淀工艺难度加大,且提取率变化不显著。因此,考虑到节约能源,选取液料比60∶1(mL/g)比较合适。
由图1b可知,粒度对银耳多糖提取率有一定影响,随着粒度的变细,物料与溶剂接触的表面积增大,有助于多糖加速溶出,使得银耳多糖提取率增加。但当物料粒度超过120 目时,粒度过细使得物料容易黏聚成团,减小了与溶剂接触的表面积,进而银耳多糖提取率呈现下降趋势。考虑成本和实际操作,选取粒度为120 目左右较为合适。
由图1c可知,微波功率在250~450 W之间,随着微波功率的增加,银耳多糖的提取率呈现先上升后下降的趋势,当微波功率为400 W时,银耳多糖的提取率最高,微波有助于提升物料内部温度使多糖加速溶出[19],从而使得银耳多糖提取率明显增加。但微波功率过大会阻碍介质渗入[20],导致银耳多糖提取率下降。因此,微波功率应控制在400 W左右。
由图1d可知,微波时间对银耳多糖提取率的影响较为明显,随着微波时间的延长,银耳多糖提取率增加,其原因可能是提取时间延长可明显提高微波的反射、吸收和穿透效果,提高提取率[21]。当微波时间超过2.0 h时,一次提取产生的细胞内外浓度差达到平衡,银耳多糖提取率呈现稳定趋势。考虑时间和成本因素,提取时间选择2.0 h较好。
2.2 正交试验结果
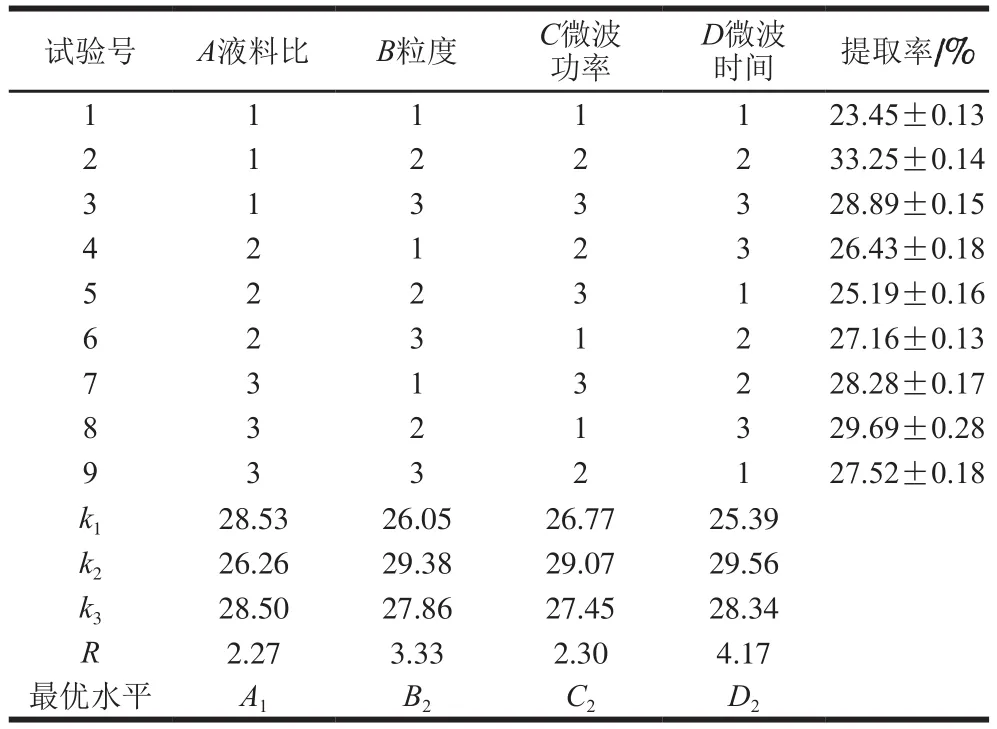
表2 正交试验设计与结果Table 2 Orthogonal array design with experimental results
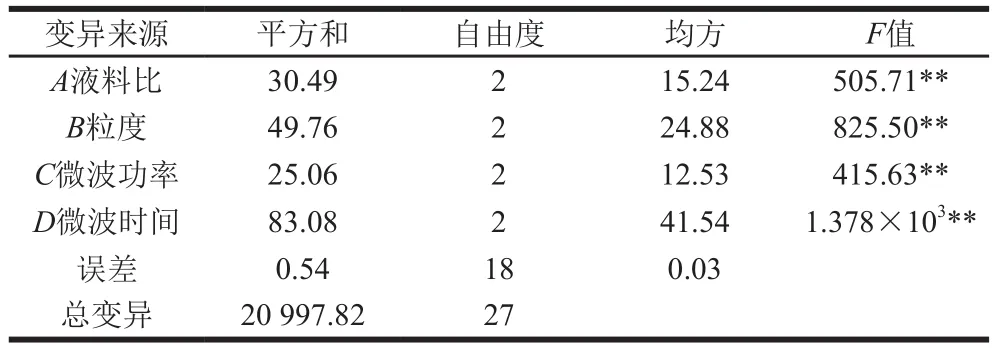
表3 正交试验方差分析结果Table 3 Analysis of variance for orthogonal array design
根据表2中的R值可以得出,在所选试验范围内,各因素对银耳多糖提取率的影响主次为D(微波时间)>B(粒度)>C(微波功率)>A(液料比)。由表3可知,液料比、粒度、微波功率和微波时间对提取率的影响均达到极显著水平(P<0.01),这一结果与极差分析结果一致。由正交试验结果得出,最优方案为A1B2C2D2,即液料比50∶1(mL/g)、粒度120 目、微波功率400 W、微波时间2.0 h。经验证实验,此条件下银耳多糖的提取率为(33.25±0.14)%。
2.3 银耳多糖红外光谱分析
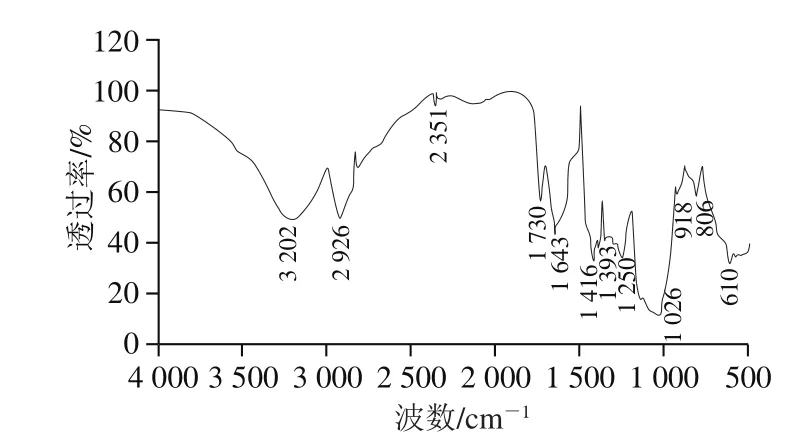
图2 银耳多糖的傅里叶变换红外光谱图Fig. 2 FIIR spectrum of polysaccharides from T. fuciformis
如图2所示,3 202 cm-1和2 926cm-1的吸收带分别来自糖类分子的O—H和C—H伸缩振动[22]。1 643 cm-1和1 416 cm-1可分别对应于糖醛酸中的羰基C=O振动和羰基C—O伸缩振动,这表明银耳多糖是酸性多糖[23]。在1 026 cm-1和1 250 cm-1处的峰分别是由于糖环中的C—O—C伸缩振动和C—H可变角振动[24]。806 cm-1处的吸收峰为α-型吡喃糖的C—H弯曲振动或硫酸盐组中的C—O—S[23,25]。这些结果表明银耳多糖是含有硫酸化基团和糖醛酸的酸性杂多糖。
主要由糖醛酸组成的藻酸盐和主要由硫酸化基团组成的角叉菜胶以其流变性和胶凝行为而被广泛用于食品和生物医药行业[26-27]。类似的还有从浒苔中提取的多糖[28]。因此,具有硫酸化基团和糖醛酸的独特多糖链的银耳多糖,可能具有相似的流变性质和胶凝行为。
2.4 银耳多糖流变特性
2.4.1 剪切速率对黏度和应力的影响
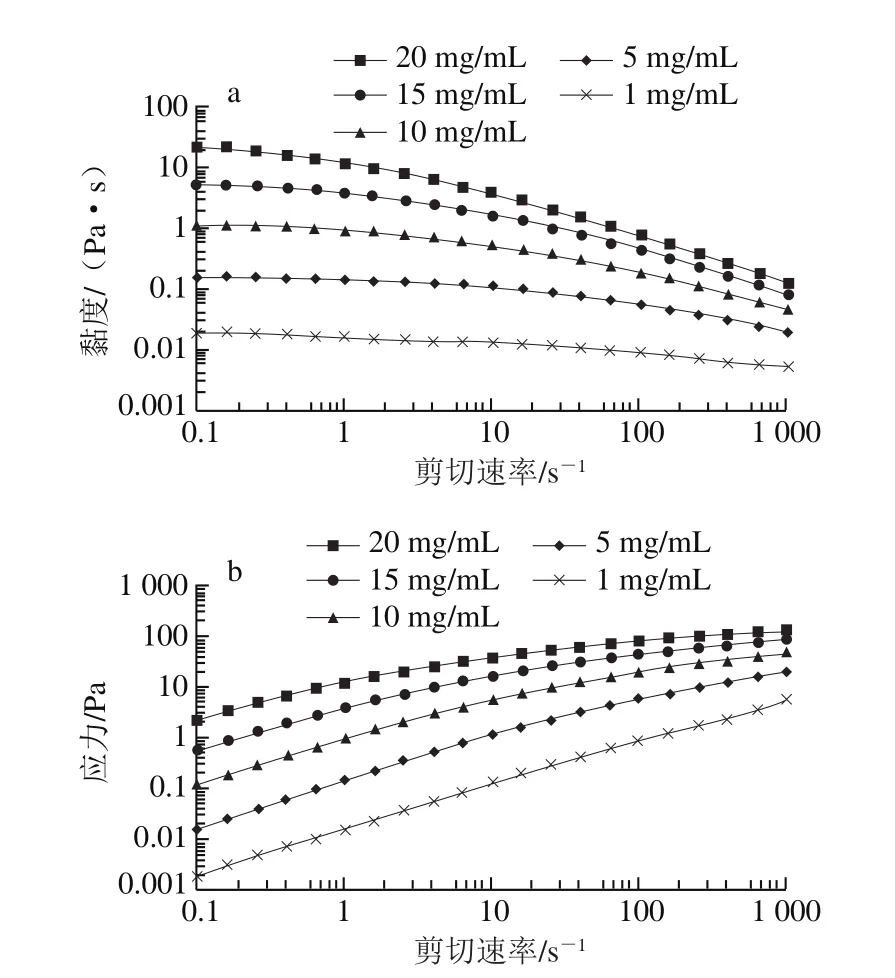
图3 银耳多糖溶液的稳定剪切黏度η(a)和应力σ(b)对剪切速率的依赖性Fig. 3 Shear rate dependence of steady shear viscosity (a) and stress (b) of TPS solutions at 25 ℃
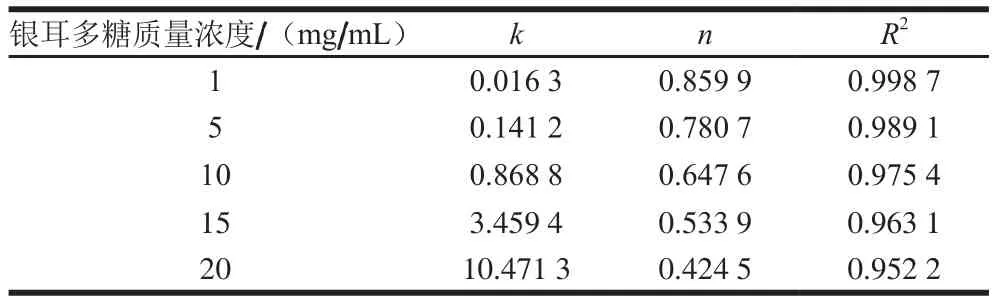
表4 幂律模型拟合参数Table 4 Fitting parameters for the power law model
在25 ℃测试剪切黏度(η)对剪切速率在0.1~1 000 s-1之间的依赖性(图3a)。所有质量浓度下,银耳多糖溶液的剪切黏度随着剪切速率的增加而降低,表明银耳多糖溶液表现出剪切变稀的假塑性[29]。但不同质量浓度的黏度变化率不同。对于高质量浓度的溶液,黏度随着质量浓度的增加而下降得更快;在相同的剪切速率下,溶液黏度随着质量浓度的增加而增加。
随着剪切速率的增加,应力变化曲线(图3b)显示出与黏度曲线相反的趋势。在所有质量浓度下,银耳多糖溶液的应力随着剪切速率的增加而增加,同样也表明了溶液的剪切稀化行为。
将曲线拟合为幂律方程:η=kγn-1,其中,η为剪切黏度,k为一致性指数,γ为剪切速率,n为流动行为指数。n也称为假塑性指数,即n为0~1的流体被归类为假塑性流体;如果n=1,则流体为牛顿流体。如表4所示,通过幂律方程可以解释银耳多糖溶液的剪切稀化行为。可以看到,系统的n值在0.424 5~0.859 9之间,并且较高质量浓度溶液显示出更大的剪切稀化能力,表明了银耳多糖溶液是假塑性流体。随着银耳多糖质量浓度的增加,各个分子开始重叠,形成分子间连接或“连接区”,这种行为限制了含水体系中聚合物链的运动和拉伸。因此,黏度随着质量浓度的增加而显著增加[30]。

图4 不同质量浓度的银耳多糖溶液Fig. 4 Photos of TPS solutions at different concentrations
如图4所示,将6 种不同质量浓度的银耳多糖溶液置于试管中,在4 ℃以45°倾斜24 h后观察样品状态。随着质量浓度的增加,溶液透明度降低并且银耳多糖溶液的黏度增加(图3、4)。图4显示,与其他样品相比,20 mg/mL溶液的流动性显著减弱并且倾斜表面不再是水平的,初步形成了弱凝胶结构。在下面的凝胶特性研究中,将着重于20 mg/mL及其以上质量浓度的银耳多糖凝胶。
2.4.2 温度对表观黏度的影响
如图5所示,在1 000 s-1的剪切速率下,所有质量浓度的银耳多糖溶液的黏度随着温度的升高而降低。这可能是因为提高温度促进了分子运动,使得银耳多糖分子的卷曲结构得到伸展,分子间的相互作用增强,且液体体积以及每个分子的平均占有体积增大,因此,整个体系的表观黏度降低[31]。
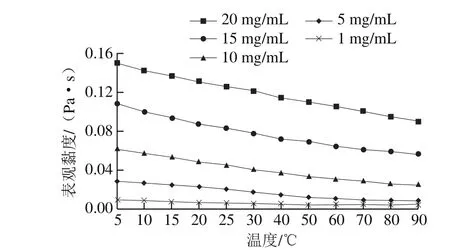
图5 剪切速率为1 000 s- 1时银耳多糖溶液表观黏度对温度的依赖性Fig. 5 Temperature dependence of apparent viscosity (η) of TPS solutions at shear rate of 1 000 s-1
2.4.3 动态黏弹性
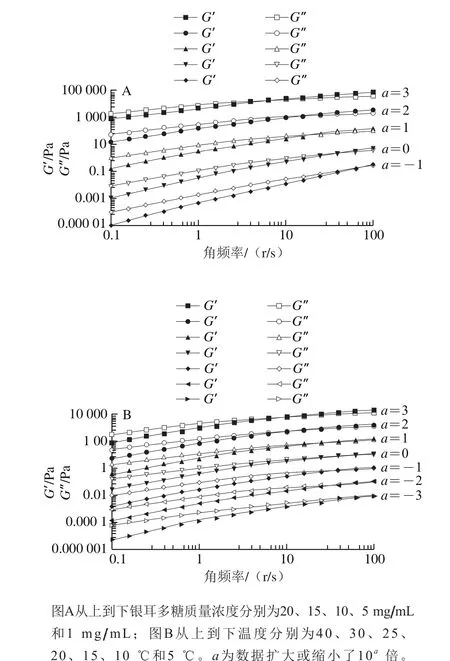
图6 不同质量浓度的银耳多糖溶液在25 ℃的动态流变学(A)以及10 mg/mL银耳多糖溶液在不同温度下的动态流变学(B)Fig. 6 Dynamic rheology of TPS solutions of different concentrations at 25 ℃ (A) and dynamic rheology of 10 mg/mL TPS solution at various temperatures (B)
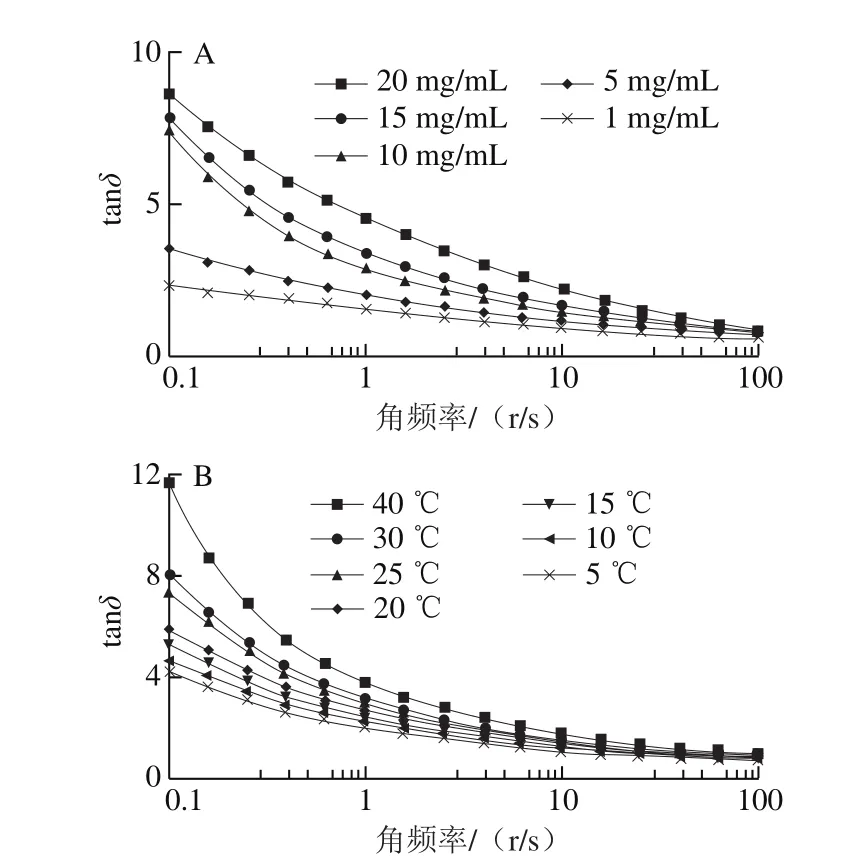
图7 25 ℃不同质量浓度的银耳多糖溶液的tanδ和角频率的关系(A)和不同温度下10 mg/mL的银耳多糖溶液的tanδ和角频率的关系(B)Fig. 7 Relationship between tanδ of TPS solutions of different concentrations and angular frequency at 25 ℃ (A) and between tanδ of 10 mg/mL TPS solution and angular frequency at various temperatures (B)
如图6和图7所示,在25 ℃,G’和G″值随角频率的增加而增加(图6A)。在低频区域,所有质量浓度下的G″都高于G’,表明银耳多糖溶液在低角频率下不能形成凝胶。G’和G’’的曲线在高频区域相交后,G’高于G’’,表明银耳多糖溶液此时可以形成弱凝胶结构。tanδ(G’’/G’)值也可用于解释溶液的流变行为。tanδ<0.1,表示传统的弹性凝胶,而tanδ>0.1,传统的弱凝胶[32]。由图7A可以看到,银耳多糖溶液不形成强弹性凝胶结构。在所有温度下,G’和G’’都随着角频率的增加而增加(图6B)。在降低温度时,G’显著增加,G’和G’’的频率依赖性降低。可以得出,银耳多糖溶液仅在低温和高角频率下才能形成弱凝胶结构。图7B显示10 mg/mL银耳多糖溶液的tanδ随着角频率的增加而显著降低,并且该降低的速率随着温度的升高而增加。因此,银耳多糖溶液在低角频率和高温下不能形成凝胶结构。银耳多糖具有线性化学结构,其在水溶液中变为缠绕结构,并且缠绕程度随着剪切速率的增加而增加[24]。其他真菌多糖也有类似的现象,如黄山花菇多糖[33]。
2.5 质构特性测定结果
如图8所示,将5 种不同质量浓度的银耳多糖凝胶置于试管中,在4 ℃以45°倾斜24 h后观察样品状态。在低质量浓度下,凝胶具有良好的透明度,倾斜表面和强流动性。随着质量浓度的增加,凝胶透明度和表面倾斜度降低,流动性减弱,并且表现出良好的凝胶化性能。

图8 不同质量浓度的银耳多糖凝胶Fig. 8 Photos of TPS gels at different concentrations
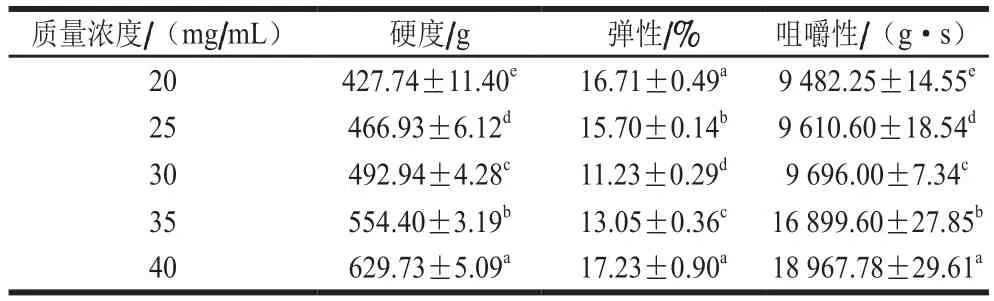
表5 不同质量浓度银耳多糖凝胶的质构特性Table 5 Textural characteristics of TPS gels at different concentrations
如表5所示,随着银耳多糖质量浓度的增加,凝胶的硬度和咀嚼性增加,弹性降低。然而,当银耳多糖质量浓度分别为35 mg/mL和40 mg/mL时,弹性增加至13.05%和17.23%。这些结果表明银耳多糖与系统中的水之间存在一定的协同作用。增加的银耳多糖在凝胶中产生填充效果,增强了这种协同作用。根据硬度和弹性值,银耳多糖可以开发成一些产品,如果冻和软糖。这意味着银耳多糖可以用作食品中部分胶体的替代品。
2.6 溶解性结果
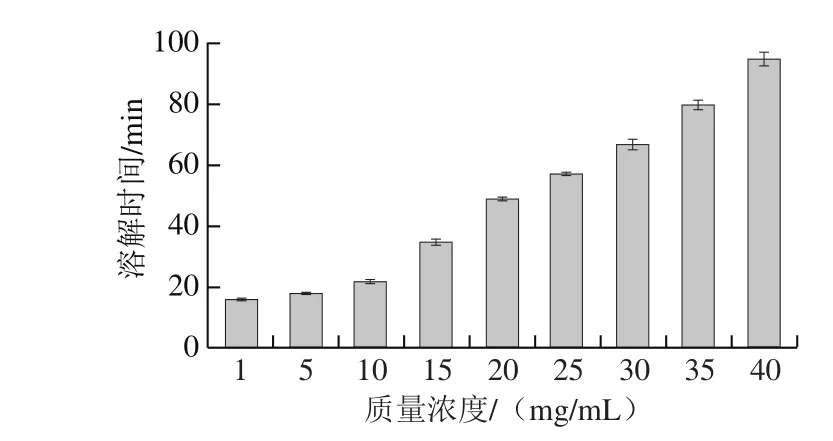
图9 60 ℃银耳多糖的溶解性Fig. 9 Solubility of TPS at 60 ℃
由图9可知,在60 ℃,银耳多糖的溶解性随质量浓度的增大而减小。在多糖溶液中,水与多糖的羟基形成大量的氢键,水化的多糖大分子形成环状、螺旋状或双螺旋结构,再通过分子的伸展及不同的点键合而构成三维网状结构并在一定质量浓度下形成凝胶[34]。通过对银耳多糖溶解性的研究,可为其在食品中产业化应用及开发提供科学依据。
3 结 论
采用微波辅助法提取银耳多糖,通过正交试验优化,得到实际最佳工艺条件为液料比50∶1(mL/g)、粒度120 目、微波功率400 W、微波时间2.0 h,此时多糖提取率达到(33.25±0.14)%。
通过傅里叶变换红外光谱和流变学研究表明,银耳多糖溶液是具有剪切稀化行为的假塑性流体。银耳多糖溶液的动态黏弹性行为表明,G’和G″都表现出对质量浓度,温度和tanδ的强烈依赖性,在低温和高频下可以形成弱凝胶结构。通过质构分析发现银耳多糖质量浓度显著影响其凝胶的硬度、弹性和咀嚼性。此外,银耳多糖质量浓度对其溶解性的影响较大,其溶解性随质量浓度的增加而降低。结果表明,银耳多糖具有良好的流变和凝胶特性,在食品加工中可提高产品的营养价值并减少食用胶的使用量,拓宽银耳多糖的应用范围,提升其经济价值,以期为我国新型食品的开发提供理论指导。

