茯砖茶中冠突散囊菌的分离鉴定及其在液态发酵中的应用
王 昕,张宇翔,任婷婷,赵倩囡,岳田利*,袁亚宏*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
茯砖茶属于一种发酵黑茶,至今已有几百年的历史,产销量一直占据黑茶市场的首位。冠突散囊菌(Eurotium cristatum)是茯砖茶在特定温度、湿度条件下,通过“发花”工艺长成的自然益生菌体,俗称“金花”,是茯砖茶发酵过程中的优势菌之一[1-3]。胡治远等[4]研究报道,“金花”菌是茯砖茶加工过程中发花阶段的主导微生物,对茯砖茶醇香、浓厚的风味及健康功效有重要贡献;胡谢馨等[5]研究表明“金花”菌对野葛、粉葛、葛渣固体发酵后总黄酮和葛根素含量的增加有很大贡献。冠突散囊菌发酵[6]可使茶的成分发生很大变化[7-11],产生大量氧化产物和水解产物以及有机酸等活性物质,使发酵茶具有降脂[12-15]减肥、改善人体消化道功能[16]、治疗心血管疾病[17-18]等保健功效[19-21]。有研究报道,一种从海藻中提取分离的内生真菌冠突散囊菌可产生蒽醌类化合物,从而使其具有止血、抗菌、泻下、利尿的作用[22];Salazar等[23]研究表明冠突散囊菌的次级代谢产物Compound 1具有抑制细胞生长的作用,在抗癌、抗肿瘤的应用上有很重要的参考价值;李佳莲等[24]研究发现冠突散囊菌发酵液对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌等有较强的抑制作用。
以往对冠突散囊菌的研究主要集中在茶叶固态发酵,发酵周期长、工艺难控制且原料要求高(多以黑毛茶为原料,一级鲜叶要求一芽二三叶,二级一芽三四叶,三级一芽四五叶,四级一芽五六叶或开面叶),而对冠突散囊菌的液态发酵研究较少且鲜见关于茶水浸提液灭菌处理影响主要理化指标的研究,为进一步缩短发酵周期[25],同时解决由于夏秋茶滋味苦涩品质差不能被有效开发利用的问题[26],本实验着重研究冠突散囊菌的分离鉴定、生长特性,以夏秋茶(平利山茶)浸提液为原料,分离得到的冠突散囊菌作为发酵菌种,进行液态发酵制备富含冠突散囊菌菌丝体的发酵黑茶产品。为进一步揭示冠突散囊菌在液态发酵中的调控机制提供理论支持,为冠突散囊菌液态发酵工业化生产提供可行性途径。
1 材料与方法
1.1 材料与试剂
手筑茯砖茶1 000 g,购自湖南益阳捷饮茶业有限公司;平利山茶(夏秋茶),2017年10月采自陕西省安康市平利县茶园。
没食子酸(分析纯,纯度98.5%)、谷氨酸(纯度>99%) 上海源叶生物科技有限公司;一水合茚三酮(纯度>97%) 北京奥科生物科技有限公司;福林-酚试剂(生化试剂,浓度1 mol/L) 上海荔达生物科技有限公司;Biospin真菌基因组DNA提取试剂盒 北京奥科生物科技有限公司。
1.2 仪器与设备
ZXSD-A1160恒温培养箱、ZWY-240恒温培养振荡器上海智诚分析仪器制造有限公司;SHB-Ш循环水式多用真空泵 郑州长城科工贸有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;CFX CONNCT聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc XR+凝胶成像仪 美国Bio-Rad公司;JY600C电泳仪 北京市六一仪器厂;DGX-9143BC电热恒温鼓风干燥箱 上海福玛实验设备有限公司;YT-CJ-2ND超净工作台 北京亚泰科隆仪器技术有限公司;S-3400N扫描电子显微镜 日本日立公司;Ni-U光学显微镜 日本尼康公司。
1.3 方法
1.3.1 培养基制作与茶样制备
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水定容至1 000 mL。称取去皮马铃薯200 g,切片加1 000 mL蒸馏水,煮沸10~20 min,用纱布过滤,补加蒸馏水至1 000 mL,121 ℃灭菌20 min。马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:马铃薯200 g,葡萄糖20 g,蒸馏水定容至1 000 mL,pH值自然[27]。
茶叶制备:将鲜叶经滚筒烘干制成干茶密封保存备用,按 GB/T 8302—2013《茶 取样》[28]的规定取样,并按GB/T 8303—2013《茶 磨碎试样的制备及其干物质含量测定》[29]的规定,制备试样。
1.3.2 冠突散囊菌的分离纯化
取样器具用75%乙醇溶液消毒,将实验手筑茯砖茶于超净工作台操作。五点取样法将每部分所取样品混匀,然后称取10 g茶样于盛有250 mL 0.85%无菌生理盐水的500 mL三角瓶中。28 ℃摇床洗脱2 h,洗脱茶样中的霉菌孢子。将洗脱得到的茶样原液梯度稀释至10-1、10-2、10-3、10-4、10-5,取各梯度洗脱液100~200 μL均匀涂布于PDA培养基上,每个梯度3 个平行。28 ℃恒温培养数天至长出菌落,挑取形态不同的单菌落于PDA培养基上划线纯化多次,直至得到单菌落,进行形态观察和斜面保存。
1.3.3 分子生物学鉴定
对PDA培养得到的单菌落,采用Biospin Fungus Genomic DNA Extraction Kit提取基因组DNA。采用真菌通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)、ITS4(5’-TCCTCCGCTTATTGATATGC-3’)对所选菌株进行PCR扩增。PCR扩增体系:20 μL的总反应体系中包含上下游引物各1 μL(5.94 nmol,稀释100 倍),2 μL模板DNA,10 μL premix Taq,加无菌水至20 μL。扩增条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,34 次循环,最后72 ℃延伸10 min。PCR产物经1.5%的琼脂糖凝胶电泳检测,紫外成像系统拍照,将单一透亮条带的PCR产物送生工生物工程(上海)股份有限公司测序。将测序得到的序列和GenBank中序列进行比对,确定相似度高的序列,得到目标菌株冠突散囊菌。采用Cluxtal-X对基因序列进行比对,并用MEGA6.0对相似序列构建系统发育树,确定其系统发育学地位。
1.3.4 生长特性分析
将斜面保存的冠突散囊菌于PDA培养基上活化1~2 次,用接种环挑取适量黄色闭囊壳于无菌生理盐水,振摇均匀,血球计数使得孢子悬浮液浓度为107CFU/mL。以2%接种量接种孢子悬浮液于PDB培养基中,28 ℃、120 r/min摇床培养8 d。每隔12 h取出三角瓶,将培养液过滤于滤纸上,100~105 ℃烘至质量恒定。以时间为横坐标,菌体干质量为纵坐标,绘制生长曲线。
1.3.5 形态学特征观察
取斜面保存的冠突散囊菌划线接种于PDA培养基,于28 ℃恒温培养箱培养,并进行菌落特征、显微形态及扫描电镜的形态学研究。
1.3.6 山茶浸提液制备
参考GB/T 8305—2013《茶 水浸出物测定》[30]和文献[31],平利山茶与蒸馏水比例为1∶25(g/mL),沸水浴浸提45 min,待浸提液冷却后离心取上清液,得到山茶浸提液。
1.3.7 孢子悬浮液制备
将斜面保存的HNYYWX.13冠突散囊菌于PDA培养基上活化1~2 次,用接种环挑取适量黄色闭囊壳于无菌生理盐水,振摇均匀,血球计数使得孢子悬浮液浓度为107CFU/mL,即得液态发酵所用孢子悬浮液。
1.3.8 冠突散囊菌的液态发酵
以2%接种量将冠突散囊菌的孢子悬浮液分别接种到100 ℃、15 min灭菌的山茶浸提液、不灭菌的山茶浸提液(均不添加蔗糖)和添加4%蔗糖的山茶浸提液、不添加4%蔗糖的山茶浸提液(均不灭菌)中,28 ℃、120 r/min摇床发酵。分别于0、12、24、36、48、60、72、84、96、108、120、132、144、156、168、180 h测定发酵液的茶多酚总量、氨基酸总量,探究灭菌处理及碳源对冠突散囊菌液态发酵的影响。
1.3.9 指标测定
参考GB/T 8313—2008《茶叶中茶多酚和儿茶素类含量的检测方法》[32]和GB/T 8314—2013《茶 游离氨基酸总量的测定》[33]的方法分别测定发酵液中的茶多酚总量和氨基酸总量,得到标准曲线,茶多酚总量标准曲线为:Y=0.008 7+0.012 31X,R2=0.999 06;氨基酸总量标准曲线为:Y=0.875 78X-7.241 38×10-4,R2=0.998 17。
1.4 数据分析
通过OriginPro 9.0作图,SPSS 20.0作统计学分析。
2 结果与分析
2.1 分子生物学鉴定
2.1.1 琼脂糖凝胶电泳

图1 茯砖茶部分优势菌种的PCR扩增产物电泳分析图Fig. 1 PCR amplification of fungal ITS from Fuzhuan tea
茯砖茶中所分离出的部分菌种的ITS序列扩增产物电泳分析见图1。3~13号泳道的条带分子质量约处于500~750 bp,且均呈现单一、明亮,表明此11 株菌的DNA纯度较高、无污染,可送去基因测序进一步鉴定。
2.1.2 基因测序

表1 湖南益阳茯砖茶测序结果Table 1 Results of sequencing of 33 strains in Fuzhuan tea from Yiyang, Hunan province
从表1可以看出,在湖南益阳茯砖茶中所分离的33 株菌中,编号分别为HNYYWX.1、HNYYWX.3、HNYYWX.5、HNYYWX.10、HNYYWX.17、HNYYWX.21、HNYYWX.22、HNYYWX.28的8 株菌经过在GenBank中BLAST比对后,与数据库中冠突散囊菌的模式菌株(JQ743649.1)相似度均达到99%,编号为HNYYWX.13的菌株相似度为100%,因此选择HNYYWX.13菌株进行冠突散囊菌的液态发酵研究。
2.1.3 系统发育树分析
从GenBank下载冠突散囊菌模式菌株或公认菌株的相应基因序列,以JQ743649.1(模式菌株)为参比,用MEGA 6.0软件采用Neighbor-Joining Tree法构建系统发育树。如图2所示,编号为HNYYWX.1、HNYYWX.3等21 株菌与模式菌株JQ743649.1优先聚集到一起,系统发育学分析表明其与模式菌株的亲缘关系非常接近;在此亲缘关系下,菌株HNYYWX.7和HNYYWX.27、HNYYWX.10和HNYYWX.18差异更小。系统发育学地位分析为研究相似菌株的差异性提供了很好的参考和指导。
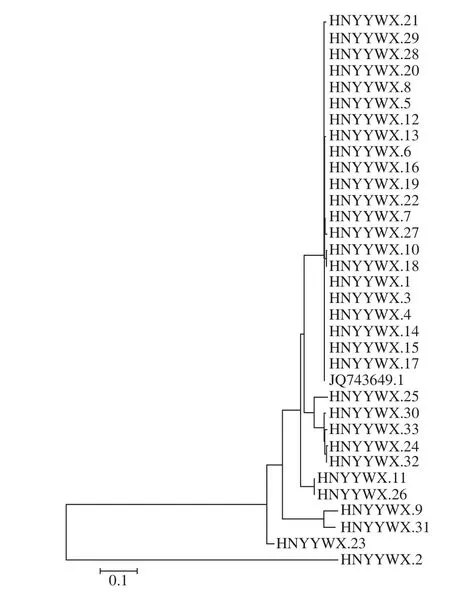
图2 茯砖茶分离株ITS序列系统发育树Fig. 2 NJ phylogenetic tree based on ITS sequences of fungi in Fuzhuan tea
2.2 冠突散囊菌生长曲线
如图3所示,培养0~12 h时,由于PDB培养基中营养丰富,冠突散囊菌很快适应生长环境,大量吸收培养基中的碳源等营养物质,促使无性孢子迅速萌发生长,使得前12 h菌丝体干质量增加近0.015 g/mL。随后继续培养12~132 h,期间菌体生长明显趋于平稳,呈缓慢增加的趋势。完全适应PDB生长环境的冠突散囊菌,经过前12 h菌体的大量繁殖,冠突散囊菌菌体干质量大大增加,使得PDB培养体系内菌体相对密度大大增加,菌体生长空间相对变小。培养到132~156 h时可见菌体生长速率大幅提升,并且156 h菌丝体干质量达到最大为0.058 g/mL,可知此阶段为冠突散囊菌活力最旺盛的时期。到168 h时,菌丝体干质量略微减少(0.002 g/mL),可能是由于菌丝体自溶造成[35]。
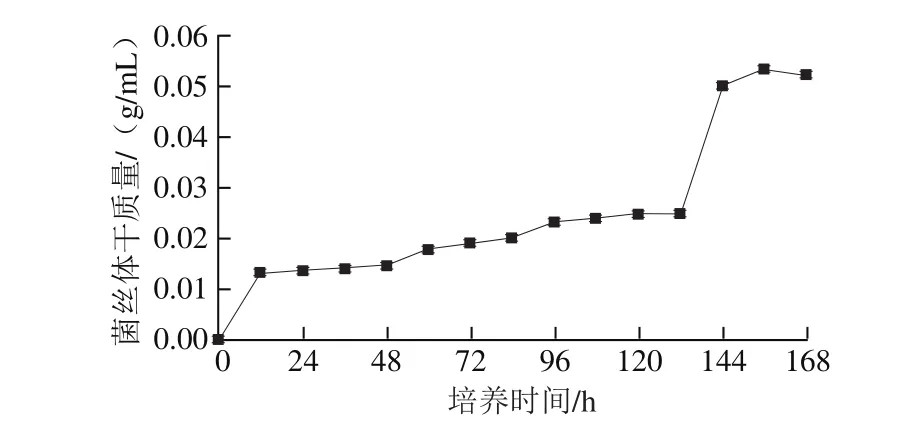
图3 HNYYWX.13冠突散囊菌培养过程中菌丝体干质量变化Fig. 3 Change in dry biomass yield of E. cristatum HNYYWX.13 during incubation
2.3 冠突散囊菌形态特征
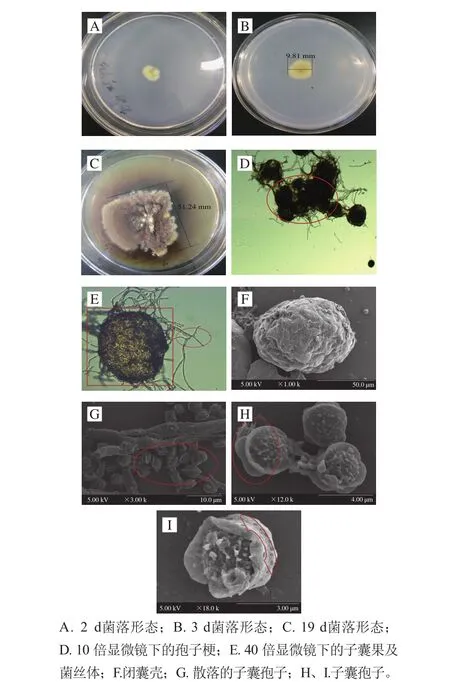
图4 HNYYWX.13冠突散囊菌的形态特征Fig. 4 Morphological characteristics of E. cristatum HNYYWX.13
将分离得到的冠突散囊菌接种到PDA琼脂培养基上28 ℃恒温培养,约48 h冠突散囊菌开始生长,首先长出白色菌丝体向外延伸,菌落中心逐渐由白色变为浅黄色,图4A为冠突散囊菌生长2 d的形态。图4B中,黄色闭囊壳产生在整个菌落区域内,菌落直径达到7~10 mm,呈淡黄色,第5天时菌落直径18~20 mm,菌落边缘呈淡黄色,中心凸起,越靠近菌落中心颜色依次变深呈黄色、深黄色,菌落中心颜色深至橄榄褐色或深褐色,并且菌落中心有少许黄色透明小液珠渗出。菌落生长7 d时,直径达到25~30 mm,菌落背部有大量色素渗出,扩散进入培养基,使培养基呈现深褐色。约12 d,能够很明显观察到菌落中心有干涩、凸起褶皱,菌落直径达40~45 mm。图4C为冠突散囊菌生长19 d形态,此时菌落直径达50~55 mm,基本不再变化,颜色全部呈现褐色,分泌出的色素使整个培养基呈黑褐色。
图4D中孢子梗簇拥,菌丝体交错(红色椭圆)。图4E观察到单个子囊果为椭球状(红色方框)及向外发散的菌丝体(红色椭圆)。
通过电镜观察,冠突散囊菌能产生大量闭囊壳(图4F),缠绕在菌丝中,呈球形或近球形,直径为750~950 μm。子囊球形或近球形,由拟薄壁组织包裹子囊孢子,随着子囊孢子的发育,拟薄壁组织逐渐溶解漏出球状体的子囊孢子,直径约26~32 μm,图4G为大量散落的子囊孢子。随着子囊孢子的进一步发育,如图4H、I所示,整个子囊孢子呈“双花”状,子囊孢子呈双凸透镜形,“赤道”(4I图中红色标记)部分具有两条明显的纵向鸡冠状“脊”,较薄,反卷,赤道沟较深。
2.4 冠突散囊菌的液态发酵
2.4.1 灭菌处理对发酵过程中主要理化指标的影响

图5 发酵过程中茶多酚总量的变化Fig. 5 Changes in tea polyphenol content during liquid-state fermentation
茶多酚是茶叶发酵过程中菌体生长的主要碳源,通过冠突散囊菌的代谢调控,可将茶叶中的茶多酚转化为小分子的功能性成分[11,34],如儿茶素、表儿茶素、表儿茶素没食子酸酯、茶黄素[35-36]、茯茶素等,使茶多酚总量减少,由图5可知,接种冠突散囊菌的发酵液中,茶多酚总量随着发酵时间的延长逐渐减少,对于浸提液直接发酵过程,茶多酚总量由15.09%减少到10.32%;浸提液灭菌后发酵,茶多酚总量由14.32%减少到11.64%。前者发酵过程,冠突散囊菌利用了更多的茶多酚,大大促进了新的代谢产物的生成。正如文献[37]通过冠突散囊菌调控,经过氧化、缩合等作用生成了更多种类的功能产物,如:茯茶素A和茯茶素B[38]、异戊二烯衍生物[39]、三萜烯类化合物[40]、7 种B环裂解儿茶素(黄烷-3-醇)衍生物[8]以及其他未解析清楚的未知化合物[41];许杰等[42]研究表明冠突散囊菌发酵过程中,表儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯氧化缩合形成茶黄素,茶黄素进一步氧化、与氨基酸、蛋白质等缩合成形成茶红素等功能性成分。配对t检验分析表明,灭菌后发酵与直接发酵,茶多酚总量存在极显著差异(P=0.002<0.01)。此外,灭菌处理前,发酵液中茶多酚总量为15.09%,而灭菌处理后茶多酚总量减少为14.32%,说明灭菌处理会破坏大量的茶多酚,对茶叶自身营养有很大损失;发酵过程中,浸提液直接发酵转化近5%的茶多酚,而灭菌处理后发酵仅转化约3%的茶多酚,表明浸提液直接接种冠突散囊菌发酵,可产生更多具有生物活性的小分子物质,更有利于丰富发酵茶汤的品质。
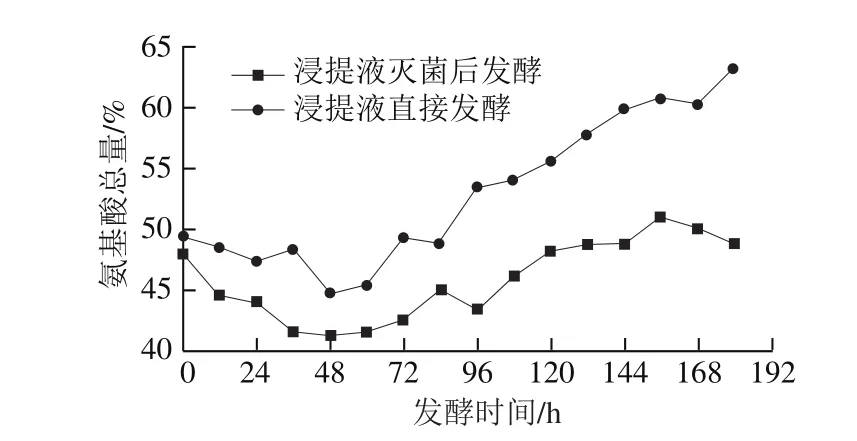
图6 发酵过程中氨基酸总量的变化Fig. 6 Changes in amino acid content during liquid-state fermentation
由图6可知,接种冠突散囊菌发酵后,发酵液中氨基酸总量呈上升趋势,说明冠突散囊菌的代谢产生了大量氨基酸。研究[25]报道,接种冠突散囊菌发酵后,发酵液中会产生多种丰富的氨基酸,如人体必需氨基酸:赖氨酸、色氨酸、苯丙氨酸、甲硫氨酸、缬氨酸、苏氨酸、亮氨酸和异亮氨酸等。发酵前约48 h,冠突散囊菌逐渐适应生长环境。随后,菌体生长比较稳定,开始代谢产生各种氨基酸。显然,浸提液直接发酵所得发酵液中氨基酸总量较灭菌处理更高。配对t检验分析表明,灭菌后发酵与直接发酵,氨基酸总量存在极显著差异(P=0.000<0.01)。因此不灭菌处理比传统灭菌处理发酵效果更好。
2.4.2 碳源对发酵过程中主要理化指标的影响
由图7、8可知,两种处理方式下,发酵液中茶多酚总量降低,氨基酸总量升高,其中发酵前期氨基酸总量升高可能是由于冠突散囊菌的调控代谢生成,发酵后期可能由于冠突散囊菌菌丝体自溶释放氨基酸到发酵液中[16]。添加碳源后发酵,48~108 h茶多酚减少速率明显快于不添加碳源,正如文献报道,蔗糖诱导冠突散囊菌“发花”[14],其生长繁殖速度大大加快,利用发酵液中大量的茶多酚,将其转化为小分子功能性成分,大大发挥冠突散囊菌代谢产物的生物活性功能(图7),所以添加碳源有利于茶多酚转化;如图8所示,两种处理方式下,发酵过程中氨基酸总量均呈上升趋势且氨基酸生成量基本一样,所以碳源对冠突散囊菌发酵过程中氨基酸总量影响不大。配对t检验分析表明,添加碳源与未添加碳源发酵过程中,茶多酚总量和氨基酸总量均存在极显著差异(P=0.000<0.01)。综合两种指标,添加碳源更有利于冠突散囊菌的液态发酵。

图7 碳源作用下发酵过程中茶多酚总量的变化Fig. 7 Changes in tea polyphenol content during fermentation with and without addition of carbon source
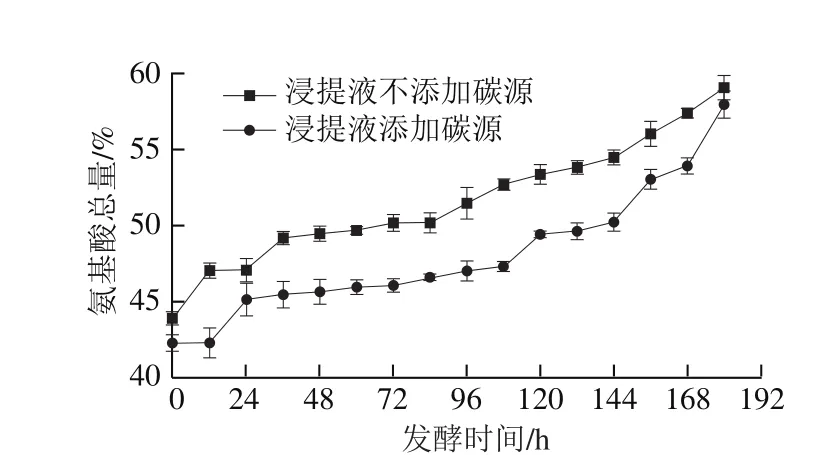
图8 碳源作用下发酵液中氨基酸总量的变化Fig. 8 Changes in amino acids during fermentation with and without addition of carbon source
3 结 论
以湖南益阳手筑茯砖茶为研究对象,通过分离纯化、PCR、基因测序的手段鉴定得到8 株序列相似度为99%的冠突散囊菌,1 株编号为HNYYWX.13序列相似度为100%的冠突散囊菌;对菌株HNYYWX.13进行菌落形态、显微形态及扫描电子显微镜形态观察,并探究得到其生长曲线,培养到132~156 h时菌体生长速率大幅提升,156 h菌丝体干质量达到最大为0.058 g/mL,此阶段为冠突散囊菌活力最旺盛的时期;选取菌株HNYYWX.13制备孢子悬浮液接种于平利山茶(夏秋茶)浸提液中液态发酵,研究了灭菌处理、添加碳源对冠突散囊菌发酵下茶多酚总量及氨基酸总量的影响,得出结论:添加碳源、不进行灭菌处理更有利于冠突散囊菌的液态发酵。
本研究探索了冠突散囊菌在平利山茶液态发酵中的应用潜力,避免其固态发酵过程中条件不易控制、不宜规模化生产的缺陷,利用我国浪费最严重的夏秋茶,大大提高了茶资源利用率,并且提出传统茶水浸提液灭菌后发酵的误区,指出不进行灭菌处理更有利于冠突散囊菌的液态发酵,为其工业化生产及茶产品的深加工技术提供了可行性路径。但是关于冠突散囊菌在液态发酵中代谢机制还需进一步研究,这对于深入揭示冠突散囊菌多种保健功效具有重要意义。

