蜂蜜接合酵母对营养物质利用及其高糖胁迫应激代谢特性分析
刘功良,费永涛*,余洁瑜,刘 锐,高苏娟,白卫东
(仲恺农业工程学院轻工食品学院,广东 广州 510225)
随着乙醇浓醪发酵技术的进步,对以酿酒酵母为主体的代谢过程和基本代谢途径已有较多报道,但由于它的代谢过程极为复杂,代谢产物较多,对其在高糖环境下的代谢特性与应答机理尚有待进一步研究。彭郦等[1]研究发现酿酒酵母AWRI R2在高糖条件下仍可以积累海藻糖,海藻糖积累量是酿酒酵母应对高糖逆境的指标之一,同时温度会影响海藻糖的产生。此外,Wang Pinmei等[2]研究发现重组酵母通过积累胞内海藻糖的方式保护细胞,通过调控重组酵母在高渗条件下细胞的完整性、过氧化氢酶和超氧化物歧化酶的酶活性提高酵母在浓醪中的发酵能力。除海藻糖外,李晓军等[3]研究指数生长期的酿酒酵母FCC2146在高渗胁迫下的应激代谢反应,发现甘油作为酿酒酵母FCC2146的主要相容性溶质也是酵母应对高糖逆境的指示物质,在300 g/L高糖环境下,胞外乙醇、甘油、海藻糖分别较对照环境(糖100 g/L)提高100%、400%和11%。同样,Abertny等[4]也认为酿酒酵母细胞可以通过主动调节甘油的浓度适应高糖环境。董欣福等[5]发现酿酒酵母在高糖培养环境中,有氧呼吸抑制,三羧酸循环(tricarboxylic acid cycle,TCA)断裂,导致发酵初期柠檬酸和苹果酸分泌到胞外,同时菌体中乳酸也不断积累,而当糖浓度降低时,TCA循环重新闭合,柠檬酸、α-酮戊二酸和苹果酸重新进入细胞参与代谢。酵母不仅可以通过改变代谢流来适应高糖环境,徐伟等[6]发现酿酒酵母YMI-37还可以通过改变自身形态提高细胞质浓度来应对高渗环境。在前期研究中,利用26S rDNA分子鉴定技术将分离自蜂蜜的酵母鉴定为蜂蜜接合酵母,发现该菌能够耐受700 g/L高糖质量浓度[7],而目前开展酵母耐受高糖特性研究所用糖质量浓度均在300~650 g/L范围内[8]。因此,本研究以已筛选的蜂蜜接合酵母6-7431为实验菌,研究其高糖胁迫应激代谢特性,为乙醇浓醪发酵和酵母耐高糖机制研究提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
葡萄酒高活性干酵母SY 湖北安琪酵母有限公司;蜂蜜接合酵母(Zygosaccharomyces mellis)7-7142、7-7352、6-7431、7-7551、7-7651、7-7751,由仲恺农业工程学院轻工食品学院生物工程试验室分离筛选得到,其中蜂蜜接合酵母6-7431保藏于中国典型培养物保藏中心,保藏编号为CCTCC M 2015545。
1.1.2 试剂
半乳糖、阿拉伯糖、麦芽糖、木糖、麦芽三糖、甘油 阿拉丁生化科技股份有限公司;酵母膏、琼脂、麦芽汁培养基、蛋白胨、酵母提取粉、KH2PO4、MgSO4·7H2O 广东环凯微生物科技有限公司;其余为分析纯或生化试剂。
1.1.3 培养基
高糖培养基:称取葡萄糖加入麦芽汁培养基中,溶于去离子水,调整糖质量浓度为300、350、400、450、500、550、600、650、700 g/L和750 g/L,70 ℃水浴摇匀溶解,115 ℃灭菌20 min。其中常规培养基的含糖质量浓度为100 g/L。
糖类发酵培养基:蛋白胨2 g/L,NaCl 0.5 g/L,溶于去离子水,121 ℃灭菌15 min。
同化碳源基础培养基:(NH4)2SO40.5 g/L,KH2PO40.1 g/L,MgSO4·7H2O 0.05 g/L,酵母膏0.02 g/L,琼脂 2.0 g/L,pH 5~6,115 ℃灭菌15 min,冷却至70 ℃后,倒平板备用。
同化氮源基础培养基:葡萄糖2.0 g/L KH2PO40.1 g/L,MgSO4·7H2O 0.05 g/L,酵母膏0.02 g/L,琼脂2.0 g/L,pH 5~6,115 ℃灭菌15 min,冷却至70 ℃后,倒平板备用。
完全培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,琼脂20 g/L,115 ℃灭菌15 min,冷却至70 ℃后,倒平板备用。
无维生素生长培养基:葡萄糖20 g/L,(NH4)2SO42.0 g/L,MgSO4·7H2O 1.0 g/L,CaCl2·2H2O 0.1 g/L,KH2PO42.5 g/L,NaCl 0.1 g/L,115 ℃灭菌15 min,冷却至70 ℃后,倒平板备用。
1.2 仪器与设备
Phenom-World飞纳台式扫描电镜 复纳科学仪器上海有限公司;UV-2700紫外-可见分光光度计、LC-20A高效液相色谱仪 日本岛津公司。
1.3 方法
1.3.1 蜂蜜接合酵母的活化
取出保存在4 ℃冰箱里的酵母菌试管斜面,用接种环挑取两环菌种,接种于100 g/L常规糖质量浓度培养基,在28 ℃条件下恒温培养48 h。
1.3.2 蜂蜜接合酵母的同化性能鉴定
挑取在低温试管斜面保藏的菌体,接种到含糖量为70 °Bé的麦芽汁试管斜面,28 ℃培养3~4 d,转接到麦芽汁液体培养基中,28 ℃培养至对数生长期,用无菌水对菌体进行清洗,制备菌悬液。
糖类发酵实验:采用杜氏管发酵法测定6 株菌对糖类物质的代谢能力[9]。将菌体重悬液按照5%接种量(V/V,下同)接入糖质量浓度为30 °Bé的杜氏小管培养基中,在28 ℃培养3~4 d,观察6 株蜂蜜接合酵母对葡萄糖、果糖、木糖、蔗糖、半乳糖、乳糖、麦芽糖的发酵能力。
碳、氮源同化性能鉴定:采用生长谱法[10-11]测定6 株酵母对果糖、木糖、麦芽三糖、阿拉伯糖、半乳糖、麦芽糖、甘油等碳源的同化能力,各种碳源在培养基中质量浓度为40 g/L;采用生长谱法鉴定6 株酵母对酵母粉、蛋白胨、尿素、硫酸铵、硝酸钾、磷酸三铵、乙酸铵等氮源的同化能力,各种氮源在培养基中质量浓度为40 g/L。
无维生素培养基上菌种的生长性能鉴定[12]:将6 株酵母的重悬液按照5%接种量接入无维生素培养基,28 ℃培养3~5 d,每隔24 h观察培养皿中是否有菌落生长,以完全培养基作对照,设置3 组平行实验。
1.3.3 高糖胁迫对蜂蜜接合酵母生理形态的影响
取活化后的蜂蜜接合酵母6-7431,以10%接种量接入高糖质量浓度培养基中,28 ℃恒温培养96 h后,通过电子扫描显微镜观察蜂蜜接合酵母的形态特征[13-14]。
1.3.4 高糖胁迫对蜂蜜接合酵母应急代谢产物的影响
取活化后的蜂蜜接合酵母6-7431,以10%接种量接入高糖质量浓度培养基中,初始pH 6.0,30 ℃发酵96 h后,用比重法测发酵液的乙醇体积分数[15]。采用高效液相色谱法对酵母菌6-7431三羧酸循环中间代谢产物苹果酸、α-酮戊二酸、柠檬酸进行分析[16-17]。以峰面积为y,有机酸含量(μg)为x,绘制检测标准曲线,苹果酸、α-酮戊二酸、柠檬酸的回归方程分别为:y=6 718.8x+434.1(R2=1),y=287 820x-39 189(R2=0.999 9),y=46 355x+5 098.5(R2=0.999 8)。此外,用高碘酸钠-乙酰丙酮法测定酵母细胞中甘油的浓度[18],采用硫酸蒽酮法测定酵母细胞内海藻糖含量[19-20],每个指标重复检测3 次。
1.4 数据分析
利用SPSS 17.0和Origin 8.0软件分别统计分析数据和绘图。基于Duncan法多重比较检验,P<0.05,差异显著。
2 结果与分析
2.1 蜂蜜接合酵母的同化性能鉴定
碳源同化性能鉴定结果表明6 株蜂蜜接合酵母都能利用葡萄糖、果糖、麦芽糖,无法利用乳糖、木糖、阿拉伯糖、麦芽三糖,其中菌株6-7431、7-7651、7-7751能利用半乳糖和蔗糖进行糖类发酵,菌株6-7431、7-7142能利用甘油、半乳糖、麦芽糖等4 种碳源。氮源同化性能鉴定结果显示6 株菌都能同化蛋白胨和酵母提取粉,但无法同化乙酸铵和磷酸三铵,其中菌株6-7431、7-7751能够利用硫酸铵作为氮源,7-7352、6-7431、7-7651可以同化尿素。此外,菌株6-7431、7-7551、7-7651都能在无维生素培养基生长。蜂蜜接合酵母6-7431不仅能利用葡萄糖、果糖、麦芽糖、蔗糖、半乳糖、甘油6 种碳源,还能利用尿素、硫酸铵、蛋白胨、酵母提取粉4 种氮源。综上所述,菌株6-7431利用碳源较广泛,且无需专门提供维生素,前期研究发现蜂蜜接合酵母6-7431能够耐受700 g/L的高糖质量浓度[7],该菌具有很好的应用潜力。因此,选择对菌株6-7431进行高糖胁迫应激代谢特性的研究。
2.2 高糖环境对蜂蜜接合酵母6-7431形态及生殖方式的影响
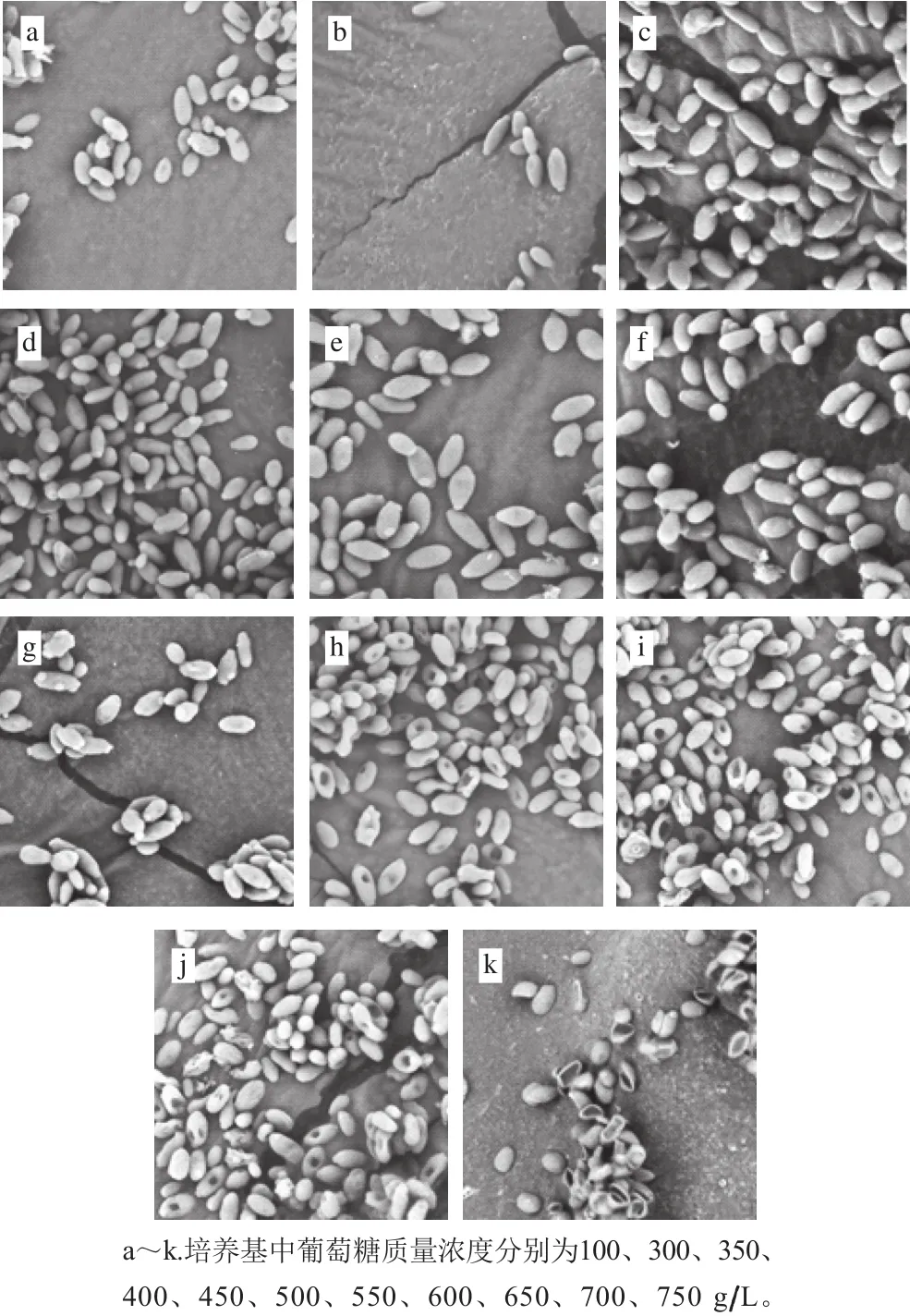
图1 不同糖质量浓度环境下蜂蜜接合酵母6-7431的菌体形态Fig. 1 Morphology of Z. mellis 6-7431 cultured at different sugar concentrations
酵母菌的生殖方式主要以无性繁殖中的芽殖为主,尤其是在良好的营养与生长条件下[21]。由图1可知,随着糖质量浓度从100 g/L增加到550 g/L,细胞外部的渗透压变大,蜂蜜接合酵母6-7431细胞的生殖方式基本未发生变化,一直保持出芽生殖(图1b~g),同时细胞的形态未发生显著的变化。随着糖质量浓度达到550 g/L时,菌丝内胞浆浓缩、胞壁增厚,酵母的出芽生殖已经停止,但是菌体完整性较好,仍然具有较好的代谢基质及产乙醇的能力;质量浓度从600~700 g/L,酵母菌菌体中部开始凹陷,随着质量浓度的增加,凹陷菌体的比例越来越高,但仍然具有一定的代谢活性;当质量浓度达到750 g/L,菌体严重变形,没有完整的菌体形态,代谢能力完全被抑制。高糖环境对蜂蜜接合酵母6-7431的形态和生殖具有一定的影响,但该菌株在700 g/L的高糖质量浓度下仍能够保持一定的代谢活性,表明该菌存在应对高渗环境的生理性防御机制。研究也发现酵母菌中存在大量应对高糖环境的保护机制,如高渗压甘油应答途径、高渗压转录因子等[22-24]。因此,后续将会对该菌在高糖环境中生理性防御机制进行探究。
2.3 高糖质量浓度对蜂蜜接合酵母6-7431分泌乙醇的影响
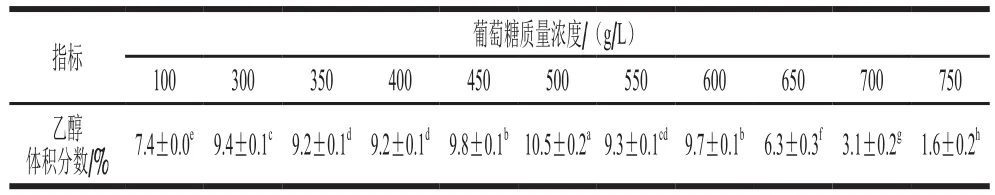
表1 葡萄糖质量浓度对蜂蜜接合酵母6-7431产乙醇的影响Table 1 Effects of different glucose concentrations on ethanol production of Z. mellis 6-7431
表1显示,不同糖质量浓度下该菌发酵产生的乙醇体积分数具有显著差异(P<0.05)。糖质量浓度100~500 g/L,发酵液中乙醇体积分数从7.4%增加10.5%。当糖质量浓度为550~750 g/L时,乙醇从9.3%下降到1.6%。糖质量浓度在300~600 g/L的乙醇体积分数都要高于常规糖质量浓度100 g/L。目前开展酵母耐受高糖特性研究所用到的糖质量浓度均在300~650 g/L范围内[8],而酵母6-7431在糖质量浓度650~700 g/L环境下仍然能够保持菌体的完整并能够代谢糖分泌乙醇,在乙醇浓醪发酵中具有潜在的应用价值。
2.4 高糖胁迫对蜂蜜接合酵母积累应急代谢产物的影响
2.4.1 高糖胁迫对蜂蜜接合酵母积累甘油的影响

图2 初始糖质量浓度对蜂蜜接合酵母6-7431积累甘油的影响Fig. 2 Effects of different initial sugar levels on the accumulation of glycerol in Z. mellis 6-7431
在接种量为10%初始pH 6.0、30 ℃条件下发酵96 h,蜂蜜接合酵母6-7431经高糖胁迫积累的总甘油质量浓度比常规培养基(100 g/L)中显著提高(P<0.05),其中胞内和胞外的甘油质量浓度都比常规培养基中的甘油质量浓度高,如图2所示。当糖质量浓度从300 g/L增加到600 g/L时,胞内甘油质量浓度和总甘油质量浓度显著提高(P<0.05)。当糖质量浓度达到600 g/L时,胞外甘油质量浓度和总甘油质量浓度达到最高,分别为4 781 mg/L和22 918 mg/L,远超过常规培养(分别为1 845 mg/L和4 613 mg/L)。随着糖质量浓度从600 g/L增加到750 g/L时,胞内甘油质量浓度和总甘油质量浓度显著降低(P<0.05)。此外,在不同的糖质量浓度环境中,蜂蜜接合酵母胞内外甘油质量浓度的变化趋势基本一致,但胞内甘油质量浓度始终高于胞外。在面对高糖环境时,酿酒酵母甘油的分泌量也会增加,主要是由于在高糖环境中菌体会上调甘油合成基因的表达[25],蜂蜜接合酵母6-7431也可能利用同样的机制应对高糖环境,甘油可作为该菌株应对高糖逆境的指示物质。
2.4.2 高糖胁迫对蜂蜜接合酵母积累海藻糖的影响
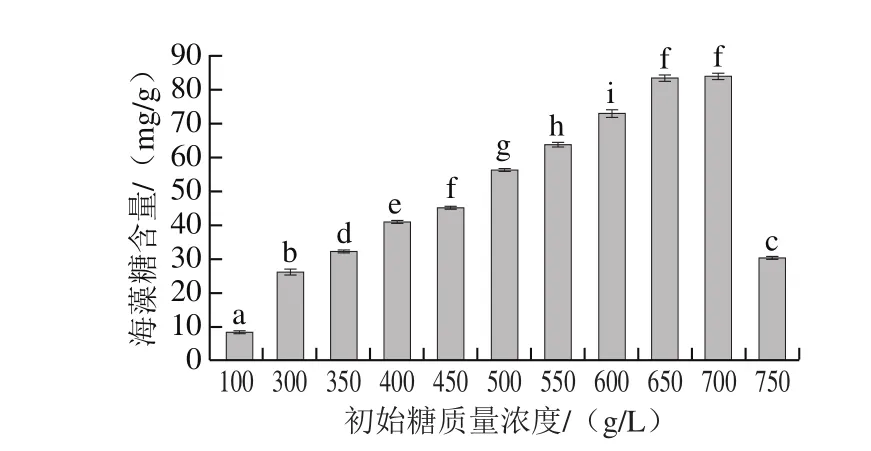
图3 初始糖质量浓度对蜂蜜接合酵母6-7431积累海藻糖的影响Fig. 3 Effects of different initial sugar levels on the accumulation of trehalose in Z. mellis 6-7431
在相同的培养条件下,蜂蜜接合酵母6-7431经高糖胁迫积累的胞内海藻糖质量浓度比常规培养基显著增加(P<0.05),结果如图3所示。糖质量浓度在300~650 g/L范围内,胞内海藻糖含量与培养基中的糖质量浓度呈正比,蜂蜜接合酵母6-7431积累海藻糖的变化趋势与前期报道关于酿酒酵母积累海藻糖的趋势较为类似,可能都是由于海藻糖合成基因的表达量增加所致[25]。当糖质量浓度为650 g/L和700 g/L时,胞内海藻糖含量达到最高83.649 mg/g,同时在两个不同糖质量浓度下胞内海藻糖含量无显著变化,而当糖质量浓度达到750 g/L时,胞内海藻糖含量显著降低,这主要是由于渗透压过高,导致细胞形态严重皱缩(图1),胞内代谢被抑制。本研究显示海藻糖作为蜂蜜接合酵母6-7431的渗透压调节剂之一,在不超过700 g/L糖质量浓度的环境中可以发挥作用。
2.4.3 高糖胁迫对蜂蜜接合酵母TCA中间代谢产物的影响
蜂蜜接合酵母6-7431在高糖胁迫下,由于培养基中存在氧气,在酵母菌TCA循环代谢中会积累苹果酸。由图4可知,在接种量为10%、初始pH 6.0、30 ℃条件下发酵96 h,蜂蜜接合酵母6-7431在初始糖质量浓度300~700 g/L范围内,培养基中积累苹果酸含量比常规培养基增加显著(P<0.05)。糖质量浓度为300~650 g/L时,苹果酸含量与培养基中的糖质量浓度呈正比,有显著上升趋势,糖质量浓度为650 g/L时,苹果酸质量浓度最高达到371.53mg/L,远超过常规培养(142.13 mg/L)。当糖质量浓度增加到650~750 g/L时,蜂蜜接合酵母逐渐无法适应高糖、高渗环境,TCA循环的代谢强度进一步降低,苹果酸含量显著下降(P<0.05)。但是糖质量浓度升至750 g/L时,蜂蜜接合酵母中积累苹果酸含量甚至比常规培养还低,此时高渗环境已经破坏了该菌的正常代谢功能。
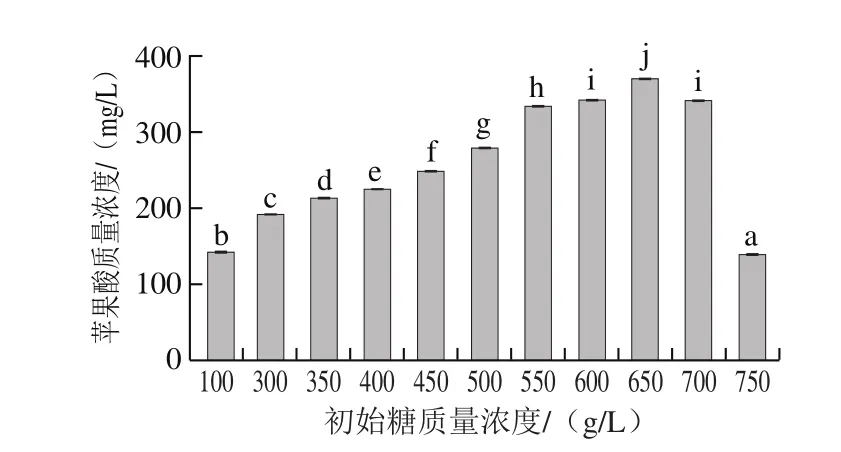
图4 初始糖质量浓度对蜂蜜接合酵母6-7431积累苹果酸的影响Fig. 4 Effects of different initial sugar levels on the accumulation of malic acid in Z. mellis 6-7431
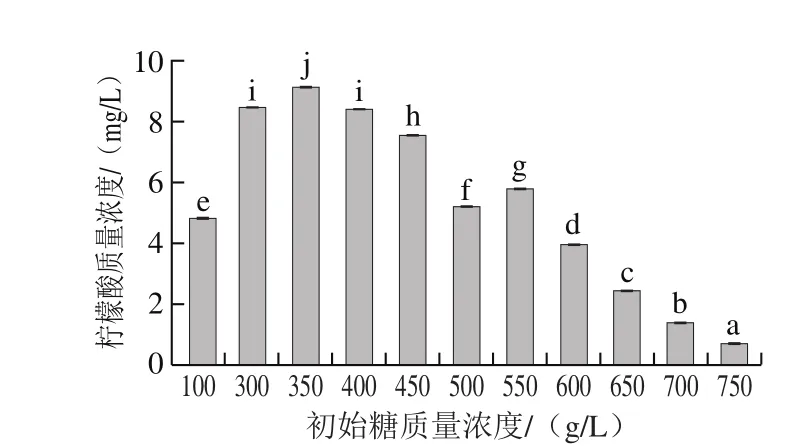
图5 初始糖质量浓度对蜂蜜接合酵母6-7431积累柠檬酸的影响Fig. 5 Effects of different initial sugar levels on the accumulation of citric acid in Z. mellis 6-7431
蜂蜜接合酵母6-7431在高糖胁迫下,也会在胞内积累柠檬酸,但由于高浓度苹果酸的反馈抑制作用[26],柠檬酸积累量较低。由图5可知,在初始糖质量浓度300~550 g/L、接种量10%、初始pH 6.0、30 ℃条件下发酵96 h,蜂蜜接合酵母6-7431积累的柠檬酸质量浓度比常规培养显著升高(P<0.05),在糖质量浓度为350 g/L时,柠檬酸积累量达到最大9.14 mg/L。糖质量浓度在350~750 g/L范围内,蜂蜜接合酵母胞内柠檬酸质量浓度逐渐降低,主要由苹果酸的反馈抑制作用和高渗环境导致。同样,在高糖环境下,蜂蜜接合酵母6-7431在胞内积累的α-酮戊二酸也具有苹果酸类似的变化趋势。前期大量的转录组学研究发现酵母菌在高糖环境中会增加糖酵解和磷酸戊糖途径中酶基因的表达量[27],同样蛋白组学的研究也发现高糖环境会促使酵母菌中参与糖酵解和磷酸戊糖途径的酶蛋白量增加[28],这样会促使更多的乙酰辅酶A进入到TCA中,研究发现酿酒酵母在高糖培养环境中,有氧呼吸抑制,TCA断裂,导致TCA中间产物如α-酮戊二酸和苹果酸不断积累[5],与本研究结果一致。
3 结 论
在6 株蜂蜜接合酵母中,发现蜂蜜接合酵母6-7431对营养物质的代谢能力强于其他菌株,具有较好应用潜力。对该菌株在高糖胁迫下的细胞形态、繁殖方式和应激代谢产物的研究发现,菌株6-7431在300~550 g/L的高糖环境中能正常出芽生殖,其代谢产生的乙醇、甘油、海藻糖、有机酸等物质含量都远高于常规培养基的含糖环境;在550~700 g/L高糖环境中,菌株6-7431的繁殖方式由出芽生殖逐渐被抑制,代谢活动也有所减弱,分泌产生的乙醇、甘油、海藻糖、有机酸等物质含量降低;在750 g/L高糖环境中,菌株6-7431严重失水,基本停止发酵活动。本研究不仅探究了高糖环境对蜂蜜接合酵母细胞形态、繁殖方式的影响,还发现高糖环境对TCA代谢中间产物具有重要的影响,本研究对酵母的高糖耐受机制以及酵母在乙醇浓醪发酵的研究具有重要的参考价值,但在产生应激反应的分子机制方面需要进一步挖掘。

