luxS基因对盐胁迫下植物乳杆菌生长及细菌素合成的影响
孙思睿,万 峰,赵鹏昊,侯雨佳,范小飘,梁 玉,孟祥晨*
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
植物乳杆菌(Lactobacillus plantarum)是乳酸杆菌的一种,常用作益生菌,广泛存在于谷物、乳肉制品、果蔬制品及发酵饮料中,也常用于生产某些发酵产品,是一种重要的工业微生物。在食品生产中乳酸菌会面临多种环境胁迫,如加工过程中的高压胁迫[1]、发酵过程中的酸胁迫[2]以及贮藏过程中的冷胁迫[3]等,其中盐胁迫也逐渐引起人们的关注。食盐是泡菜、酱制品、发酵肉制品及干酪等发酵制品中必不可少的添加物,主要作用是调味和延长贮存期;然而一定浓度盐会增加环境渗透压,易使乳酸菌细胞失水,细胞质浓缩,会在一定程度上影响其正常生理功能。因此,乳酸菌对盐的耐受性在一定程度上会影响其发酵特性,对生产意义重大。
群体感应(quorum sensing,QS)是乳酸菌与外界环境进行信息交流的重要调控系统,通常由信号分子和双组分调节系统(包括组氨酸蛋白激酶和相应调节因子)两部分组成。AI-2是一类重要的信号分子,可以进行细菌间的沟通,其中LuxS蛋白酶是AI-2合成的关键酶,因此其编码基因luxS在QS系统中具有重要作用[4]。当信号分子的浓度达到一定阈值后,便会激活特定基因的表达,以调控某个单个细菌无法完成的生理功能[5],如生物发光[6]、生物膜形成[7]、细菌素的合成[8]、耐受性[9]及黏附性[10]等。luxS介导的QS过程已被证明可以调节基因表达[11],且该基因序列高度保守,当前研究发现luxS基因与耐酸能力有很大关系,但对细菌素合成及盐耐受性的影响知之甚少。
L. plantarum KLDS1.0391是从传统发酵乳制品中分离得到的1 株生理特性良好的产细菌素菌株,由全基因组信息得知[12],该菌具有多种与胁迫相关的蛋白,包含5 个胆盐胁迫相关基因、13 个温度胁迫相关基因以及4 个渗透压胁迫相关基因等。前期研究结果证实该菌含有luxS基因[13];并已发现:QS可调节该菌与其他细菌共培养时细菌素的合成[13],但还不清楚该菌盐胁迫耐受性是否受QS系统调节。
本研究通过测定野生株和luxS基因缺失突变株在不同浓度盐胁迫下的生长及细菌素合成情况,探究luxS基因在L. plantarum KLDS1.0391应对NaCl胁迫时的作用,从而揭示在NaCl胁迫时L. plantarum中QS系统对该菌株生长及代谢的调控作用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
L. plantarum KLDS1.0391野生株及luxS基因缺失突变株均保藏于东北农业大学乳品科学教育部重点实验室;枯草芽孢杆菌(Bacillus subtilis)ATCC6633 中国食品药品检定研究院。
1.1.2 培养基与试剂
MRS培养基及营养肉汤培养基配制方法参照文献[14-15]。
氯霉素(chloramphenicol,CAP)、溶菌酶 美国Amresco公司;PrimerScript®RT Reagent Kit with gDNA Eraser反转录试剂盒、SYBR®Premix Ex TaqTM实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、DL5000 DNA Marker 宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒、细菌总RNA提取试剂盒、dNTPs、TaqDNA聚合酶 天根生化科技有限公司;琼脂糖、过氧化氢酶 美国Sigma公司;其余试剂均为国产分析纯或生化纯。
1.2 仪器与设备
DK-8D型电热恒温水槽 上海一恒科技有限公司;0.22 μm微孔滤膜 美国Bio-Rad公司;GL-21M高速冷冻离心机 上海市离心机械研究所;DYY-10C型电泳仪北京市六一仪器厂;凝胶成像系统 美国UVP公司;ZHWY200B型全温度恒温培养摇床 上海智城分析仪器制造有限公司;HVE-8D型全自动高压灭菌锅 日本HIRAYAMA公司;9700 PCR扩增仪 美国Applied Biosystem公司;Step One PlusTM实时荧光定量PCR仪 美国Thermo Fisher公司;LGJ-1冷冻干燥机 上海医用分析仪器厂;Delta320 pH计 瑞士梅特勒-托利多有限公司;UV-2401PC型紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 luxS基因缺失突变株的构建与扩培
参照文献[16],并对构建成功的突变株进行氯霉素抗性平板及PCR扩增验证。反应条件:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火45 s,72 ℃延伸210 s,33 个循环后72 ℃延伸10 min,4 ℃保存。分别将L. plantarum KLDS1.0391野生株及luxS基因缺失突变株于MRS及含氯霉素的MRS培养基中37 ℃活化3 代,进行之后实验。
1.3.2 盐耐受能力比较
将活化后的野生株和突变株过夜培养,分别取10 mL菌液在4 ℃、8 000 r/min离心10 min,收集菌体,经磷酸盐缓冲液(pH 7.2)洗涤2 次后等体积重悬于含0%、2%、3%、4%、6%以及8% NaCl的磷酸盐缓冲液中,于37 ℃孵育24 h,分别测定在孵育0、8、16 h和24 h时2 株菌的活菌数,并按下式计算存活率:
1.3.3 生长性能比较
分别将野生株和突变株以2%的接种量接种于含0%、2%、3%、4%和6% NaCl的MRS培养基中,37 ℃培养36 h,每隔4 h取样,在波长600 nm处测定OD值,并绘制生长曲线。
1.3.4 产细菌素能力比较
在1.3.3节取样间隔,每个样品取10 mL菌液,12 000 r/min离心15 min收集无细胞发酵上清液,按参考文献[17]采用双层平板打孔法测定抑菌活性,以B. subtilis作为上层指示菌,打孔后上样量为100 μL。
1.3.5 部分基因表达的比较
1.3.5.1 PCR引物设计与合成
以16S rDNA作为内参基因,目的基因为细菌素结构基因plnEF以及QS调节基因plnD和plNC8HK。引物设计见表1[18]。
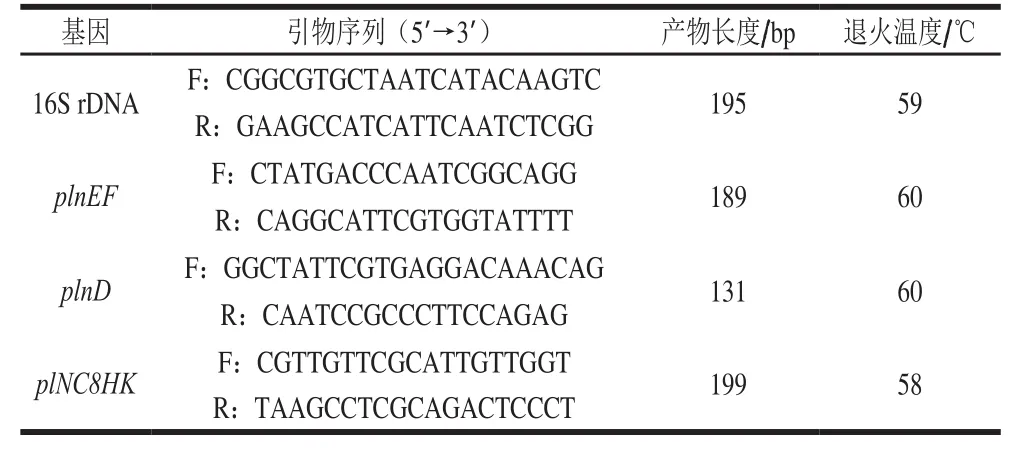
表1 实时荧光定量PCR引物Table 1 Primer sequences used for real-time quantitative PCR
1.3.5.2 总RNA提取
分别将野生株与突变株在含0%、2%及4% NaCl的MRS中培养24 h后,取菌液(要求所收集菌体数量小于1×109CFU/mL)于4 ℃、12 000 r/min离心2 min,弃上清液收集菌体。RNA提取过程参照天根细菌总RNA提取试剂盒(DP430)说明书,分别提取上述菌体的总RNA。
1.3.5.3 逆转录合成cDNA
首先在反转录前去除基因组DNA,然后在冰浴上按PrimerScript®RT Reagent Kit with gDNA Eraser试剂盒说明书混合体系并合成cDNA,合成后于4 ℃保存。
1.3.5.4 实时荧光定量PCR检测
依据SYBR®Premix Ex TaqTM试剂盒说明书进行PCR反应液的配制。反应体系总体积为20 μL。PCR参数为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸34 s,共40 个循环数[16]。在任一盐浓度胁迫下,均以野生株样品为校准样品,以同浓度下luxS基因突变株样品为待测样品,通过2-ΔΔCt分析不同待测样品基因的表达差异[19]。
1.4 数据分析
结果均为3 次独立重复实验数据的平均值,用 ±s表示。采用Excel及Origin 8.5进行数据分析和作图,并利用SPSS 17.0程序进行方差分析。P<0.05,差异显著;P<0.01,差异极显著。
2 结果与分析
2.1 luxS基因缺失突变株的验证
前期研究已经成功构建luxS基因缺失突变株[16],由于质粒自身性质不稳定且基因敲除后具有一定复原性,在长时间贮存后性状易发生改变,因此在实验前对突变株进行验证。在含4 mg/L CAP的抗性平板上划线结果显示,野生株在抗性平板上不生长,而luxS基因缺失突变株正常生长(图1)。
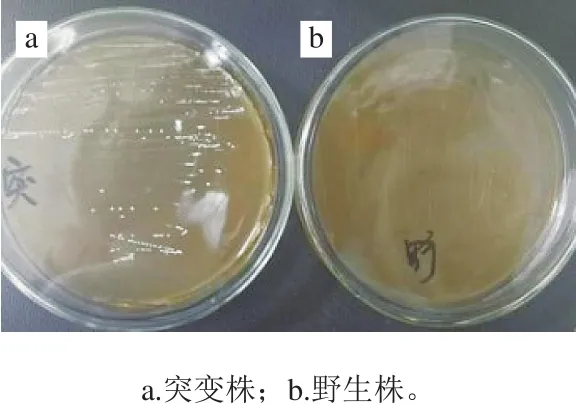
图1 luxS基因缺失突变株抗性平板验证Fig. 1 Verification of luxS gene deletion mutant strain by resistant plate
分别挑取抗性MRS平板上生长的突变株单菌落及普通MRS平板上生长的野生株单菌落进行PCR验证,结果显示,野生株在2.9 kb处有一条明亮条带为luxS基因片段(图2泳道1),而突变株分别在2.9 kb和3.4 kb处有两条明亮的特异性条带(图2泳道2)。由于L. plantarum KLDS1.0391具有2 个luxS基因片段,突变株的2 条特异性条带分别为同源重组的转化子与luxS基因片段,表明打靶片段仍同源重组在基因组中,因此该突变株为L. plantarum KLDS1.0391 luxS单基因缺失突变株。
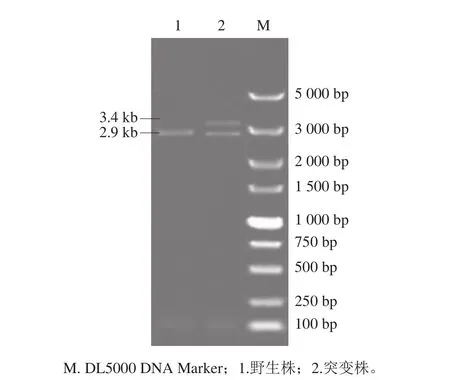
图2 luxS基因缺失突变株菌落PCR验证Fig. 2 Verification of luxS gene deletion mutant strain by PCR
2.2 luxS基因对菌株NaCl耐受能力的影响
在6 种不同质量分数NaCl胁迫条件下,L. plantarum KLDS1.0391野生株与luxS基因缺失突变株在胁迫24 h内存活率的变化如图3所示。在孵育过程中,无论luxS基因缺失与否,L. plantarum KLDS1.0391存活率均随NaCl质量分数的升高而降低,且野生株对NaCl具有较好的耐受能力,在8% NaCl质量分数下胁迫24 h后存活率仍能达到80%以上。
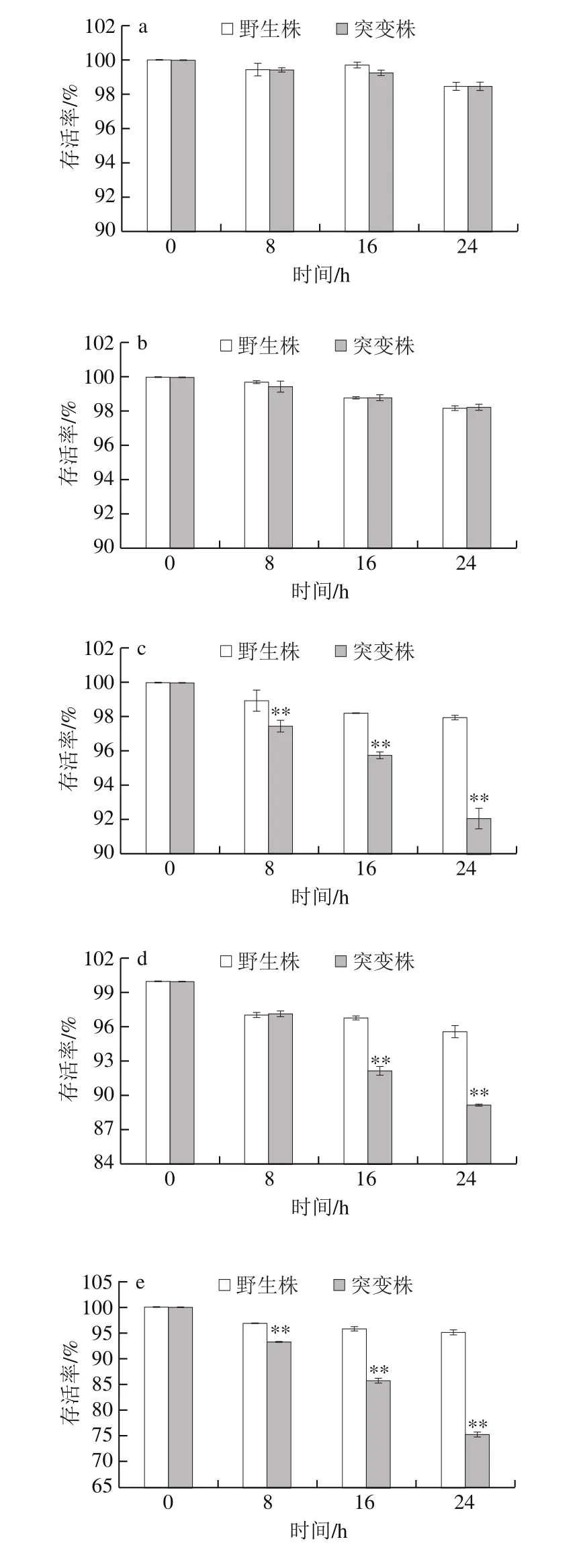
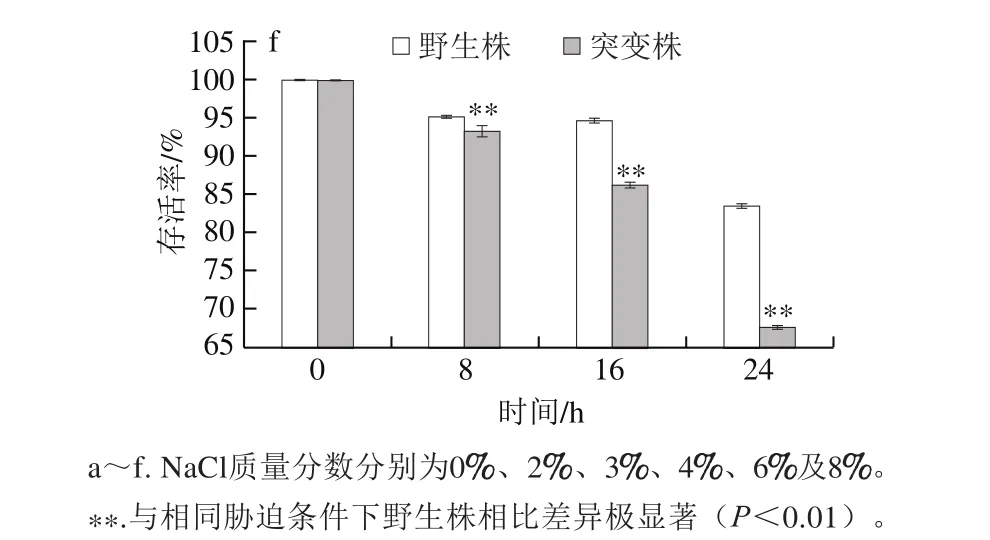
图3 NaCl胁迫对野生株与luxS基因缺失突变株存活率的影响Fig. 3 Effects of different concentrations of NaCl stress on survival rates of the wild-type strain and its mutant
不添加NaCl时,在孵育的24 h中,两株菌的存活率均有微弱下降,这可能是由于没有营养物质导致其中某些细胞个体的衰亡(图3a)。在2% NaCl条件下孵育24 h后,存活率低于不添加NaCl组,但两株菌存活率仍能达到98%以上,且无显著性差异(P>0.05)(图3b),此结果表明:在NaCl质量分数低于2%时,luxS基因对该菌株耐受NaCl胁迫的影响不显著。当NaCl质量分数不小于3%时,野生株对NaCl的耐受能力极显著高于突变株(P<0.01)。野生株在3%、4%、6%及8% NaCl质量分数下胁迫24 h后存活率分别为97.95%、95.55%、95.10%和83.47%;而luxS基因缺失突变株的存活率分别为92.05%、89.13%、75.15%和67.46%(图3c~f),实验结果表明,luxS基因在L. plantarum菌株耐受NaCl胁迫中起作用。
2.3 luxS基因对菌株在NaCl胁迫下生长的影响
由盐耐受能力实验结果可知,在8% NaCl质量分数胁迫下菌株存活率显著下降,表明该条件严重影响其存活能力,进而抑制菌株生长代谢,因此在后续研究中仅讨论其他5 个质量分数梯度。由图4可知,无论是野生株还是突变株,盐胁迫均会在一定程度上延缓或抑制L. plantarum KLDS1.0391菌体的生长。野生株在含2%NaCl的MRS中生长16 h后进入稳定期(图4b),较不含NaCl延迟4 h(图4a),但在稳定期后的OD600nm值无显著差异(P>0.05);而对于其他NaCl质量分数,不仅到达稳定期的时间较不含NaCl时有所延迟,OD600nm值也显著降低(P<0.05)(图4c~e)。对于luxS突变株,任何质量分数的NaCl胁迫均会延长其进入稳定期的时间,且显著降低菌体数量(P<0.05);生长能力均弱于野生株,且差异显著(P<0.05)。而突变株相对于野生株而言,二者达到各生长阶段的时间几乎保持一致,无延迟现象;但在达到稳定期后,各NaCl质量分数下活菌数均为野生株大于突变株。在6% NaCl质量分数下,菌株在指数生长阶段维持较长时间,表明高质量分数NaCl胁迫严重影响了L. plantarum KLDS1.0391的生长。野生株在含0%、2%、3%、4%和6% NaCl的MRS培养基中培养进入稳定期后OD600nm值分别为1.767、1.766、1.657、1.588和1.182;突变株则分别为1.705、1.677、1.618、1.544、1.101。
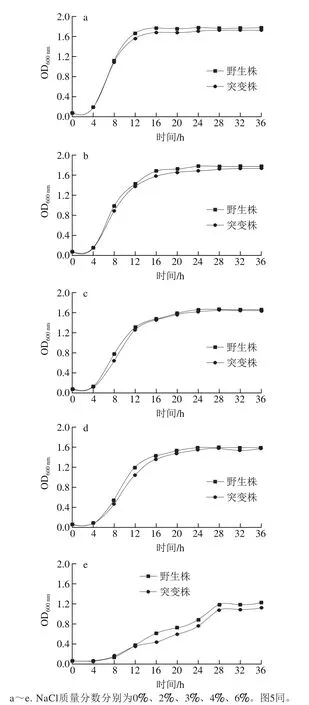
图4 NaCl胁迫对野生株与luxS基因缺失突变株生长的影响Fig. 4 Effects of different concentrations of NaCl stress on growth of the wild-type strain and its mutant
2.4 luxS基因缺失对菌株在NaCl胁迫下细菌素合成能力的影响
随着L. plantarum KLDS1.0391进入生长对数期,野生株细菌素合成量逐渐增加,当进入稳定期后细菌素合成量最大,且随着细菌的衰亡,细菌素合成能力也逐渐减弱(图5a);在2% NaCl胁迫下,细菌素合成量高于未添加NaCl(图5b);而当NaCl质量分数大于2%时,则在一定程度上抑制细菌素的合成,NaCl胁迫下L. plantarum KLDS1.0391细菌素最大合成量的顺序依次为:2% NaCl>0% NaCl>3% NaCl>4% NaCl>6% NaCl(图5c~e)。对于突变株,虽然细菌素在菌体生长过程中的合成趋势与野生株相同,但是当其面对NaCl胁迫时,细菌素合成能力均较未胁迫时有所降低,且随NaCl质量分数提高,细菌素合成量也逐渐下降,差异显著(P<0.05)。
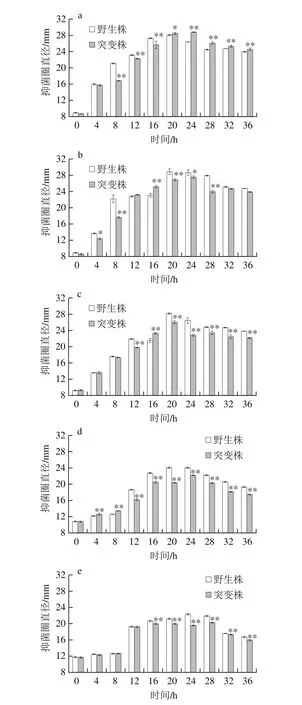
图5 NaCl胁迫对野生株与luxS基因缺失突变株细菌素合成的影响Fig. 5 Effects of different concentrations of NaCl stress on bacteriocin biosynthesis of the wild-type strain and its mutant
2.5 luxS基因对菌株在NaCl胁迫下细菌素合成相关基因表达的影响
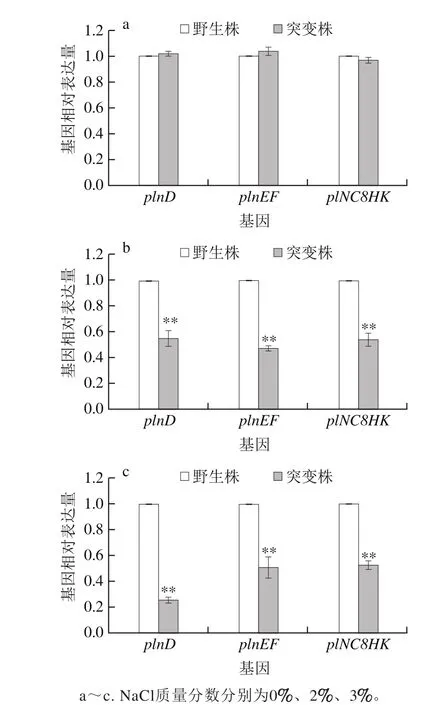
图6 NaCl胁迫对野生株与luxS基因缺失突变株细菌素相关基因表达的影响Fig. 6 Effects of different concentrations of NaCl stress on expression of bacteriocin biosynthesis-related genes in the wild-type strain and its mutant
根据上述细菌素合成能力研究结果,选取具有代表性的促进细菌素合成的NaCl质量分数2%、抑制细菌素合成的NaCl质量分数4%为研究对象,以未胁迫作为对照。结果表明:当L. plantarum野生株及突变株分别在不含NaCl的MRS中培养24 h时,编码细菌素的结构基因plnEF与调节细菌素合成相关基因plnD和plNC8HK表达量差异不显著(P>0.05)(图6a);当NaCl质量分数为2%和4%时,luxS基因缺失导致基因plnEF、plnD和plNC8HK的表达量极显著下调(P<0.01)(图6b、c)。结果表明,存在盐胁迫时,luxS基因会影响L. plantarum KLDS1.0391中细菌素合成相关基因的转录水平,进而影响该菌在盐胁迫条件下细菌素的合成。
3 讨 论
许多发酵食品如发酵肉、酸菜、干酪等通常会在发酵过程中添加一定量的NaCl,使得环境中的渗透压升高,影响细胞结构并引起生理损伤,这会在一定程度上对乳酸菌的生长与代谢造成胁迫。从本实验结果可以看出,无论野生株亦或是luxS基因缺失突变株,随着NaCl质量分数的增加,存活率均逐渐下降,这是由于当环境渗透压增大时,细胞中的K+和Na+含量不足,细胞失水无法维持正常平衡,当水分活度降低到一定程度导致死亡[20];而在较低NaCl质量分数下仍能维持较高的存活率可能因为调节因子如分子伴侣(GroEL、GroES、DnaK、DnaJ等),在面对环境胁迫时,通过调节蛋白质的修复和折叠,以及甘氨酸甜菜碱等相似相容性物质,取代水与生物大分子物质结合,减少细胞失水,从而对细菌自身起到良好的保护作用[21]。
LuxS/AI-2 QS可以调控乳酸菌的多种代谢活动,luxS是合成AI-2信号分子中重要酶的编码基因,在调控中起着重要作用。当luxS基因缺失时,L. plantarum KLDS1.0391对NaCl的耐受能力及NaCl胁迫下的生长能力均较野生株显著下降,表明luxS基因对NaCl胁迫抗性起重要作用。Gu Yue等[22]研究表明当Lactobacillus fermentum 2-1在4.5% NaCl胁迫下生长时,luxS基因及pfs基因的表达量分别上调4.2 倍和2.9 倍,表明luxS基因在面对NaCl胁迫时起到一定的积极调节作用;此外Lin Lin等[23]也通过研究表明当luxS基因被破坏后,会抑制调节因子dps-1基因的表达,致使菌体无法抵抗环境压力;同样Van Kessel等[24]发现AI-2 QS系统参与了哈氏弧菌的渗透胁迫反应系统,且渗透耐受系统甘氨酸甜菜碱操纵子betIBA-proXWV由群体信号诱导,因此与野生型相比,信号调节基因luxR缺陷型菌株抗性较弱。然而Park等[25]研究虽然也证明了LuxS/AI-2 QS信号对Escherichia coli O157:H7应对渗透胁迫有一定作用,但是其结果表明在0.6 mol/L NaCl胁迫条件下,luxS缺陷型大肠杆菌生长速率快于野生株,且对渗透胁迫耐受性强,这可能是由于luxS基因的缺失影响大肠杆菌全局转录调控,改变了甲硫氨酸生物合成途径;同时rcsA可以激活多糖的合成,且该基因与sdiA(一种编码AHLs QS调节因子LuxR的同源物质基因)的表达相关,因此推测rcsA基因的表达差异可能是影响二者生理反应的主要原因。近年来,关于luxS/AI-2 QS参与应激反应[26]的研究逐步增加,Lebeer等[27]研究表明Lactobacillus rhamnosus的luxS突变株在模拟胃液中的存活率下降,表明luxS基因对胃酸应激起关键作用;L. acidophilus的luxS突变株由于无法产生AI-2信号分子,使得生物膜的合成能力受到严重影响,且对肠上皮细胞的黏附性仅为野生株的42%[28]。
细菌素是由核糖体合成的具有生物活性的蛋白质或多肽,可以抑制某些同源微生物的生长,可作为新型防腐剂或抑菌物质。野生株在2% NaCl质量分数下培养至稳定期后细菌素活性较对照组显著提高,而其他质量分数时细菌素活性则显著降低,这与Lim[29]的结论相似,L. plantarum KC21在低浓度NaCl胁迫下对细菌素合成有一定促进作用。然而当面对环境中的NaCl胁迫时,不同菌株也有差异,如Lactobacillus casei CTC494在有NaCl胁迫的条件下细菌素活性均下降[30];而Lactobacillus pentosus B96在8%质量浓度NaCl胁迫时细菌素活性仍较正常培养时有所升高[31]。但对于相关机制目前尚未有明确定论,这可能由于适量NaCl可以改变细胞膜的通透性[32],有利于细菌素的释放;同时细菌素的分泌有多种途径如Sec途径、SRP途径以及ABC转运系统等,一定浓度NaCl胁迫下可能使得相关基因的表达量发生改变[33],增加了细胞分泌的效率,使得合成的细菌素更快的排出胞内被检测到相关活性。Man等[18]研究结果显示,L. plantarum KLDS1.0391中含有一对组氨酸蛋白激酶plNC8HK与相应调节因子plnD,并构建了plNC8HK-plnD基因突变株,发现突变株在单独培养时无细菌素活性检出,这表明该双组分系统对细菌素的合成具有重要的调控作用。本研究结果表明luxS基因缺失突变株在各NaCl质量分数胁迫下细菌素活性低于野生株,说明luxS基因显著影响细菌素的合成,且进一步实时荧光定量结果表明,突变株中与细菌素合成相关基因plnD、plnEF及plNC8HK基因的表达量均低于野生株。Merritt等[34]研究发现luxS基因缺失使得Streptococcus突变株无法产生细菌素mutacin I,且编码基因mutA的表达量也较野生株下调400多倍,位于操纵子下游基因的正调控基因mutR的表达量也显著下调,同样表明luxS基因对细菌素合成有重要意义。
细菌素作为生物防腐剂使用时,应具备在盐胁迫条件下有较好的生长与细菌素合成能力。本研究表明:L. plantarum KLDS1.0391野生株具有较好的盐耐受能力,在8% NaCl质量分数胁迫下仍能保持80%以上的存活率,且在低质量分数NaCl存在时可以显著提高细菌素合成能力;当luxS基因缺失时,其对高质量分数NaCl的耐受能力显著降低,且在任一NaCl质量分数胁迫下突变株的生长能力、细菌素合成能力均弱于野生株,细菌素合成相关基因的表达量也均显著下降,说明L. plantarum KLDS1.0391中的luxS基因参与盐胁迫响应且起着重要作用,这为胁迫下QS调控细菌素合成提供一定理论依据,同时为该菌株应用于实际生产提供理论支持。

