苦荞芽苗茶饮料发酵前后营养、风味及抗氧化活性的变化
李 俊 卢 扬 赵 刚 向达兵 陈中爱 刘 辉
(1.贵州理工学院食品药品制造工程学院,贵州 贵阳 550003;2.贵州省农业科学院食品加工研究所,贵州 贵阳 550006;3.农业农村部杂粮加工重点实验室,四川 成都 610106)
苦荞被誉为药食同源植物,除了蛋白质、维生素等基本营养元素外,还富含芦丁、槲皮素等黄酮类物质,营养素含量丰富,比例均衡[1]。研究[2]表明,黄酮类物质具有较高的食用和药用价值,具有抗菌消炎等作用,长期食用还能增强人体免疫力。因此,苦荞已经成为食品加工的一个热点,已经开发出苦荞醋、苦荞茶、苦荞酸奶等各种特色保健食品。有研究[3]发现,萌发后的苦荞籽粒,黄酮类物质的含量会显著提高,其中芦丁含量会增加4~6倍。但现阶段国内外对苦荞产品的开发主要集中于苦荞籽粒,对苦荞萌发后的芽苗研究还较少。
乳酸菌具有协调人体肠道菌群的比例、降低胆固醇、增强免疫力等一系列功效[4]。通过乳酸菌发酵不仅能赋予制品新的保健功能,而且还可使制品产生特有的风味。Cho等[5]开发出的乳酸菌发酵饮料蛋白含量高,脂肪含量低,活菌数高,抗氧化及抗菌活性显著增强,感官性状良好。王振斌等[6]采用乳酸菌和酵母菌发酵葛根汁,发酵6 d葛根汁总黄酮含量提高了17.72%,γ-氨基丁酸质量浓度增加了279.17%,必需氨基酸总量增加了65.58%,乳酸浓度增加,产品中风味物质的含量比葛根汁有所提高。但现阶段关于乳酸菌发酵对苦荞制品中营养及风味物质的研究尚未见报道。
本研究以苦荞芽苗及苦荞茶汤为原料,采用植物乳杆菌发酵,利用液相色谱、氨基酸分析仪及气质联用等检测方法对发酵前后苦荞芽苗茶饮料的芦丁、槲皮素、山奈酚-3-O-芸香糖苷、总黄酮、氨基酸、挥发性化合物、DPPH和ABTS自由基清除率进行分析,探究发酵前后苦荞芽苗茶饮料营养、风味及抗氧化活性的变化,为苦荞饮料的研制提供数据支撑。
1 材料与方法
1.1 材料与试剂
苦荞籽粒:贵米苦18号,贵州师范大学荞麦产业技术研究中心,温度25 ℃、湿度80%条件下萌发8~10 d左右可得萌发苦荞芽苗;
苦荞茶:贵州省威宁县东方神谷有限责任公司;
植物乳杆菌(GIM1.380):广东省微生物菌种保藏中心;
芦丁、槲皮素、山奈酚-3-O-芸香糖苷标准品:美国Sigma公司;
果葡糖浆:食品级,加福得食品(北京)有限公司;
甲醇:液相色谱级,上海阿拉丁生化科技股份有限公司;
乙醇、亚硝酸钠、硝酸铝、氢氧化钠、磷酸、盐酸、苯酚、柠檬酸钠、1,1-二苯基-2-三硝基苯肼、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)、过硫酸钾:分析纯,天津市富宇精细化工有限公司;
所用水为超纯水。
1.2 仪器与设备
高效液相色谱仪:1260型,配紫外检测器,色谱柱为Shiseido C18(4.6 mm×250 mm×5 μm),美国Agilent公司;
气相色谱质谱联用仪:HP6890/5975C型,色谱柱为FB-5 (30 m×0.25 mm×0.25 μm)弹性石英毛细管柱,美国Agilent公司;
氨基酸分析仪:S433D型,德国Sykam公司;
均质机:BRS-200型,安徽博进化工机械有限公司。
1.3 试验方法
1.3.1 苦荞芽苗茶饮料制备 参照文献[7]。苦荞茶汤与苦荞芽苗按照4∶1(质量比)的比例混匀后打浆,用4层纱布过滤杂质后,4 000 r/min离心5 min,按照1∶10(体积比)的比例加入纯净水进行稀释,加入稳定剂,均质(25 MPa,60 ℃)后在121 ℃条件下灭菌5 min,按0.6%的菌剂添加量接种植物乳杆菌(液体MRS培养基37 ℃培养48 h),37 ℃发酵24 h,发酵结束。
1.3.2 总黄酮含量测定 采用亚硝酸钠—硝酸铝比色法[8]。制作的标准曲线为:Y= 0.318 6X+0.002,R2= 0.999 1。样品平行测定3次取平均值,根据标准曲线计算相应的总黄酮含量(μg/mL)。
1.3.3 不同黄酮物质含量测定 采用高效液相色谱法。根据文献[9],修改如下:制成每100 mL分别含芦丁100 mg,山奈酚-3-O-芸香糖苷50 mg,槲皮素20 mg的混合溶液,作为混合对照品溶液。取5.0 mL饮料,加入75%乙醇50 mL,超声30 min,水浴蒸干,加甲醇溶解并定容至10 mL,摇匀,过滤,即得供试品溶液。色谱条件:流动相:甲醇(A)∶0.1%磷酸溶液(B)=55∶45(体积比);波长355 nm;柱温30 ℃;进样量5 μL。
1.3.4 氨基酸测定 参照GB 5009.124—2016《食品中氨基酸的测定》的方法,水解后直接用氨基酸分析仪对苦荞芽苗饮料中的氨基酸进行分析。
1.3.5 挥发性成分测定 取样品8 mL,置于10 mL固相微萃取仪采样瓶中,放置磁力搅拌器上(转速120 r/min),插入装有2 cm×50/30 μm DVB/CAR/PDMS StableFlex纤维头的手动进样器,在60 ℃水浴中顶空萃取45 min,快速移出萃取头并插入色谱仪进样口(温度250 ℃),热解析5 min进样。色谱条件参照文献[10],对总离子流图中的各峰经质谱计算机数据系统检索及核对Nist2014和Wiley275标准质谱图,确定挥发性化学成分。
1.3.6 DPPH自由基清除的测定 参照Yang等[11]的方法并稍作改动,将发酵前后饮料稀释成不同浓度,分别置于10 mL试管中,加入3 mL DPPH溶液并振摇10 s,室温静置,避光反应30 min。在波长517 nm处测其吸光值,以不加样品的DPPH溶液作为空白对照。
1.3.7 ABTS自由基清除率测定 参照Guo等[12]的方法并稍作改动,将发酵前后饮料稀释成不同浓度,分别置于10 mL试管中,加入3 mL ABTS工作液并振摇10 s,室温静置,避光反应6 min。在波长734 nm处测其吸光值,以不加样品液的ABTS工作液为空白对照。
1.4 数据处理
采用Origin(Version 8.6)进行作图,采用SPSS(Version 17.0)进行统计学分析,P<0.05认为有统计学显著性差异,P<0.01认为有统计学极显著性差异。
2 结果与讨论
2.1 发酵前后苦荞芽苗茶饮料中黄酮含量变化
发酵前后苦荞芽苗茶饮料中黄酮含量变化见图1。由图1可知,发酵后芦丁含量基本保持不变,但槲皮素和山奈酚-3-O-芸香糖苷含量有稍许降低,总黄酮含量也从(120.6±1.9)μg/mL降至(114.6±1.7)μg/mL。这些结果与Shyu等[13]关于柑橘果皮中黄酮类物质的报道一致,柑橘果皮中黄酮类物质经发酵后也有不同程度的降低。可能是,一部分黄酮被消耗或是经修饰转化为其他物质,Chen等[14]报道了发酵对黄岑茎叶提取物中黄酮类物质的生物转化,发现L.brevisRO1菌株能够有效地提升黄酮类物质的生物转化率。但关于苦荞芽苗茶饮料中黄酮类物质降低的原因还有待进一步研究。
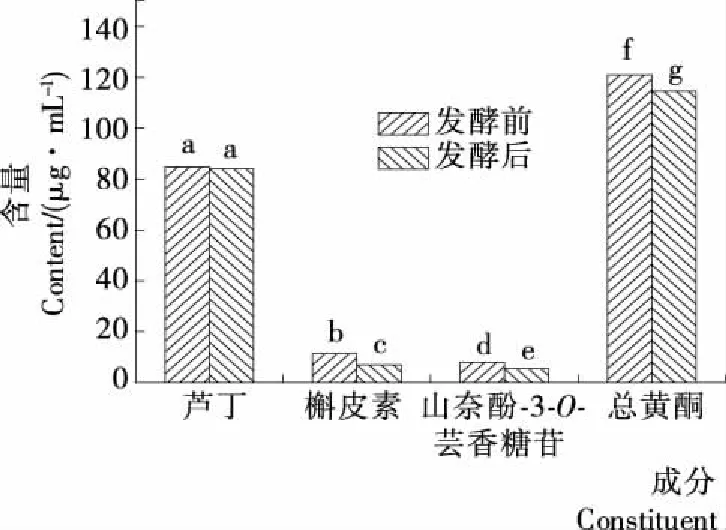
字母不同代表发酵前后测定结果差异显著(P<0.05)图1 发酵前后苦荞芽苗茶饮料中黄酮含量对比Figure 1 Comparison of flavonoids content intea beverage of tartary buckwheat sprout before and after fermentation
2.2 发酵前后苦荞芽苗饮料中氨基酸含量变化
苦荞芽苗茶饮料发酵前后氨基酸含量见表1。苦荞芽苗茶饮料中包含6种必需氨基酸(EAA)和11种非必需氨基酸(NEAA),但经乳酸菌发酵后苏氨酸并未检出。发酵前NEAA和总氨基酸(TAA)含量显著高于发酵后 (P<0.05),可能是氨基酸作为乳酸菌发酵的氮源物质被吸收利用,导致发酵后氨基酸含量降低;同时发酵过程会产生一定的风味,如苏氨酸、缬氨酸等会通过微生物转化产生特征性风味物质乙醛[6]。发酵后EAA/TAA的比例为38.32%,EAA/NEAA为62.13%,而发酵前EAA/TAA和EAA/NEAA分别为26.89%和36.80%,发酵后EAA/TAA和EAA/NEAA比例显著高于发酵前。FAO/WHO[15]提出的理想蛋白质标准为:人体EAA/TAA在40%左右,EAA/NEAA在60%左右。从这一角度分析,发酵有利于苦荞芽苗茶饮料中蛋白质性能的提高。
根据FAO/WHO[15]模式制定的苦荞芽苗饮料发酵前后氨基酸评分见表2。苏氨酸在发酵前后苦荞芽苗汁中评分最低,为第一限制性氨基酸[10]。氨基酸评分越接近1,说明该食品氨基酸比例越接近FAO/WHO推荐模式。苦荞芽苗茶饮料发酵前后大部分氨基酸评分都低于l,表明其必需氨基酸构成有一定的提升空间。
表1发酵前后苦荞芽苗茶饮料中氨基酸含量对比†
Table 1Comparison of amino acid content in tea beverage of tartary buckwheat sprout before and after fermentation

mg/kg
† a代表发酵前后同一种氨基酸测定结果对比显著 (P<0.05),未标注代表结果不显著。
2.3 发酵前后苦荞芽苗茶饮料中挥发性风味成分变化
通过对发酵前后苦荞芽苗茶饮料中各挥发性成分提取、分离、鉴定,求得其相对含量,结果如表3、4所示。共分离鉴定出8类54种挥发性物质,包括醛类(7种),醇类(14种),酮类(9种),酯类(11种),酸类(4种),烯类(2种),烷类(1种),杂环类(3种)。王灼琛等[16]对苦荞粉、苦荞壳、苦荞麸皮挥发性成分进行了分析,苦荞粉含有挥发性化合物成分44种,苦荞壳含有46种挥发性物质,苦荞麸皮含有20种挥发性物质。余丽等[17]从苦荞中分析出了35种挥发性成分,包括酯类、烃类、酮类、醛类和醇类,以酯类和醛类为主。本试验检测出发酵前苦荞芽苗茶饮料中含有46种挥发性物质,发酵后含有43种挥发性物质。

表2 苦荞芽苗茶饮料发酵前后氨基酸评分对比†Table 2 Comparison of amino acid score in tea beverage of tartary buckwheat sprout before and after fermentation
† 氨基酸评分表示1 g待测蛋白中该氨基酸占1 g标准蛋白中该种氨基酸的比值。
表4苦荞芽苗茶饮料发酵前后挥发性物质分析汇总
Table 4Analysis and summary of volatile components in tea beverage of tartary buckwheat sprout before and after fermentation
从表3可以看出,发酵前所有风味物质中2-乙酸庚酯含量最高,达到22.569%,发酵后所有风味物质中2-乙酸壬酯含量最高,达到39.986%,可能来源于饮料中添加的稳定剂(黄原胶、羧甲基纤维素钠、海藻酸钠),且发酵过程中发生了一定的化学变化。
从表4可以看出,发酵后酯类、酸类、烯类、烷类和杂环类物质均有不同程度升高,而醛类、醇类、酮类物质明显降低。酯类化合物相对含量从39.331%升高到58.687%,它是发酵饮料中一种很重要的挥发性风味物质,具有特殊的水果味和花香味,同时酯类物质的阈值一般较低,对整个体系风味的贡献很大[18]。发酵前醇类物质为主要挥发性物质,发酵后醇类物质含量从39.680%降低至29.933%,醇类一般具有芳香、花香或水果香,可以结合有机酸形成酯类物质,改善发酵后产品的风味。发酵后乙醇和2-壬醇含量显著升高,而乙醇具有醇香味,对发酵后产品风味影响较大。醇类物质虽然含量较高,但阈值也较高,对发酵后饮料的香气起到柔和作用[19]。发酵后酸类物质含量从0.196%升高到3.045%,主要的风味物质是乙酸,是因为乳酸菌代谢会产生辛酸、癸酸等有机酸,有机酸能使饮料口感清爽并带有新鲜的水果香,提升产品的滋味和口感。烷烃阈值较高,对风味的影响不大。而挥发性烯烃具有良好的香气,其中柠檬烯具有类似于柠檬的特异香味[20]。因此,通过发酵,苦荞芽苗茶饮料中阈值较低的芳香性风味物质含量明显提升,对饮料的风味具有有益的影响。
2.4 发酵对苦荞芽苗茶饮料抗氧化活性的影响
通过DPPH和ABTS自由基清除率两种测定方法对比发酵前后苦荞芽苗茶饮料的抗氧化活性,结果如图2所示。饮料发酵后DPPH自由基清除率从(68.32±0.73)%升高至(72.19±0.52)%,ABTS自由基清除率从(61.25±0.49)%升高至(63.18±0.65)%,均有一定提升。贾红玲[21]报道了乳酸菌发酵对全稻芽抗氧化性能的影响,DPPH和ABTS自由基清除率都有显著提升。梁斐等[22]报道葎草经乳酸菌发酵后,其总黄酮DPPH自由基清除率显著高于对照组和自然发酵,对ABTS自由基的清除率显著高于自然发酵组。乳酸菌发酵能够提高DPPH和ABTS自由基清除率,可能有以下3种原因:① 发酵过程中苦荞芽苗茶饮料因微生物的代谢活动自身活性物质发生改变,同时代谢出新的活性物质;② 发酵可能造成苦荞芽苗茶饮料中黄酮种类和结构改变,不同种类和结构的黄酮对DPPH和ABTS自由基清除率差异较大,增加了其抗氧化活性;③ 乳酸菌活菌的存在对其抗氧化活性也有所提高。因此,乳酸菌发酵可以提高苦荞芽苗茶饮料的抗氧化活性。

字母不同代表发酵前后测定结果差异显著(P<0.05)图2 苦荞芽苗茶饮料发酵前后抗氧化活性对比Figure 2 Comparison of antioxidant activity in tea beverage of tartary buckwheat sprout before and after fermentation
3 结论
对发酵前后苦荞芽苗茶饮料中营养、风味及抗氧化活性的变化规律进行了研究。试验结果显示,发酵后芦丁含量基本保持不变,总黄酮含量稍微降低,EAA/TAA达到38.32%,EAA/NEAA达到62.13%,显著高于发酵前,蛋白质更为均衡,但必需氨基酸评分不高。分离鉴定出8类54种挥发性物质,发酵后阈值较低的芳香性风味物质含量明显提升,对饮料的风味具有有益的影响。发酵后DPPH自由基清除率从(68.32±0.73)%升高至(72.19±0.52)%,ABTS清除率从(61.25±0.49)%升高至(63.18±0.65)%,乳酸菌发酵可以提高苦荞芽苗茶饮料的抗氧化活性。总体来说,乳酸菌发酵可以提高苦荞芽苗茶饮料的营养价值,具有一定的应用前景,但发酵过程会破坏其中的一些有益成分,下一步需要更深层次的研究其作用机理,全面提升产品品质。

