酶解对紫花芸豆清蛋白功能性质的影响
林巍,翟丽萍,刘晓兰,孙美佳
齐齐哈尔大学食品与生物工程学院(齐齐哈尔 161006)
芸豆是豆科菜豆属小宗杂粮,是世界上主要栽培的豆类作物之一。我国芸豆种植面积广,产量高,品种资源丰富。黑龙江省是我国芸豆的主要产区之一,年出口总量占全国的近1/2[1]。芸豆富含淀粉、蛋白质、多糖、膳食纤维、花色苷等物质,其中蛋白含量达20.29%~27.73%,包括清蛋白、球蛋白、谷蛋白和醇溶蛋白等,其中清蛋白含量最高[2];芸豆清蛋白中含有18种氨基酸,氨基酸总量达85.30%,其中谷氨酸含量最高,其次是天门冬氨酸,氨基酸比例合理,具有较高营养价值[3]。但是目前芸豆蛋白利用率相对较低,主要因为其分离蛋白具有相对较差的功能特性,限制了这类蛋白资源在食品加工中的应用。研究表明芸豆蛋白酶水解后会改善其功能性质[4-5],释放特殊的生理活性,如抗氧化活性[6-8]。芸豆是一种潜在的优质豆类蛋白资源,因此,试验主要对酶解前后紫花芸豆清蛋白的功能性质变化情况进行了研究,为芸豆蛋白在食品工业上的应用奠定基础,也为芸豆资源深加工产业的发展提供理论依据。
基金项目:黑龙江省省属高等学校基本科研业务费科研项目(YSTSXK201822);黑龙江省教育厅科研创新团队项目(135309113);黑龙江省教育厅基本业务专项粮头食尾(LTSW201717)
1 材料与方法
1.1 材料与设备
黑龙江紫花芸豆,市售,蛋白质质量分数23.77%;DPPH、ABTS,均购于Sigma公司;碱性蛋白酶、中性蛋白酶和复合蛋白酶,购于上海源叶生物科技有限公司;木瓜蛋白酶,购于上海生工;其他试剂等均为国产分析纯。
T-114分析天平,美国丹佛;水浴恒温振荡器,上海跃进医疗器械厂;紫外可见分光光度计,北京瑞利分析仪器有限公司;真空冷冻干燥机,美国Sim公司;CF 15 RXII高速离心机,日本日立公司;En Spire全波长多功能酶标仪,美国珀金埃尔默公司。
1.2 试验方法
1.2.1 紫花芸豆清蛋白的提取
将紫花芸豆浸泡后手工脱皮,50 ℃烘干,粉碎过筛,得芸豆粉。1份芸豆粉加15份蒸馏水,调节溶液pH为8,50 ℃振荡提取3 h,冷却后12 000 r/min离心30 min。取上清液,用盐酸调至pH 4.8,以5 000 r/min再离心20 min。取沉淀,用pH 4.8的去离子水洗2次,pH 7水复溶,以3 000 r/min离心20 min,取上清液冷冻干燥,备用。
1.2.2 不同蛋白酶酶解效果比较
使用4种商业蛋白酶(木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和复合蛋白酶)对芸豆清蛋白进行了酶解,通过比较水解度和水解产物中蛋白变化确定最适酶。
1.2.3 酶解前后紫花芸豆清蛋白功能性质影响
1.2.3.1 紫外光谱扫描
缺硼:幼苗子叶和真叶发紫,叶片僵而脆。茎生长点发黑、干枯,在生长点附近长出新的侧枝。整个植株呈丛生状。顶端的枝条向内卷曲,发黄而死,叶片、叶柄及中脉都变脆。
取浓度为0.1%的木瓜蛋白酶酶解液、碱性蛋白酶酶解液和清蛋白溶液,分别在200~800 nm范围用多功能酶标仪扫描,平行测定3组试验。
1.2.3.2 起泡性能的测定
分别配置浓度为2%的木瓜蛋白酶酶解液、碱性蛋白酶酶解液和清蛋白溶液,各取50 mL,用均质机以10 000 r/min搅打2 min,然后测定泡沫体积,记为V1(mL)。静置10,20和30 min之后,再次测定泡沫的体积V2(mL),记为泡沫稳定性。
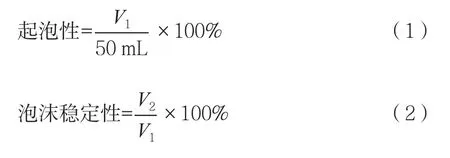
1.2.3.3 乳化性能的测定
分别配置浓度为3%的木瓜蛋白酶酶解液、碱性蛋白酶酶解液和清蛋白溶液各50 mL,调节至pH 7.0,加入50 mL大豆油,再均质5 min,迅速将乳化液倒入100 mL离心管中,3 000 r/min离心5 min,测量乳化层体积。上述方法所得混合液放置于80 ℃的水浴锅中保温30 min,冷却至室温后再以3 000 r/min在离心机中离心5 min,取出后测量乳化层的体积(mL)。计算样品的乳化活性(EAI)和乳化稳定性(ESI)。

1.2.3.4 吸油性的测定
称取0.5 g木瓜蛋白酶酶解物、碱性蛋白酶酶解物、清蛋白,分别和10 mL大豆油于离心管中混匀,室温静置30 min,然后以8 000 r/min离心30 min,测定上清液体积,体积减少量即为样品吸油量。吸油性表示为每克样品的吸附油体积,平行3组试验。
将样品蛋白浓度配制为40 μg/mL,用于ABTS自由基清除能力测定。将配好的ABTS自由基储备液,用PBS稀释到A734=0.7±0.2,作为ABTS自由基工作液。在96孔酶标板的每孔中加入100 μL各样品溶液,再加入100 μL的ABTS自由基工作液,用PBS代替样品作为对照A0,每个样品设6个重复,摇匀后黑暗中静置50 min在734 nm波长下测定吸光度。
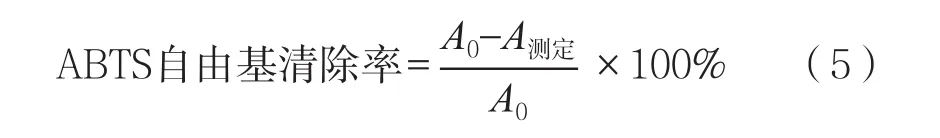
1.2.3.6 DPPH自由基清除率的测定
将紫花芸豆清蛋白、两种酶解物以及膜分离各组分的蛋白浓度配制为1 mg/mL,采用微量法测定DPPH自由基清除率。取100 μL上述样品于96孔板中,再加入100 μL浓度为0.04 g/L的DPPH自由基无水乙醇溶液,混合均匀,避光反应50 min后,在517 nm处测其吸光度为Ai;另取100 μL待测样品,加100 μL无水乙醇,测定吸光度Aj;以100 μL 0.04 g/L的DPPH自由基无水乙醇溶液和100 μL无水乙醇反应作为参比,其吸光度为A0。所有的测量都需要平行6次。DPPH自由基清除率计算公式为:

2 结果与分析
2.1 四种蛋白酶对紫花芸豆清蛋白水解度的影响
由图1可知,采用四种蛋白酶水解紫花芸豆清蛋白,碱性蛋白酶的水解度最大,其次是木瓜蛋白酶,而复合蛋白酶和中性蛋白酶的水解较差,都低于5%。图2为四种蛋白酶水解2 h后的蛋白电泳图谱。由图2可以看出,水解前的紫花芸豆清蛋白分子量主要集中在45 kDa,此外在25和70 kDa左右还有三条明显的条带。复合蛋白酶和中性蛋白水解后,70 kDa的两条亚基降解了,但其他亚基没有变化;而木瓜蛋白酶和碱性蛋白酶水解后,水解液中基本上观察不到18 kDa以上的蛋白条带,表明水解效果较好。
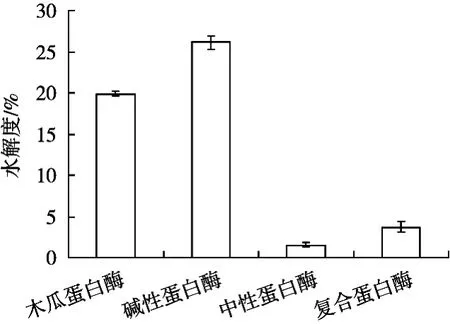
图1 四种蛋白酶对紫花芸豆清蛋白水解度的影响

图2 酶解前后蛋白质变化情况
2.2 酶解对紫花芸豆清蛋白功能性质的影响
2.2.1 酶解前后紫花芸豆清蛋白的紫外光谱扫描
蛋白质产生紫外吸收光谱主要由于色氨酸和酪氨酸残基侧链基团对紫外光的吸收,其次是苯丙氨酸、组氨酸和半胱氨酸残基侧链基团对紫外光的吸收。由图3可知,两种酶解均可提高紫花芸豆清蛋白的紫外吸收,两个吸收峰分别位于235和280 nm附近。经过酶解作用的紫花芸豆清蛋白,肽链长度发生变化,蛋白质空间结构也发生改变,内部的生色基团暴露出来,导致紫外吸收增强。
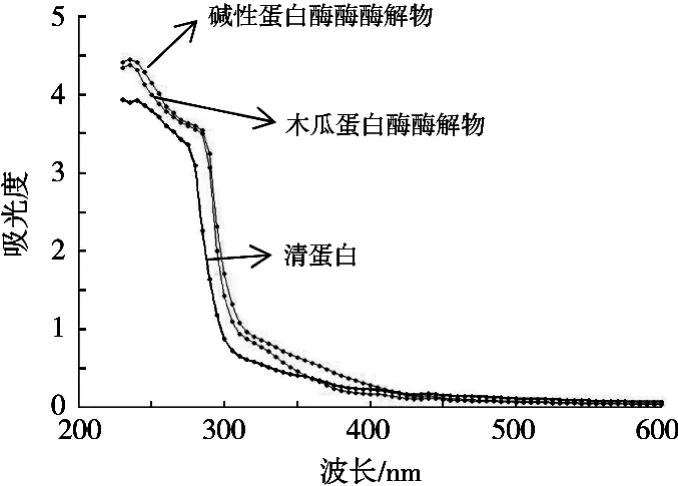
图3 酶解前后紫花芸豆清蛋白的紫外光谱扫描
2.2.2 酶解前后紫花芸豆清蛋白的起泡性与泡沫稳定性
由图4和图5可知,酶解提高了紫花芸豆清蛋白的起泡性和起泡稳定性;其中木瓜蛋白酶效果优于碱性蛋白酶。蛋白分子中含有亲水基团和疏水基团,能降低水的表面张力,在剧烈搅拌时可形成泡沫。蛋白质的起泡活性和溶解度是呈正相关的,这是由于溶解度提高有助于蛋白扩散在油/水和气/水界面,起泡性也得到了改进。酶解提高了芸豆清蛋白的溶解性,其起泡性也随之增加。
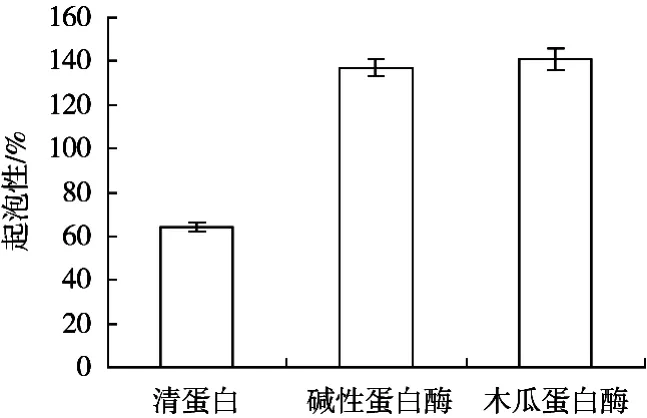
图4 酶解前后紫花芸豆清蛋白的起泡性
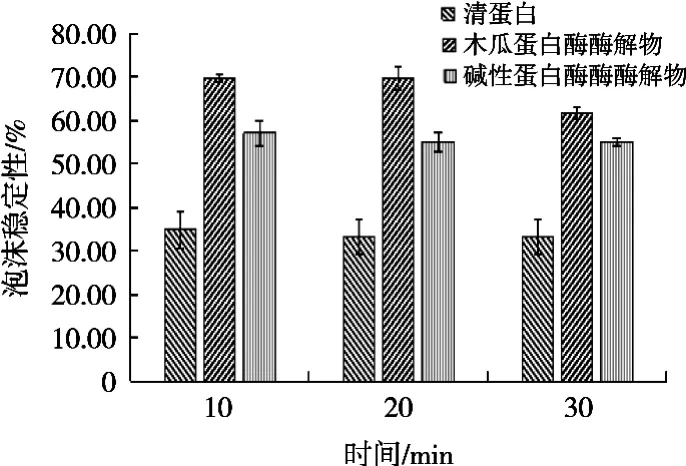
图5 酶解前后紫花芸豆清蛋白的泡沫稳定性
2.2.3 酶解前后紫花芸豆清蛋白的乳化性与乳化稳定性
由图6可知,酶解前后紫花芸豆清蛋白的乳化性和乳化稳定性没有显著性改变。蛋白质的溶解度、疏水性、扩散到界面的速率、分子间相互作用、表面电荷和水合度等因素皆可影响乳化性。酶解可改变蛋白质的空间构象,使原先埋藏于分子内部的疏水区域暴露于溶液,表面疏水性和表面电荷增加,提高了蛋白的乳化性,但是随着肽键的水解,使蛋白质分子量进一步减低,逐渐失去表面活性作用,又可降低蛋白的乳化性。所以虽然酶解前后紫花芸豆清蛋白的乳化性没有改变,但其实是多因素综合作用的结果。
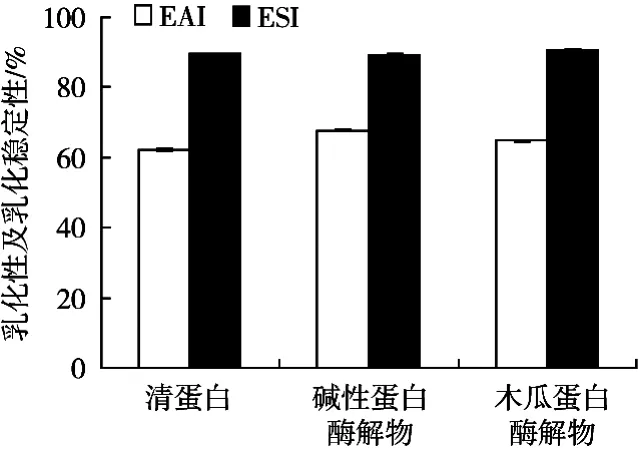
图6 酶解前后紫花芸豆清蛋白的乳化性与乳化稳定性
2.2.4 酶解前后紫花芸豆清蛋白的吸油性
由图7可以看出,酶解前后芸豆清蛋白的吸油性存在显著性差异,酶解降低了紫花芸豆清蛋白的吸油性。蛋白质肽键水解,分子量降低,疏水性较弱,与油结合机会减少。所以其吸油性产生了下降的现象。

图7 酶解前后紫花芸豆清蛋白的吸油性
2.2.5 酶解对芸豆清蛋白抗氧化活性的影响
由图8可知,酶解前芸豆清蛋白的抗氧化活性较弱,酶解可使其抗氧化活性显著升高。与未酶解的芸豆蛋白相比,碱性蛋白酶和木瓜蛋白酶的水解物的ABTS和DPPH自由基清除能力显著升高,其中木瓜蛋白酶解产物的ABTS和DPPH自由基清除率都优于碱性蛋白酶,尤其木瓜蛋白酶水解产物ABTS自由基清除率,由原来酶解前的17%提高到73%,所以木瓜蛋白酶更适合制备芸豆抗氧化活性肽。
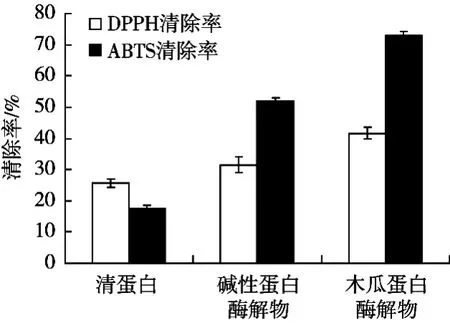
图8 酶解前后紫花芸豆清蛋白的抗氧化活性
3 结论
4种商业蛋白酶中碱性蛋白酶和木瓜蛋白酶酶解效果较好;酶解后紫花芸豆清蛋白的抗氧化活性、起泡性及起泡稳定性明显提高;紫外吸收增强;但吸油性明显降低,乳化性及其稳定性没有变化;酶解后的紫花芸豆清蛋白更有利于其在食品加工及功能性食品研发方面的应用。

