一种常见致病菌耐药基因检测芯片的建立及其应用
郭健莲 肖斌龙 刘惠娜 江先海 徐忠玉
细菌耐药性的监测,对于控制医院感染耐药菌株的发生,促进抗菌药物的合理使用具有重要意义[1]。目前常规检验手段是药敏实验,得出结果需要至少2~3天,甚至更长周期,而对于重症监护病房(intensive care unit,ICU)等对时效性要求较高的科室而言,如此长的周期给其及时诊治带来了障碍,临床迫切需要能快速、准确监测细菌耐药性的方法。随着分子诊断技术迅速发展,基因芯片在细菌耐药监测方面体现出极大的优势[2]。本研究通过设计一种新的耐药基因芯片,对6种常见致病菌进行芯片检测[3-4],以期快速、高效地监测其相应细菌的耐药情况,为临床治疗提供依据。
1 材料与方法
1.1 样本来源
收集2016年1月至2017年6月间临床送检的伤口分泌液中所分离的病原菌237株,其中革兰氏阳性菌74株(金黄色葡萄球菌41株、肠球菌33株),革兰氏阴性菌163株(大肠埃希菌57株、肺炎克雷伯菌39株、鲍曼不动杆菌32株、铜绿假单胞菌35株)。
1.2 主要试剂
NC33和PC50鉴定药敏板条(德国西门子公司);液体LB培养基[上海生工生物工程(上海)股份有限公司];CTAB/NaCl溶液(北京索莱宝科技有限公司);苯酚/氯仿/异戊醇混合液(国药集团化学试剂有限公司);探针用点样液(6×SSC,0.1%SDS)(北京博奥生物有限公司);醛基化玻片(北京博奥生物有限公司);及杂交液(5×SSC,5×Denhardt,10 μg/mL鲑鱼DNA,0.3%SDS)均为北京博奥生物有限公司产品。
1.3 主要仪器
微生物鉴定药敏测试系统MicroScan walk-Away-96(德国西门子公司);ABI 2720 PCR扩增仪[美国应用生物系统(ABI)公司];基因芯片扫描仪GenePix 4000B(美国Axon公司)。
1.4 方法
1.4.1 细菌鉴定和药敏试验
通过微生物鉴定药敏测试系统MicroScan walkAway-96,分别使用NC33和PC50鉴定药敏板条对革兰氏阴性菌(9类常用抗生素)和革兰氏阳性菌(11类常用抗生素)进行药敏测试。药敏结果按照CLSI-2013版标准[5]进行判定。
1.4.2 检测引物和探针的设计
根据GeneBank和抗生素耐药基因数据库(Antibiotic Resistance Genes Database,ARDB)公共数据库下载得到常用类抗生素(革兰阳性菌11类和革兰阴性菌9类)的主要耐药基因的基因序列,然后使用MegAlign程序进行序列比对,选择序列保守区域使用PrimerSelect软件进行引物及探针设计。使用NCBI中的Primer-BLAST程序对引物及探针进行特异性检测,以确定引物和探针的特异性。耐药基因引物及探针序列见表1。
1.4.3 基因芯片制备和杂交
将制备的探针用点样液稀释至终浓度为50 μmol/L,各取6 μL置于384孔板上,用微阵列点样仪点到醛基化玻片上,每个点重复3次;同时设置空白对照,点样模式详见表2。将点样后的芯片室温放置至少20 h。使用时用0.2%SDS洗去芯片上的一些未共价结合的寡聚核苷酸,然后用超纯水冲洗残余的SDS,自然晾干,备用。
1.4.4 致病菌DNA基因组的提取和纯化
革兰氏阳性菌采用玻璃珠法,革兰氏阴性菌采用十六烷基三甲基溴化铵法,分别提取DNA基因组。取10 μL提取的基因组DNA溶液加1.99 mL水稀释后测量OD260和OD280值,蒸馏水作为空白,计算OD260/OD280比值和DNA浓度(1 OD260=50 μg/mL DNA)。
1.4.5 多重PCR扩增反应
按照每一管检测6个耐药基因进行多重PCR扩增。PCR反应条件为:95℃预变性5 min;95℃变性 30 s,53℃~58℃退火 1 min,72℃延伸3 min,共40个循环;最后72℃延伸10 min。总共检测54个耐药基因。

表1 耐药基因的引物和探针序列Table1 Sequences for primers and probes of drug-resistant genes

续表1
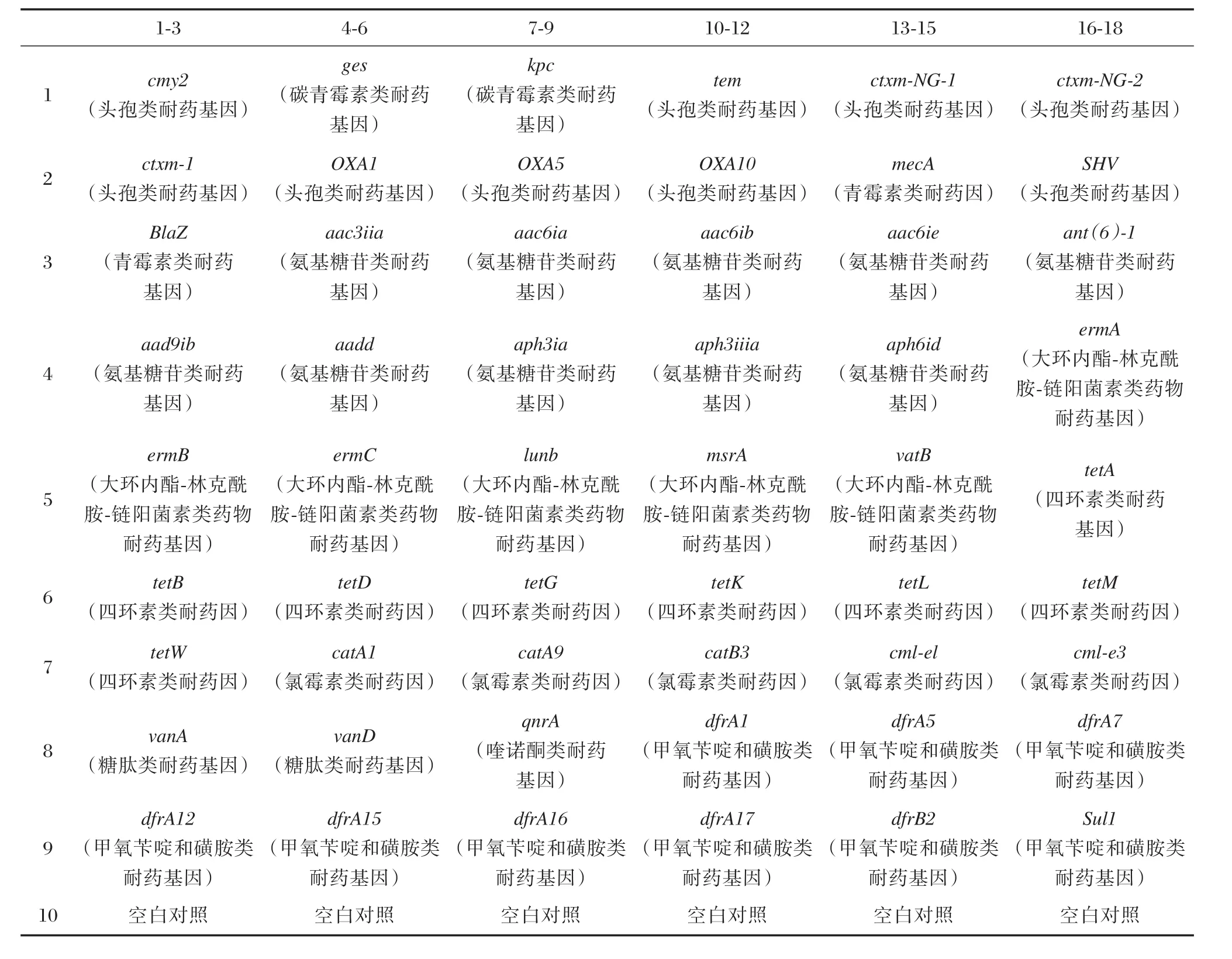
表2 基因芯片点样模式Table2 Gene chip dot pattern
1.4.6 芯片杂交和洗片
将PCR产物放入PCR扩增仪中95℃变性5 min,迅速置于0℃的冰上5 min;取变性过的PCR扩增液1 μL与9 μL杂交液混匀,然后转移至芯片的杂交区域。将芯片置于杂交盒中,50℃水浴保温1 h。将杂交后的芯片依次在室温下用洗液A(1×SSC,0.2%SDS)、洗液B(0.2×SSC)和洗液C(0.1×SSC)中各洗涤 1 min,最后在 ddH2O中洗涤1 min。从ddH2O中取出芯片后立即置于避光的50 mL离心管中,在台式冷冻离心机上以2 000 r/min离心3 min甩干(洗涤和甩干过程注意避光操作)。甩干后的芯片置于避光盒中扫描备用,同一天扫描,避免荧光信号随时间杂交信号延长而减弱。
1.4.7 芯片扫描及结果
将杂交后的芯片置于基因芯片扫描仪上,打开分析软件GenePixPro4.0F进行图像扫描。使用绿色 532 nm 单色荧光、100%Power Gain、10 μm 分辨率进行扫描,根据信号点的饱和程度调节PMT(光电倍增管)值,调节范围在PMT550~PMT700。
2 结果
2.1 多重PCR扩增和基因芯片杂交图谱
6种常见致病菌耐药基因多重PCR扩增结果见图1,图中标记的各检测基因行号与基因芯片点样模式行号相对应,每管检测6个基因,其具体每行对应的检测基因情况可参见表1基因芯片点样模式。基因芯片扫描结果见图2,分别检出的耐药基因种类见表3,其中青霉素耐药基因blaZ仅在肺炎克雷伯菌检出,金黄色葡萄球菌、铜绿假单胞菌未检出糖肽类耐药基因,大肠埃希菌未检出碳青霉素类耐药基因。
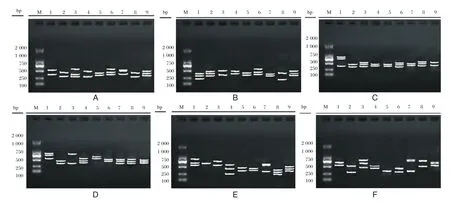
图1 6种常见致病菌耐药基因多重PCR结果Figure1 Multiple PCR results of 6 common pathogenic bacteria resistance genes
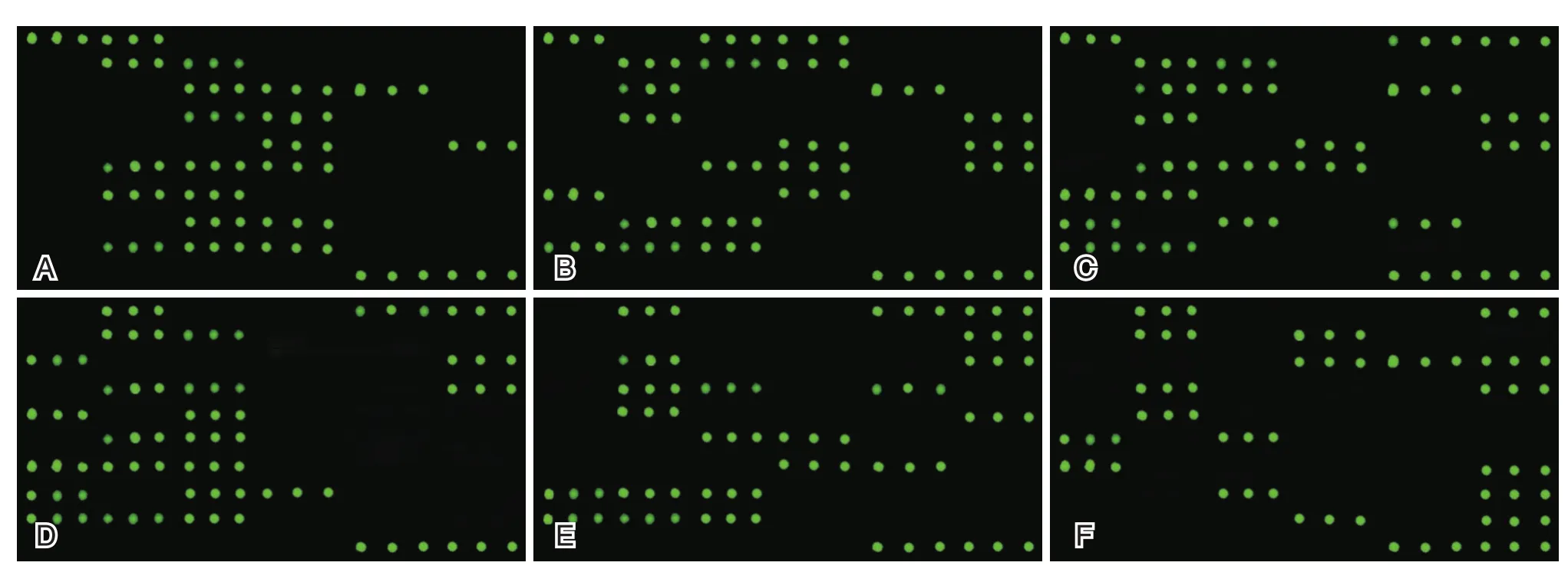
图2 耐药基因芯片杂交图谱结果Figure2 Results of drug-resistant gene chip hybridization
2.2 药敏试验结果
药敏试验结果显示,6种常见致病菌对头孢类、四环素类、氯霉素类、喹诺酮类、氨基糖苷类抗生素普遍耐药,耐药率在33.3%~92.3%之间;对糖肽类耐药率较低,耐药率均低于5%。6种细菌对大环内酯-林克酰胺-链阳菌素耐药率在22.9%~71.9%之间;对甲氧苄啶和磺胺类耐药率在12.1%~88.6%之间;对青霉素类耐药率在10.5%~92.7%之间;对碳青霉素类耐药率在1.8%~85.4%之间,见表4。
2.3 基因芯片与药敏试验符合率的比较
芯片检测结果显示,6种细菌的头孢类、大环内酯-林克酰胺-链阳菌素、四环素类、氯霉素类、甲氧苄啶和磺胺类、糖肽类、喹诺酮类、氨基糖苷类耐药基因阳性率与药敏试验结果基本一致,总符合率在90.9%~100%。除肺炎克雷伯菌外,其他5种细菌对青霉素类耐药基因阳性率与药敏试验结果均存在差异。除大肠埃希菌外,其余5种细菌对碳青霉素类耐药基因阳性率与药敏试验结果基本一致,总符合率在97.6%~100%(表5,表6)。
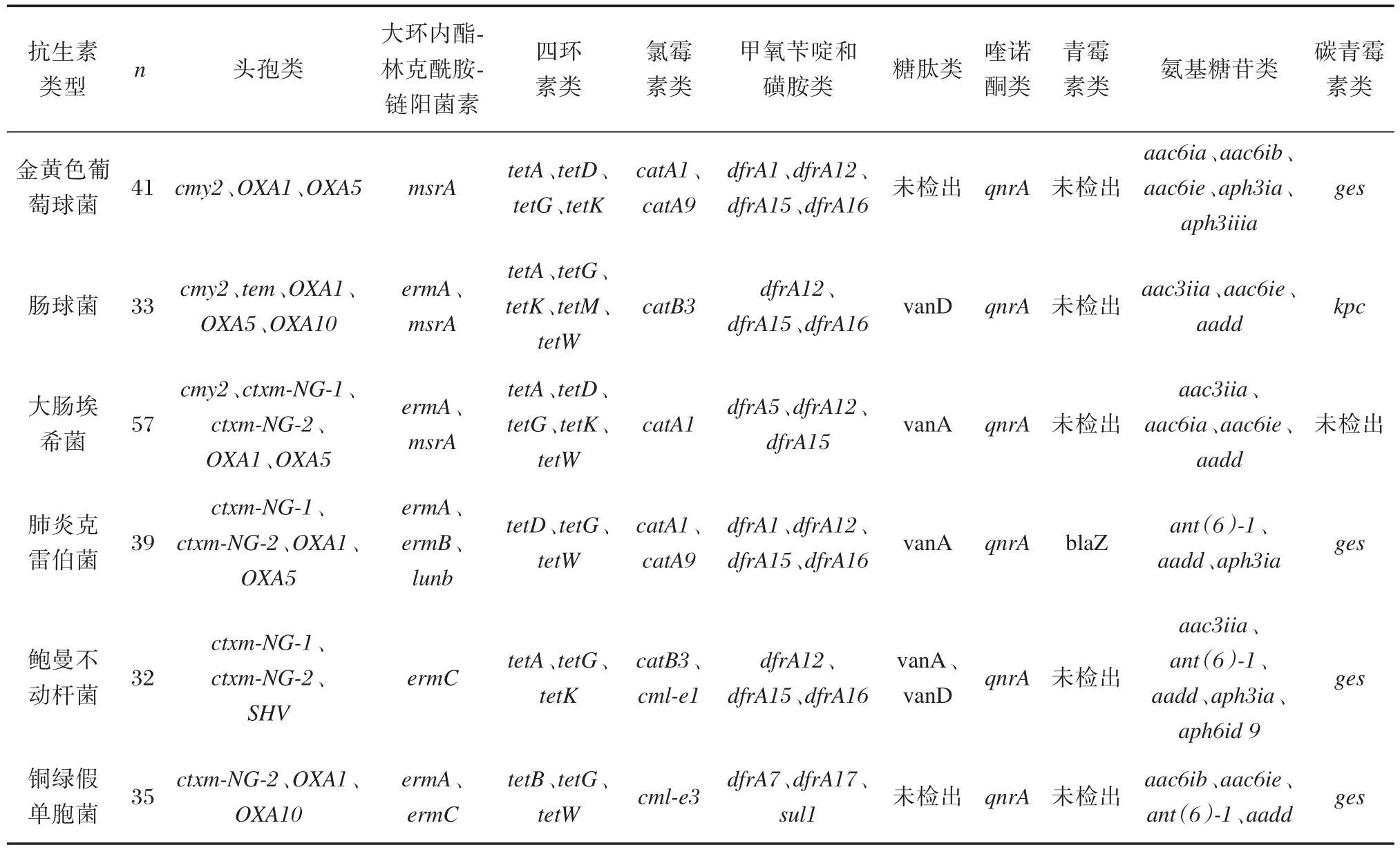
表3 6种常见致病菌检出的耐药基因种类Table3 The detection results of resistance genes in 6 common pathogenic bacteria
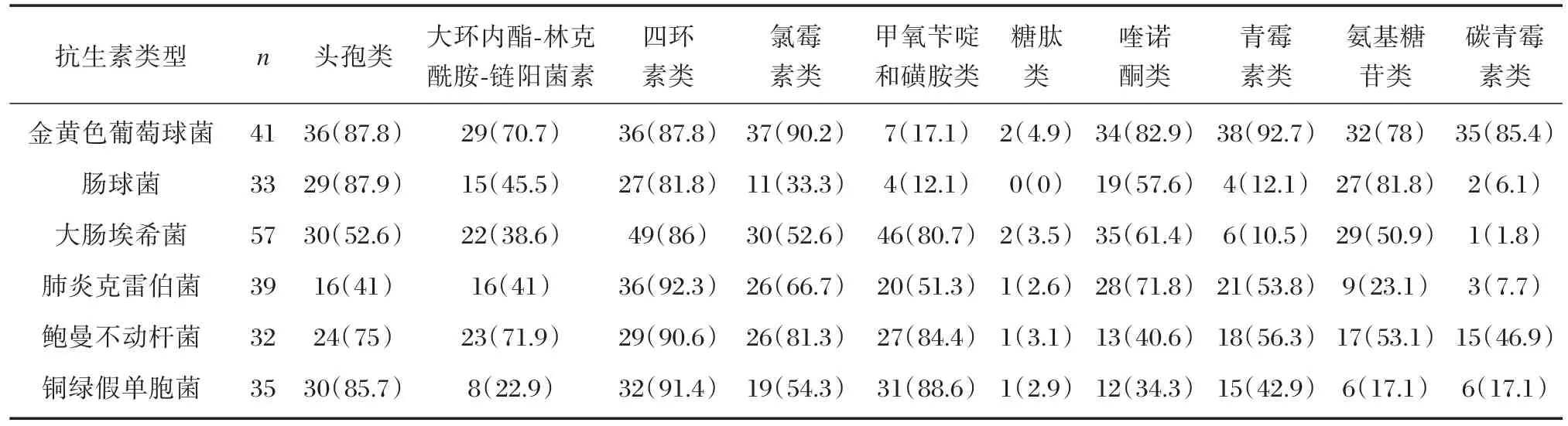
表4 6种常见致病菌药敏试验耐药率[n(%)]Table4 Resistance rate of 6 common pathogenic bacteria by bacterial susceptibility test[n(%)]
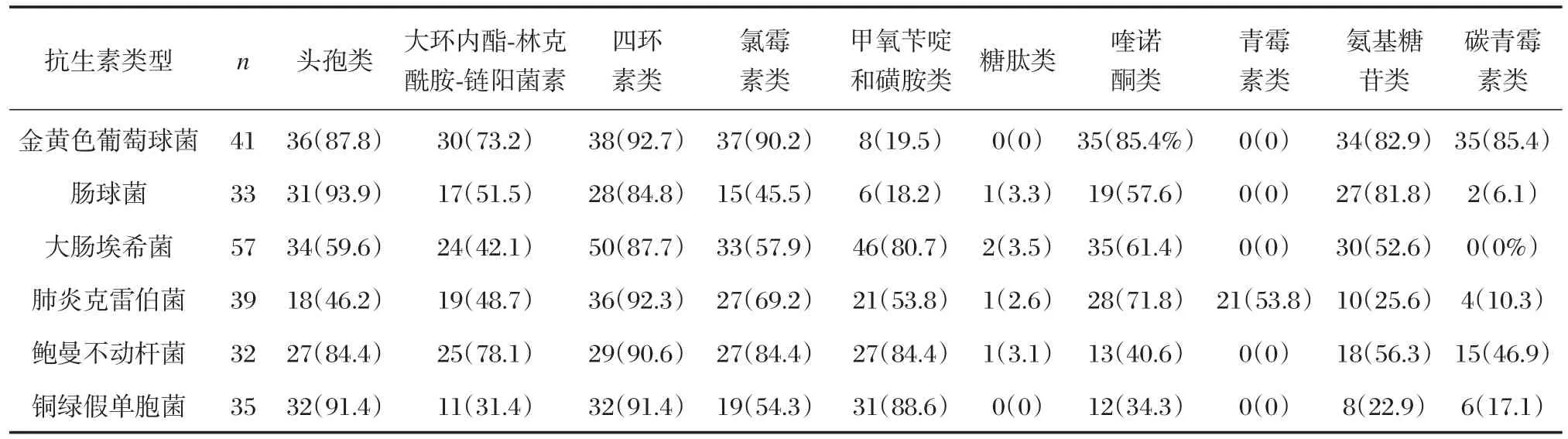
表5 6种常见致病菌基因芯片检测阳性率[n(%)]Table5 The positive rate of resistant genes in 6 common pathogenic bacteria by the gene chips[n(%)]
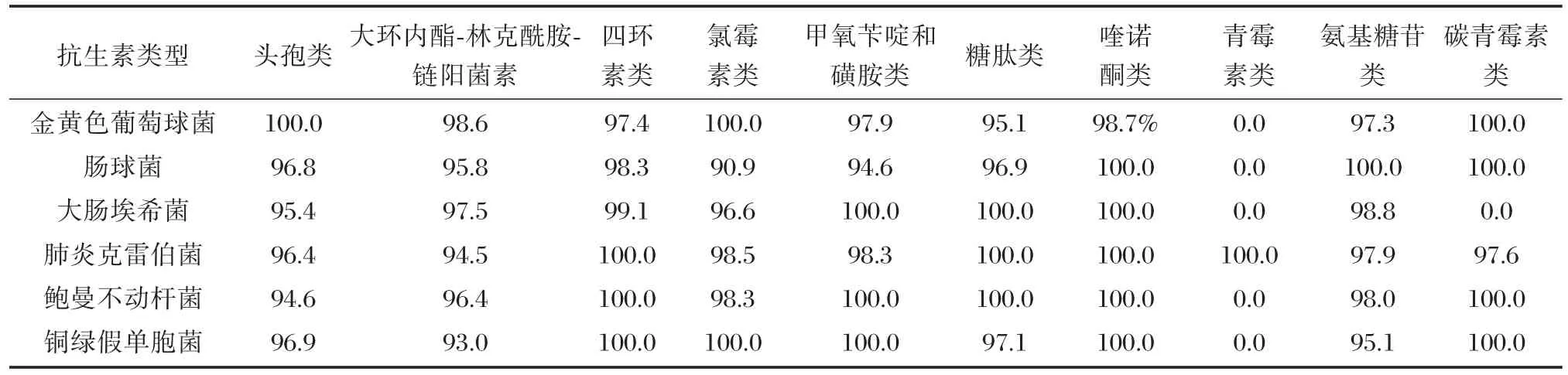
表6 6种常见致病菌药敏试验与基因芯片检测结果总符合率(%)Table6 The total coincidence rate of bacterial susceptibility tests and gene chip detection data for 6 common pathogenic bacteria(%)
3 讨论
6种常见致病菌的头孢类、大环内酯-林克酰胺-链阳菌素、四环素类、氯霉素类、甲氧苄啶和磺胺类、糖肽类、喹诺酮类、氨基糖苷类耐药基因阳性率与药敏试验结果基本一致,总符合率在90.9%~100%,说明该定制化的耐药基因检测芯片的检测方法与传统标准的药敏检测方法相比高度一致。金黄色葡萄球菌、肠球菌、铜绿假单胞菌耐药基因阳性率与药敏试验结果存在差异。而青霉素类耐药基因blaZ仅在肺炎克雷伯菌中检出,可能在设计上引物探针存在强偏好性,使得更倾向于检测肺炎克雷伯菌,从侧面也体现检测该耐药基因的引物探针对对其他细菌的检测灵敏度不足。同样的在舒丽红和丁显平[6]对基因芯片方法耐异烟肼结核分枝杆菌准确性的分析结果显示,与传统方法相比,基因芯片技术检测敏感度、特异性为82%和97%,说明基因芯片技术在应用中有着灵敏度不足之处。但韩龙等[7]研发的基于医院病原菌谱、可同时检测10种病原菌和13种耐药基因的检测芯片,拥有着和PCR技术相当的灵敏度,说明虽然基因芯片在灵敏度有所欠缺,但并不能成为该技术的缺点。碳青霉类耐药基因在大肠埃希菌中未检出,与药敏实验结果不符,同样的针对碳青霉类耐药基因设计的检测引物探针也存在灵敏度不足的原因,导致无法达到和药敏实验一样的检测限,造成检测结果的假阴性,后续需要在设计上加大力度优化改进。
传统的药敏实验,操作繁琐、准确性低,且实验周期往往需要2~3天,甚至更长时间。其他可代替药敏实验的技术,如多重PCR技术,虽快速准确,但存在反应相互影响、引物探针设计困难等问题[8-9]。全基因组测序可以发现几乎所有细菌耐药相关基因和元件,但对参比数据库的要求非常严格,而目前国际上缺乏细菌耐药基因的权威数据库,且实验过程繁琐、价格高、通量低、分析耗时长。基因芯片技术是一种利用杂交原理,将大量的探针固定于固相表面,核酸样本经荧光标记或扩增后,利用核酸杂交的特异性对大批量未知样品进行检测、分析的方法,具有高通量、高效、快速、准确的优势[10-11]。例如 Perreten 等[12]开发的基因芯片可以检测117种细菌耐药基因,可同时检测金黄色葡萄球菌的15种耐药基因。雷向东等[13]发明的细菌耐药基因检测芯片,利用实时荧光PCR技术,2 h便可一次性检测170种不同类别的耐药性基因的190个靶点。
本研究针对ICU中常见、危害较大的6种常见致病菌,设计这些细菌对于10类抗生素的耐药基因芯片,可快速准确获得常见院感细菌的耐药数据,适合在ICU等对时效性要求较高的临床科室应用,可给临床合理用药带来极大帮助。并为医院及社区感染控制乃至细菌耐药性流行病学调查及制定防治预案提供数据支持。另外,此平台的搭建必将为临床其他耐药菌的基因芯片监测平台的建立奠定基础。
总之,常见细菌耐药基因检测芯片的建立及其应用充分说明,基因芯片与药敏实验的传统检测方法相比在准确性上高度符合且优势明显。但基因芯片的检测技术也存在局限性,比如成品化芯片检查耐药基因固化与实际研究目的不一致,缺乏商品化的芯片自主研发耗时长、优化难度大、成本高等。这些都会制约该技术大规模推广应用,需要更多科研人员的努力探索。

