调强适形放射治疗对鼻咽癌的疗效及对HIF-1α和VEGF水平的影响
陈 洁,覃 强,陈雁秋
(广东省佛山市顺德区广州中医药大学顺德医院,广东 佛山 528300)
鼻咽癌(Nasopharyngeal cancer, NPC)是临床上最为常见的一种耳鼻喉科恶性肿瘤,外界环境的变化、抑癌基因的失活以及原癌基因等多基因多因素相互作用均可诱发此病的发生[1]。目前临床上NPC的转移和复发是影响其治疗效果的主要因素,其中新生血管对低氧的耐受性以及生成为主要环节。HIF-1α是肿瘤细胞在缺氧条件下形成的一种和转录因子,其转录翻译产物与肿瘤细胞的转移以及血管生成密切相关[2]。VEGF一种促血管生成因子,其可以与内皮细胞表面的受体特异性结合产生效应,引起组织内皮细胞快速分化,血管加速生长[3]。NPC由于无特异型临床症状,不易在早期发现,临床确诊时大都在中晚期,调查显示,NPC初次诊断时中晚期患者占有率高达71%以上,且生存率不超过5年。目前临床上主要的治疗方式为放疗,其中常规放射疗法较为成熟,已有十多年的历史,早期使用效果显著,单纯放疗可达80%左右的局部控制率,但对于晚期患者效果较差[4]。调强适形放射(intensity modulated radiation therapy, IMRT)是20世纪末出现的一种适形性良好的较为精确的先进放疗技术,其可以选择性的降低正常组织的放射剂量,升高肿瘤组织的剂量,对肿瘤组织的控制率有了显著提高,同时正常组织的并发症发生率降低,近期研究显示IMRT可以改善肿瘤患者的HIF-1α和VEGF水平,改善免疫功能[5]。故本文探讨IMRT治疗对NPC的疗效及对HIF-1α和VEGF水平的影响,以期为NPC患者的临床治疗提高参考。
1 资料与方法
1.1一般资料选择我院2015年9月至2017年10月收治的60例NPC患者作为研究对象,随机分为观察组和对照组,各30例,其中观察组患者男21例,女9例,年龄30~69岁,平均(43.6±5.7)岁,病程2~9个月,平均(5.5±0.8)个月,根据国际抗癌联盟(UICC)2009年制定的肿瘤分期标准[6],其中Ⅰ期1例,Ⅱ期10例,Ⅲ期13例,Ⅳ期6例,低分化鳞癌19例,其他11例;对照组患者男22例,女8例,年龄30~70岁,平均(43.5±5.9)岁,病程2~10个月,平均(5.9±0.7)个月,其中Ⅰ期2例,Ⅱ期9例,Ⅲ期14例,Ⅳ期5例,低分化鳞癌20例,其他10例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2纳入和排除标准纳入标准:①经组织病理学确定为NPC;②预估生存时间不小于3个月者;③心肝肾功能正常者;④无放疗禁忌症者;⑤卡氏生活质量评分(KPS)不低于80分者;⑥经我院伦理委员会批准,且患者以及家属同意并积极配合本次研究,签署知情协议书。排除标准:①接受化疗者;②哺乳或者妊娠期患者;③药物滥用史者;④合并有其他组织癌变者;⑤精神疾病患者;⑥依从性差,中途退出者。
1.3方法对照组患者给予常规放射治疗,具体方法如下:首先给予下颈锁骨上切线野及面颈联合野进行放疗,当照射组织量达到DT36 Gy时,将照射范围改为患者颈部电子线野以及两侧耳前野,同时缩小照射野;在遮挡骨髓的条件下,照射患者下颈锁骨上野,同时将放射调整至50 Gy;将鼻咽喉部的照射剂量调整至70~72 Gy的范围区间,耳前野以及颈部电子线野根据患者的病情程度进行调节,最后将淋巴结阳性照射量调整为66~70 Gy,每天放疗一次,一次2 Gy,每周照射5次。观察组患者给予IMRT治疗,具体如下[7]:①对患者的头颈肩部进行个体化的固定以后,在保证所有照射靶向区域均保持有2 cm左右的余量,对患者锁骨下5 cm至头顶的上缘进行CT模拟定位。②细分区域,临床靶区1为患者舌骨之上的颈部区域以及鼻咽部;临床靶区2为锁骨上的下颈部区域;临床靶区3为患者咽鼻部位的肿瘤区域;临床靶区4为鼻咽癌淋巴结转移的颈部区域;之后对限制用药以及危机器官的区域进行标记。③其中对于颞颌关节以及下颌骨照射用量不大于58 Gy;脑干、视交叉以及视神经期照射用量不高于54 Gy;腮腺的照射体积不大于30 Gy,剂量为50%;脑颞叶部位的照射剂量不高于58 Gy。④每天放疗一次,一次2 Gy,每周照射5次。⑤最后,临床靶区4和1的放疗30次完成,剂量为70 Gy;临床靶区2的放疗30次完成,剂量为60 Gy;临床靶区3的放疗30次完成,剂量为70 Gy。
1.4观察指标①所有患者均于治疗前后抽取5 mL的空腹外周血,之后放置于室温条件下,3 000 rpm·min-1的条件下离心30 min,取上清液并与-80 ℃条件下保存待测。采用ELISA法(酶联免疫吸附检测法)对患者的血清HIF-1α以及VEGF水平进行测定,其中HIF-1α试剂盒购于上海江莱生物科技有限公司,VEGF试剂盒购于北京爱迪博生物科技有限公司,操作方法严格按照说明书进行。②采用流式细胞仪(BECKMAN-COULTER)对血液中的T淋巴细胞亚群进行测定分析。③观察记录两组患者治疗过程中的不良反应发生情况。
1.5疗效评价标准参考WHO制定的NPC疗效评价标准,具体如下:①PD(进展):所有目标病灶增加的直径总和至少为20%(以目标病灶的最小直径总和为基准);②SD(稳定):目标病灶半径在进展与部分缓解之间(以目标病灶半径总和最小值为基准);③PR(部分缓解):目标病灶的直径总合最小值最少减少30%(以临界直径总和为基准);④CR(完全缓解):目标病灶基本消失,病理性淋巴结的最小直径要小于10 mm左右。总缓解=(PR+CR)×100%。

2 结 果
2.1两组患者治疗前后血清HIF-1α以及VEGF水平比较两组治疗前血清HIF-1α以及VEGF水平无统计学差异(P>0.05)。观察组治疗后血清HIF-1α以及VEGF水平显著降低,而对照组治疗后血清HIF-1α以及VEGF水平显著升高(P<0.05)。见表1。

表1 两组患者治疗前后血清HIF-1α以及VEGF水平比较/n=30
2.2两组患者治疗前后免疫功能指标变化两组治疗前CD4+/CD8+、CD4+以及CD8+免疫功能指标差异无统计学意义(P>0.05)。两组治疗后CD4+以及CD8+水平均明显降低,CD4+/CD8+水平明显升高,而治疗后观察组免疫功能指标改善更为显著(P<0.05)。见表2。
2.3两组患者不良反应发生情况比较观察组不良反应总发生率明显低于对照组(P<0.05)。见表3。

表2 两组患者治疗前后免疫功能指标变化/n=30
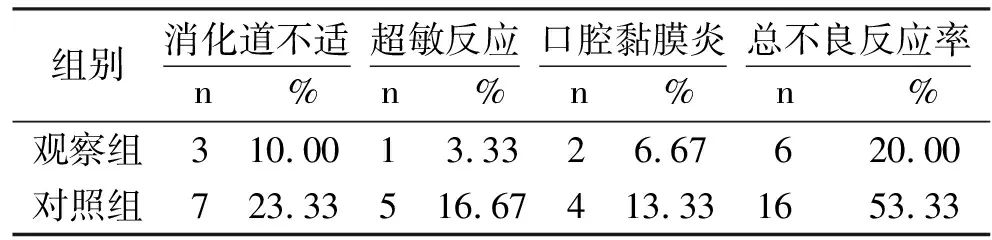
表3 两组患者不良反应发生情况比较
注:两组总不良反应率比较χ2=5.813,P=0.016。
2.4两组患者治疗疗效比较观察组治疗后的临床总缓解率为73.33%,明显高于对照组的总缓解率36.67%(P<0.05)。见表4。

表4 两组患者治疗疗效比较/n=30
注:两组总缓解率比较χ2=8.148,P=0.004。
3 讨 论
NPC是一种对射线较为敏感的鳞状细胞癌,手术治疗难以根治且易复发,故临床上放射治疗是最为有效的治疗方法[8]。本文资料显示,常规的放射治疗具有一定的临床疗效,这是因为随着影像技术的发展,可以对肿瘤部位以及侵袭范围进行较为明确的定位,外加各种辅助化疗设备的普及,可以一定程度增强治疗准确性,减弱肿瘤的增殖[9]。但是由于NPC是一种照射剂量相关性肿瘤,提高目标病灶区域的照射剂量的同时,会对其周边正常组织产生危害,从而限制了常规放疗照射剂量,而IMRT治疗可以通过调整靶向照射剂量,给予目标病灶区域合理的照射剂量,使靶区和高剂量区域的形状一致,同时对区域外的组织影响较小,从而达到鼻咽靶区与高剂量区相互适形,增强治疗效果,避免NPC周边正常组织器官受损,减少并发症的发生[10]。因此IMRT治疗过程中发生的不良反应明显低于常规放射治疗。文中资料显示,两组患者的CD4+/CD8+均出现不同程度的倒置现象,这是因为NPC患者一般伴有不同程度的免疫功能异常,与患者感染有人类疱疹病毒有关,其中CD8+淋巴细胞是体内最重要的细胞毒效应细胞,CD4+对体内T细胞群的免疫应答具有很好的调节作用,对B淋巴细胞抗体的分泌具有协同作用,两者在免疫系统中具有重要地位,数值以及比值变化可以直观地反映机体免疫功能[11]。
HIF-1是广泛存在于机体肿瘤细胞中的一种枢纽性转录因子,可以介导细胞缺氧反应。HIF-1是由HIF-1β和HIF-1α两个亚单位组成,其中HIF-1α是主要的功能性单位,其在肿瘤细胞中的含量受氧和水平的不同程度影响而敏感性变化,可以控制HIF-1通路的活性,当肿瘤组织细胞缺氧时,可以诱导HIF-1α的高表达,增强细胞增殖,病情恶化[12]。而在放疗过程中肿瘤细胞内会出现再氧合过程,造成HIF-1α相互聚集,活性受到抑制,损伤血管,放疗的敏感性增加,而IMRT治疗的区域性照射剂量较高,细胞内再氧合过程更加剧烈,HIF-1α减少更为明显,效果更为显著[13]。VEGF是一种在新生血管形成过程中起重要作用的一种特异性的促血管生长因子,肿瘤细胞分泌合成的VEGF与其宿主血管上的特异性受体相结合,刺激内皮细胞大量分泌蛋白水解酶,基质膜发生降解,屏障作用减弱[14]。另外VEGF对血管的通透性也有一定的功效,造成大量的纤维蛋白原分泌渗出,其血浆的主要组成成分,具有促进内皮细胞黏附移行的作用,这种移行机制可以穿过内皮血管基质向外部延伸,到达肿瘤组织内部,两者血管系统网相互交叉,肿瘤细胞可以通过此血管网从机体汲取营养快速生长增殖,故肿瘤细胞内的VEGF明显较高[15]。而IMRT治疗可以有针对性的对目标病灶进行照射,损伤血管,阻碍血管移行向外延伸形成血管网,抑制肿瘤细胞的生长和增殖,效果较为显著。
综上所述,IMRT治疗NPC可以降低患者血清HIF-1、VEGF水平,改善机体免疫力,减少不良反应的发生,疗效显著,值得临床推广使用。

