ERβ增加胃癌细胞氟尿嘧啶化疗敏感性的机制研究
王祥财,郭 蒸,黄 莉,涂福平,徐雪明,叶建明,赖小强
(赣南医学院第一附属医院肿瘤科,江西 赣州 341000)
晚期胃癌化疗目前常以5-氟尿嘧啶(5-FU)和铂类为基础[1],延长部分患者的总生存[2]。以5-FU为基础的一线化疗方案疗效不佳[3],整体有效率不到40%,大部分患者无法从化疗中获益。如何有针对性的筛选对5-FU敏感的胃癌患者对指导细胞毒性药物选择具有重要意义。
雌激素可调节细胞生长、复制、发育、分化等生理过程,同时还参与多种肿瘤的发生发展[4]。雌激素受体(ERs)主要包括ERα、ERβ和GPR30,ERα在胃癌组织中表达低,ERα高表达提示差的预后及淋巴结的转移[5];约40%胃癌组织中ERβ过表达[6],高表达者淋巴结及肝转移率较低,提示较好的预后,但与胃癌临床病理(如年龄、性别、肿瘤部位、肿瘤大小、肿瘤的分级)无关[7-8]。另外,有研究显示ER阴性的乳腺癌患者行新辅助化疗的有效率较ER阳性的患者高,化疗前后部分患者ER表达水平发生变化[9-11];ERβ1在非小细胞肺癌中的表达可影响靶向药物敏感性[12]。因此,ER的表达与肿瘤化疗具有相关性,可作为预测疗效的评价指标。然而胃癌中ERs的表达水平对5-FU药物敏感性的影响尚不清楚,本研究探索ERs主要是ERβ的表达与5-FU化疗疗效的相关性及可能的机制,为临床化疗方案选择及优化提供理论依据。
1 材料与方法
1.1细胞系与材料胃癌细胞AGS和KatoⅢ来源ATCC。抗ERα单抗(#ab32063)、抗ERβ单抗(#ab3577)购自Abcam公司;GST-ERβ质粒购自Addgene公司(#35563);ERβ-siRNA、抗Cyclin E单抗(sc-481)、抗Cyclin D1单抗(sc-4074)购自Santa Cruz Biotechnology公司;抗TP单抗(MA5-13542)购自ThermoFisher公司。Trizol试剂购自Invitrogen公司。逆转录试剂盒、WST-1试剂盒(MK400)购自Takara公司。SYBR green标记预混液购自Applied Biosystem公司。
1.2免疫组化本院临床胃癌患者的手术标本,常规固定切片,常规免疫组化步骤,一抗为抗ERα、ERβ抗体,显微镜观察肿瘤及癌旁组织中ERα及ERβ的分布情况。
1.3免疫印迹培养细胞或转染细胞48 h后提取全细胞蛋白裂解液。取30 μg蛋白行SDS-PAGE电泳,转膜。一抗稀释比例按说明书进行,PBS冲洗后采用对应二抗孵育。ECL化学发光法检测目的蛋白。
1.4RT-PCR常规培养细胞,Trizol提取总RNA,逆转录试剂盒生成cDNA。根据ERβ的DNA序列设计引物并比对验证,上游5′-aagaagattcccggctttct-3′,下游5′-tctacgcatttcccctcatc-3′;GAPDH为内参。取0.5 μg cDNA检测目的基因,实验重复3次。
1.5WST-1增殖实验常规培养AGS和KatoⅢ细胞,分别用0 μmol·L-1、0.01 μmol·L-1、0.1 μmol·L-1、1 μmol·L-1、10 μmol·L-1、100 μmol·L-1浓度的5-FU处理AGS和KatoⅢ细胞24 h,采用WST-1检测液处理,选择450 nm波长,在酶联免疫监测仪上测定各孔光吸收值。AGS细胞分别转染GST-ERβ或空白质粒(对照组),24 h后分别采用10 μmol·L-1的5-FU加入培养板中与细胞共孵育24 h(生理盐水为对照),WST-1液检测细胞增殖实验,OD 450表示细胞增殖速率,相对细胞增殖速率=OD 450(实验组)/OD 450(对照组)。KatoⅢ细胞分别转染ERβ-siRNA或空白siRNA(对照组),24 h后分别采用10 μmol·L-1的5-FU或者同浓度生理盐水处理细胞24 h,WST-1液检测细胞增殖实验,实验重复3次。
1.6流式细胞术AGS细胞分别转染GST-ERβ或空白质粒,48 h后收集细胞,PBS冲洗,70%乙醇固定细胞过夜,PI染色后采用细胞流式方法确定两组中AGS细胞处于G0、G1、S、G2期的细胞比,实验重复3次。

2 结 果
2.1ERβ在胃癌组织和细胞中高表达女性胃癌患者(经胃镜明确诊断),排除禁忌后行手术治疗,术后分期T4N3M0,石蜡标本行免疫组化结果显示,ERα在胃癌组织及癌旁正常组织中均未见明显表达;ERβ在胃癌组织的表达高于癌旁正常组织(图1),与前人报道一致[12],故后续我们仅观察ERβ在胃癌中的表达及作用。常规培养人肠上皮细胞HIEC、胃癌细胞KatoⅢ和AGS,分别提取mRNA和总蛋白行qPCR和免疫印迹检测ERβ表达,胃癌细胞KatoⅢ和AGS中ERβ的表达较正常肠上皮高,其中以KatoⅢ细胞ERβ表达最高(图2,P<0.05)。

图1 ERα蛋白(A)和ERβ蛋白(B)在胃癌及癌旁组织中的分布
2.2ERβ增强胃癌细胞对5-FU的化疗敏感性常规培养AGS和KatoⅢ细胞,分别用0 μmol·L-1、0.01 μmol·L-1、0.1 μmol·L-1、1 μmol·L-1、10 μmol·L-1、100 μmol·L-1浓度的5-FU处理AGS和KatoⅢ细胞24 h,WST-1增殖实验结果显示,5-FU抑制AGS和KatoⅢ细胞增殖(处理组分别与对照组比较P<0.05),并呈浓度依赖性,其中5-FU对KatoⅢ细胞增殖的抑制作用强于对AGS细胞(图3,P<0.05)。AGS细胞分别转染GST-ERβ或空白质粒,常规培养48 h,免疫印迹鉴定转染成功;同时采用10 μmol·L-1的5-FU处理细胞24 h,发现5-FU抑制AGS细胞增殖,其中以GST-ERβ组细胞增殖的抑制最为明显(图4,P<0.05)。KatoⅢ细胞分别转染ERβ-siRNA和空白siRNA,常规培养48 h时,免疫印迹鉴定转染成功;同时采用10 μmol·L-1的5-FU处理细胞24 h,发现5-FU抑制KatoⅢ细胞增殖,其中ERβ-siRNA组细胞增殖的抑制作用较对照组减弱(图5,P<0.05)。

*和**分别代表AGS和KatoⅢ中实验组(5-FU

5-FU处理组与对照组比较,*P<0.05;ERβ过表达
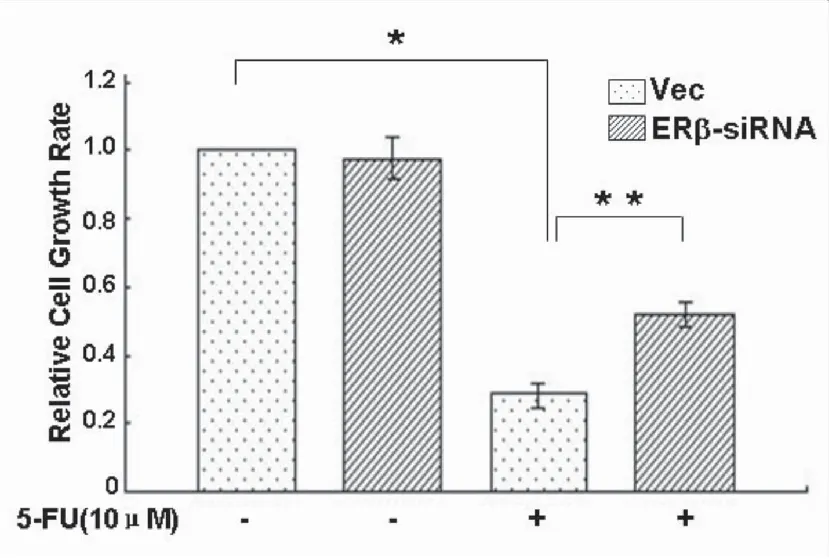
5-FU处理组与对照组比较,*P<0.05;ERβ干扰
2.3ERβ诱导胃癌细胞G1期阻滞AGS细胞分别转染GST-ERβ和空白质粒(对照组),24 h后提取两组细胞总蛋白,WB实验结果显示,AGS细胞提高ERβ蛋白的表达可抑制周期蛋白D1、E表达(图6);24 h后取相同细胞,流式细胞实验结果显示,AGS细胞提高ERβ蛋白的表达可减少AGS中G2期细胞百分比,可增加AGS中G1期细胞百分比(图7)。

图6 ERβ过表达抑制细胞周期蛋白D1、E的表达
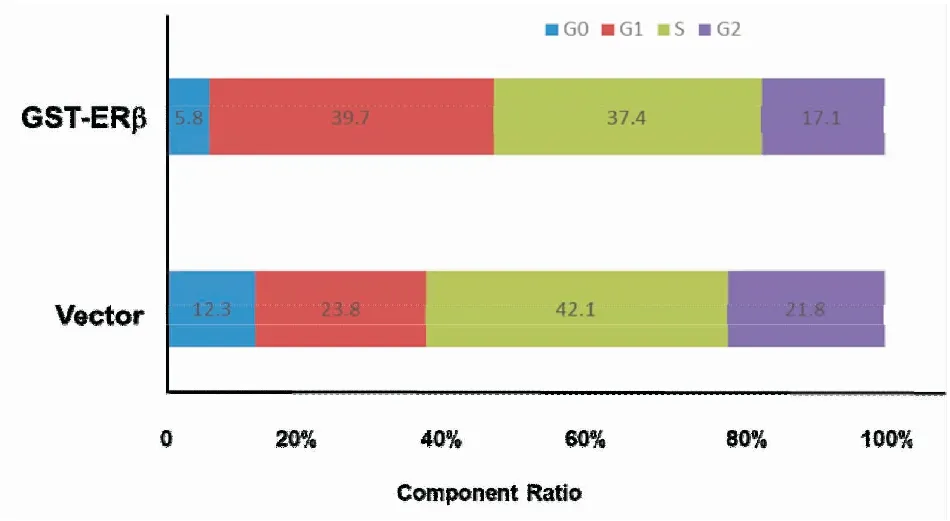
图7 ERβ过表达对AGS细胞周期的影响
2.4ERβ通过诱导TP表达增加5-FU化疗敏感性AGS细胞分别转染GST-ERβ和空白质粒(对照组),24 h后提取2组细胞总蛋白,WB实验结果显示,AGS细胞提高ERβ蛋白的表达可促进TP蛋白表达(图8)。AGS细胞常规培养转染相应的质粒或siRNA,免疫印迹证实转染成功;同时采用10 μmol·L-1的5-FU处理细胞24 h可抑制AGS增殖,过表达ERβ增加AGS对5-FU的化疗敏感性,抑制TP部分抵抗ERβ诱导的化疗敏感性(图9,P<0.05)。
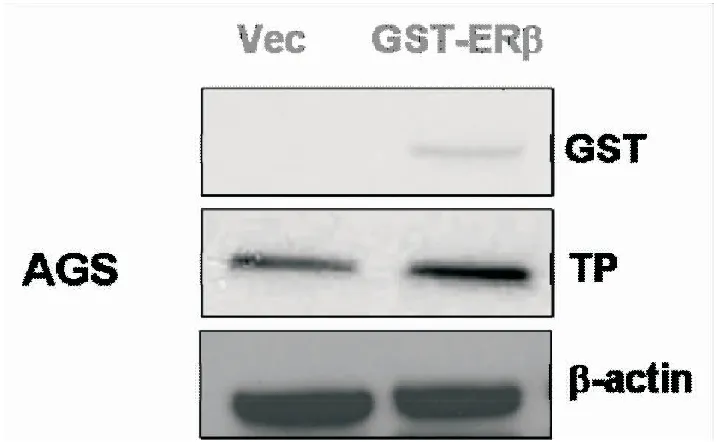
图8 ERβ过表达促进TP生成
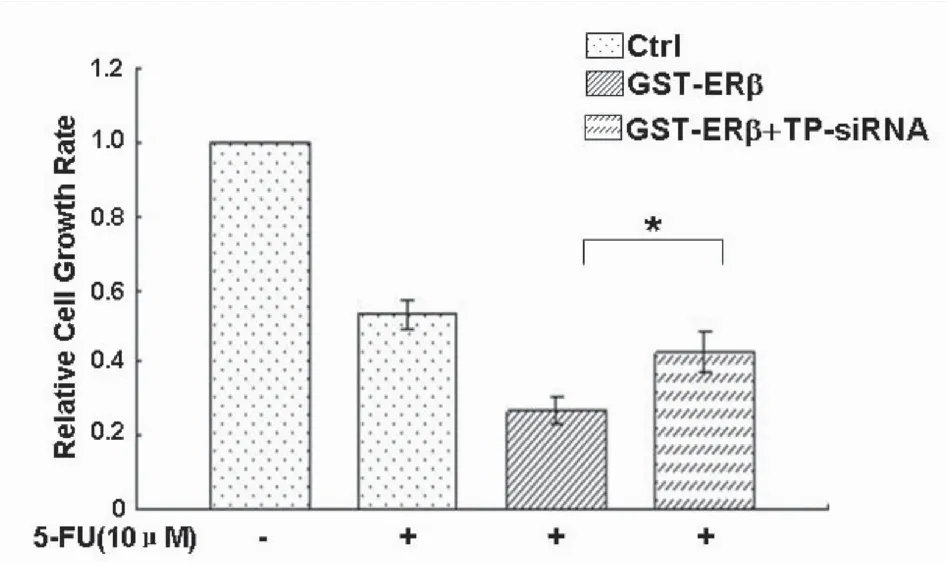
在5-FU处理下,ERβ过表达联合TP干扰组
3 讨 论
本研究通过免疫组化检测1例胃癌组织中ERs的表达,发现该患者癌组织及癌旁正常组织ERα的表达均不显著,ERβ在胃癌组织中的表达高于正常组织,这一现象与前期相关报道的结果相符[6];基于上述结果,仅ERβ表达有差异,进一步行免疫印迹检测胃癌细胞及正常肠上皮细胞中ERβ的表达,同样发现胃癌细胞中ERβ水平较正常肠上皮细胞高。然而ERβ的表达在胃癌中的作用及机制尚不明确。我们进一步通过细胞增殖实验观察了ERβ表达水平对5-FU化疗敏感性的影响。增殖实验结果显示5-FU对胃癌细胞AGS和KatoⅢ的增殖作用呈浓度依赖,ERβ表达较高的KatoⅢ细胞对5-FU的敏感性高于ERβ表达较低的AGS细胞;在AGS细胞中过表达ERβ可提高其对5-FU化疗的敏感性,在KatoⅢ细胞中抑制ERβ的表达可降低其对5-FU的化疗敏感性。上述结果提示,ERβ在胃癌细胞中的表达水平可影响5-FU对细胞增殖的抑制作用,ERβ过表达增加5-FU对胃癌细胞的化疗敏感性,ERβ敲低表达降低5-FU对胃癌细胞的化疗敏感性。
有研究发现ERβ可通过抑制myc基因、周期蛋白D1、A 表达和激活P21、P27的表达,最终导致癌细胞阻滞于G2期,进而抑制乳腺癌细胞增殖及扩散[13-14]。本研究通过免疫印迹发现,上调胃癌细胞AGS中ERβ蛋白可抑制细胞周期蛋白D1、E的表达,其中抑制周期蛋白D1表达,可抑制E2F1基因(E2F1基因是G1/S期关键的调节因子)的转录,进而致使大量胃癌细胞阻滞于G1期[15];抑制周期蛋白E表达同样也致使大量胃癌细胞阻滞于G1期[16-17]。另外,流式细胞实验发现,上调胃癌细胞AGS中ERβ蛋白可减少处于G0期的胃癌细胞,增加处于活化的胃癌细胞。并且在增加处于活化的胃癌细胞的基础上,S期无明显差异而G2期细胞明显较少,明显增加了处于G1期的胃癌细胞。概括而言,ERβ可减少处于G0期的胃癌细胞,增加处于G1期的胃癌细胞,即ERβ可诱导胃癌细胞G1/G0期阻滞,使化疗耐药细胞数(G0期)明显减少,从而增加5-FU的敏感性。
另外,氟尿嘧啶类药物在体内主要通过胸苷磷酸化酶TP活化为氟尿嘧啶脱氧核苷酸后抑制胸苷酸合成酶TS,从而抑制尿嘧啶脱氧核苷转变为胸腺嘧啶脱氧核苷,干扰S期DNA的生物合成,致使大量胃癌细胞处于S期,从而抑制细胞有丝分裂,减少细胞增殖[18-19]。免疫印迹发现上调胃癌细胞AGS中ERβ蛋白可促进TP蛋白表达;增殖实验表明,siRNA抑制TP后可部分阻断ERβ诱导的氟尿嘧啶化疗敏感性。ERβ在胃癌细胞中可诱导胃癌细胞TP表达,进而促进5-FU活化为氟尿嘧啶脱氧核苷酸,增加5-FU化疗敏感性。
综上所述,本研究通过临床标本及细胞株观察了ERβ在胃癌中的表达,并发现ERβ可通过诱导G1/G0期阻滞和TP表达,从而增加5-FU对胃癌细胞的化疗敏感性。上述研究结果提示ERβ有望作为5-FU在胃癌中临床疗效的评价指标,从而作为预测指标指导用药,但仍需行体内动物实验进一步验证。

