超声提取/气相色谱法检测食用槟榔中的甜蜜素
肖晓义,夏延斌,袁 河,赵志友
(1.湖南省槟榔加工与食用安全工程技术研究中心,湖南宾之郎食品科技有限公司,湖南湘潭 411201;2.湖南农业大学食品科技学院,湖南长沙 410128)
槟榔含有多种人体所需的营养物质和微量元素,如脂肪、槟榔油、生物碱等成分[1],其性味苦、辛、温,具有杀虫、消积等功能[2],可药用也可食用。在我国,槟榔拥有巨大的市场,仅湖南地区产值就已达到40亿~50亿元[3]。消费者对槟榔的口感、口味有一定要求,甜度是影响槟榔口感的重要指标之一。甜蜜素(C6H11NH2)化学名称为环己基氨基磺酸钠,是一种人工合成的非营养型低热能甜味剂,其甜度为蔗糖的30~50倍,且价格低廉、后苦味小,因此被广泛用于食品加工、农业等领域[4-6]。但有研究表明甜蜜素不被人体吸收而且会加重人体肝脏负担,对肾脏有毒副作用,并具有潜在致癌性[7-9],因此在实际过程中要严格把控甜蜜素的添加量。国家制定相关的甜蜜素检测标准(GB/T 5009.97—2003),该标准中甜蜜素的检测方法包含填充柱气相色谱法、比色法、薄层层析法[8-10]。气相色谱法测定甜蜜素时通常以环己醇亚硝酸脂作为定量依据[11-12],但甜蜜素和亚硝酸钠在硫酸存在时会生成环己醇,环己醇可与亚硝酸钠发生酯化反应生成环己醇亚硝酸酯,此反应为可逆反应,环己醇不能完全转换为环己醇亚硝酸酯,而2种产物之间的峰面积之和一定,因此可以通过2种产物的峰面积之和进行定量分析[13-14]。
通过峰面积加和的定量方法并结合超声提取,建立了从槟榔中检测甜蜜素的方法,并通过正交试验筛选出最佳提取工艺,该方法准确度高,精密度、分离度良好,可以满足槟榔中的甜蜜素检测。
1 材料与设备
1.1 材料
市售食用槟榔。
1.2 试剂
甜蜜素(标准品纯度≥98%),上海源叶生物科技有限公司提供;正己烷、氯化钠、亚硝酸钠溶液、硫酸溶液。以上试剂均为分析纯。
1.3 仪器
Agilent GC7890B型气相色谱,配FID检测器,美国安捷伦公司产品;SHZ-82型恒温水浴振荡器,常州市中贝仪器有限公司产品;AR224CN型分析天平,奥豪斯仪器有限公司产品;ZWSH-250型超纯水机,湖南中沃水务环保科技有限公司产品;KQ-700E型超声波清洗机,昆山美美超声仪器有限公司产品。
2 试验方法
2.1 色谱条件
色谱柱:HP-5石英毛细管柱(30 m×0.32 mm×0.25 μm);进样口:加热器温度220℃,进样量1 μL,分流比5∶1;载气N2,流量40 mL/min;柱箱温度:恒温70℃;FID检测器:温度250℃,氢气流量47 mL/min,空气流量400 mL/min,氮气流量30 mL/min。
2.2 样品前处理
选取5颗大小、形状、纹路近似的槟榔,切碎混匀,取2~3 g样品置于50 mL锥形瓶中,以超纯水为提取溶剂,采用超声的方法提取槟榔中甜蜜素,样品经超声提取后冷却至室温,取1 mL提取液置于100 mL具塞比色管中,依次加入15 mL超纯水、5 mL 50 g/L亚硝酸钠溶液和100 g/L硫酸溶液,冰浴,以转速80 r/min振摇30 min后,加入5 g氯化钠,10 mL正己烷,振摇100次,静置分层,取上层正己烷适量注入气相色谱仪中进行测定,每个样品平行3份。
2.3 单因素及正交试验
称取槟榔碎块9份,每份2.0 g,采用L9(34)正交试验表进行试验设计,结合单因素试验结果,以甜蜜素提取率为指标,考查料液比(A)、提取温度(B)、超声时间(C)3个因素对甜蜜素提取率的影响。
正交提取试验因素与水平设计见表1。
3 结果与分析
3.1 单因素考查
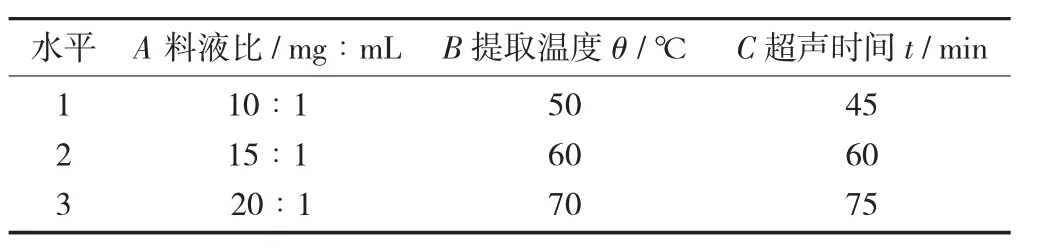
表1 正交提取试验因素与水平设计
3.1.1 超声时间对甜蜜素提取率的影响
超声时间对甜蜜素提取率的影响见图1。

图1 超声时间对甜蜜素提取率的影响
由图1可知,随着超声时间的延长,甜蜜素提取率逐渐升高,但在60 min后甜蜜素提取率随着超声时间的延长而降低,这可能是因为超声波作用时间过长破坏了甜蜜素分子结构所致。因此选取超声时间45,60,75 min 3个水平进行正交试验。
3.1.2 提取温度对甜蜜素提取率的影响
提取温度对甜蜜素提取率的影响见图2。

图2 提取温度对甜蜜素提取率的影响
由图2可知,提取温度低于70℃时,提取温度越高,甜蜜素提取率越高。提取温度高于70℃后,甜蜜素提取率下降。造成这种现象的原因可能是在低温时,随着温度的升高,分子运动加快,使得甜蜜素从槟榔中充分释放;当温度高于70℃后,超声波与高温的协同作用使得甜蜜素分子破坏降解,导致提取所得甜蜜素含量降低。因此选取提取温度50,60,70℃3个水平进行正交试验。
3.1.3 料液比对甜蜜素提取率的影响
料液比对甜蜜素提取率的影响见图3。
由图3可知,对比料液比1∶5与1∶10,前者的甜蜜素提取率远低于后者,料液比在1∶10后,甜蜜素提取率几乎没有变化。可以判断料液比1∶10可溶解槟榔中大部分甜蜜素,所以继续增大料液比对甜蜜素含量几乎没有变化。因此,综合考虑选用料液比1∶10,1∶15,1∶20 3个水平进行正交试验。

图3 料液比对甜蜜素提取率的影响
3.2 正交试验
正交试验结果如下,结果表明,影响甜蜜素提取的主次因素为A>B>C,即料液比>提取温度>超声时间。其中,料液比与提取温度达到显著水平,其最佳提取工艺为A2B2C2,即料液比1∶15,提取温度60℃,超声时间60 min。
正交提取试验结果与直观分析见表2。

表2 正交提取试验结果与直观分析
3.3 方法学考查
3.3.1 标准曲线的绘制及检出限的测定
精确称取20.0 mg甜蜜素标准品置于10 mL容量瓶中,用超纯水定容,配制成质量浓度为2 mg/mL的标准品储备液;将储备液以正己烷稀释成质量浓度为0.2,0.5,1.0,1.4,1.6,1.8 mg/mL的标准使用液,将甜蜜素标准使用液注入气相色谱仪,测定其峰面积,以标准使用液质量浓度X(mg/mL)为横坐标、相应峰面积Y为纵坐标绘制标准曲线。
甜蜜素标准曲线见图4。
由图4可知,在0.2~1.8 mg/mL线性范围内良好,回归方程为Y=116.967 2X-2.811 2,R2=0.999 1。对质量浓度为0.5 mg/mL的甜蜜素标准溶液上机分析5次,根据其3倍噪声值(S/N=3) 计算出检测限为13.99 μg/mL。
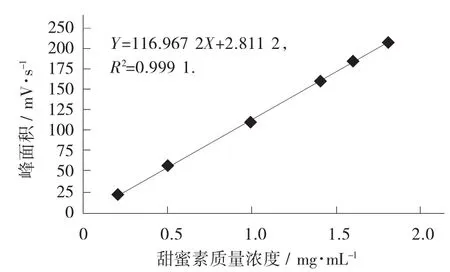
图4 甜蜜素标准曲线
3.3.2 准确度与精密度
经检测,正己烷空白溶剂中未检出甜蜜素,向正己烷空白溶剂中分别加入质量浓度0.5,1.0,1.5 mg/mL的甜蜜素标准溶液,充分混合均匀。通过测定正己烷空白溶剂加标后的甜蜜素质量浓度,计算实际样品的回收率。
甜蜜素加标回收率的测定见表3。

表3 甜蜜素加标回收率的测定
由表3可知,该方法对甜蜜素的加标回收率为98.0%~100.6%。
连续采用该方法对同一个样品测定6次,测量其平均值、标准偏差和相对标准偏差。
精密度结果的测定见表4。
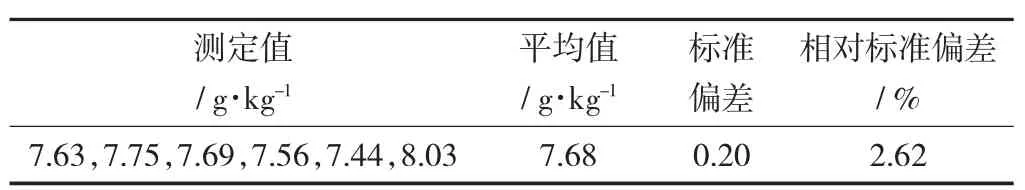
表4 精密度结果的测定
由表4可知,相对标准偏差值均小于5%,能满足分析化学的要求。
3.4 样品检测
试验在湘潭市随机购买的5种不同品牌样品按照2.2所述处理后,以提取温度60℃,超声时间60 min,料液比1∶15进行提取,经气相色谱仪分析。
槟榔甜蜜素含量抽样检测结果见表5。

表5 槟榔甜蜜素含量抽样检测结果
以上5种品牌槟榔中的甜蜜素检出量分别为7.89,7.79,7.62,6.42,7.81 g/kg,没有超过国家标准中8 g/kg 的使用量[15]。
4 结论
采用超声提取/气相色谱法测定槟榔中甜蜜素的含量,利用单因素试验和正交试验确定了最佳提取工艺为提取温度60℃,超声时间30 min,料液比1∶15(mg∶mL)。同时,使用HP-5毛细管柱管对样品中的甜蜜素进行了分离,用组校准的方法对样品进行了定量分析。测定槟榔中甜蜜素的方法,检测结果准确、甜蜜素峰形好、线性范围广、良好的准确度和精确度,重复性、再现性好,可以满足槟榔中甜蜜素含量的检测,在槟榔行业中具有推广意义。

