海洋低温葡萄糖氧化酶细菌选育及其酶学性质研究
刘春莹,胡善松,张庆芳,李美玉,于爽,迟乃玉*
1(大连大学 生命科学与技术学院,辽宁 大连,116622) 2(辽宁省海洋微生物工程技术研究中心(大连大学),辽宁 大连,116622)
葡萄糖氧化酶(glucose oxidace,GOD)能高度、专一性地催化β-D-葡萄糖与空气中的氧反应,使葡萄糖氧化成为葡萄糖酸和过氧化氢[1-3]。GOD具有去葡萄糖、脱氧、杀菌等作用,而且安全、无毒副作用,在食品的加工保鲜[4-5]、血糖检测[6-7]以及饲料加工等方面都有广泛的应用[8]。目前,工业生产GOD酶制剂的方式以微生物发酵为主,生产菌株主要是黑曲霉和青霉属[9-12],但存在副产物多、分离纯化困难的问题,霉菌所产GOD多为中高温酶,在低温食品保鲜及饲料保鲜等方面应用效果不理想。
开发海洋生物资源是我国海洋强国战略的重要内容,也是全世界海洋国家的竞争焦点。相对于陆源生物,海洋生物因其特殊的栖息环境,产生的酶具有耐压、耐碱、耐盐、耐冷等显著特征,更符合现代生物技术以及不同加工产业的应用要求。“海洋酶的挖掘及应用”已成为目前酶制剂企业竞争的新热点[13-16]。
相对于霉菌,细菌中GOD的提取、纯化更简便易行。此外,发酵液中的蛋白种类较少,使得后期的纯化也更加容易,在工业生产中更具优势。
目前,细菌GOD相关文献报道较少,叶日英、石淑钰等[17-18]得到的细菌GOD酶活较低,急需提高。诱变育种是通过诱变处理提高菌种的突变几率,扩大变异幅度,从中选出具有优良特性的变异菌株。诱变育种和其他育种方法相比,具有速度快、收效大、方法简便等优点,是野生GOD细菌选育的一种重要方法。
本文以渤海海域海泥为样品,通过平板显色和酶活测定,筛选获得高产低温GOD的野生细菌8-Ⅲ,再利用紫外诱变、化学诱变、紫外-化学复合诱变的方法对其进行诱变处理,获得高产低温GOD并且性能稳定的优良菌株,为GOD在低温保鲜领域的应用提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品
海泥(123°371’E,39°6972’N)样品取自大连地区渤海海域,水深20~30 m的海底。
1.1.2 试剂
(NH4)2HPO4、CaCO3、亚甲基蓝、琼脂、葡萄糖、KH2PO4、MgSO4、KCl、NaNO3、酵母提取物、蛋白胨、NaCl;1.0×10-3mol/L邻联茴香胺溶液;0.2 mol/L辣根过氧化物酶溶液(pH 5.2);上述试剂中NaCl、邻联茴香胺、亚甲基蓝和辣根过氧化物酶等均为分析纯试剂,其余均为化学纯试剂。
1.1.3 培养基
筛选培养基(g/L):葡萄糖60,蛋白胨3,(NH4)2HPO40.4,KH2PO40.2,MgSO40.16,CaCO33.5,KI 2,可溶性淀粉10,琼脂20,pH 6.5。
发酵培养基(g/L):葡萄糖60,蛋白胨3,KH2PO42,MgSO40.7%,KCl 0.5,NaNO340,pH 7.0。
LB培养基(g/L):酵母提取物5,蛋白胨10,NaCl 10,pH 7.0。
1.1.4 仪器
Multiskan1510酶标仪,Thermo Fisher Scientific;LDZX-40BI立式压力蒸汽灭菌锅,上海申安医疗器械厂;LTI-700恒温培养箱,上海爱郎仪器有限公司;HZP-250全温振荡培养箱,上海精宏实验设备有限公司;HD-1360超净工作台,北京东联哈尔仪器制造有限公司;AL-204电子天平,梅特勒-托利多仪器有限公司;自动微生物鉴定系统,BiOLOG MicoStation。
1.2 实验方法
1.2.1 产GOD细菌初步筛选
称取5 g海泥加入装有100 mL无菌生理盐水的锥形瓶中,制成原液,然后按10倍稀释法用无菌生理盐水将样品原液依次稀释成10-2、10-3、10-4、10-5和10-6溶液。用移液枪分别吸取1 mL的10-4、10-5、10-6稀释溶液加入筛选培养基平皿中,设计3组平行实验,置于25 ℃下培养5 d左右,观察菌落及其周围培养基是否出现蓝紫色透明圈。挑选蓝紫色透明圈的菌落进行纯化培养。
1.2.2 产GOD优势细菌株的重复筛选及其酶活性检测
将初筛得到的纯化菌株接种到发酵培养基,置于25 ℃摇瓶发酵4 d,摇床转速160 r/min。在96孔板中依次加入质量分数为5%葡萄糖溶液150 μL,邻联茴香胺溶液150 μL和辣根过氧化物酶溶液10 μL,并将该反应体系置于25 ℃恒温静置10 min,然后加入10 μL粗酶液。设定酶标仪波长为460 nm,每间隔1 min测定吸光度A,连续测量5 min,设置3组平行实验。根据公式(1)、(2)和(3)计算酶活[19]:
(1)
(2)
(3)
式中:11.3,消光系数;t,反应时间,min;V1,酶液体积,mL;V2,反应液总体积,mL;f,酶液稀释倍数。
1.2.3 菌株鉴定
参考相关文献[20-22],观察菌落在平板上形状、大小、透明度、颜色、边缘和表面等特征。
利用自动微生物鉴定系统对菌株8-III进行明胶液化、牛奶凝固与胨化、淀粉酶的活性、纤维素生长试验、硫化氢试验、碳源的利用等生理生化鉴定。
将样品送往大连宝生物公司进行16S rDNA鉴定。
1.2.4 紫外诱变
菌体在斜面培养后用20 mL生理盐水重悬,倒入空平板中,并将平板置于磁力搅拌器上搅拌,在20 W紫外灯照射下,处理5、10、15、20、25 min[23-24]。然后稀释涂布,25 ℃培养2~3 d。
1.2.5 化学诱变
此次个人所得税法改革取得的突破性进展,就是实现了从分类征收到综合与分类相结合的税制,而迈出这一步,中国用了22年时间。
取0.4 mL菌液,加入0.5 mL醋酸缓冲液(0.2 mol/L,pH 4.4),再加入0.1 mL(5 mg/mL)亚硝酸钠溶液,于25 ℃条件下处理一定时间(10、20、30、40、50 min)后,加入5倍的pH 8.6磷酸缓冲液解毒,重悬后涂布,在25 ℃条件下培养2~3 d[25-26]。
1.2.6 复合诱变
复合诱变采用先紫外诱变,后化学诱变的方法。
1.2.7 优良突变菌株的传代试验
对诱变得到的菌株进行酶活测定,将高酶活的优良突变菌株在平板上转接5代,发酵后测定产酶活力,确定其产酶能力是否稳定。
1.2.8 粗酶液制备
将发酵液8 000 r/min离心15 min。取上清液加入饱和(NH4)2SO4溶液至(NH4)2SO4饱和度达到80%,4 ℃过夜。10 000 r/min离心20 min,弃上清,用pH 7.4磷酸缓冲液吹打沉淀至完全溶解,过夜透析。倒入G-100葡聚糖凝胶柱中,用pH 7.4磷酸缓冲液洗脱,并记录峰值。收集含GOD的过柱液备用。
1.2.9 酶学性质研究
酶最适作用温度:将适当稀释的酶液分别在0、5、10、15、20、25、30、35、40、45、50、55、60 ℃下进行反应,并按照 1.2.2的方法进行酶活测定。定义酶活最高者为100%,计算相对酶活,从而确定该酶的最适作用温度。
酶的热稳定性:将适当稀释的酶液分别放到0、5、10、15、20、25、30、35、40、45、50、55、60 ℃下保温1 h,每隔30 min取样,在冰上放置5 min后进行酶活测定。定义未进行热处理的酶液的酶活为100%,计算相对酶活,以确定重组GOD的热稳定性。
酶最适作用pH值:配制pH分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的PBS缓冲液,将酶液与缓冲液混合稀释后进行反应,然后按照1.2.2的方法进行酶活测定。定义酶活最高者为100%,计算相对酶活,从而确定GOD酶的最适作用pH。
酶的pH值稳定性:分别将酶液在pH为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5和10.0的PBS缓冲液中保温30 min(温度为25 ℃),并按照1.2.2的方法进行酶活测定。定义未经保温处理的酶活为100%,计算残余酶活力,从而确定GOD酶的pH稳定性。
金属离子对酶活影响:在酶活测定反应体系中加入Na+、K+、Ca2+、Mg2+、Fe2+、Cu2+、Mn2+、Fe3+、Zn2+、Ba2+及乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA),浓度为0.35 mmol/L,然后按照1.2.2的方法进行酶活测定。定义不加入任何金属离子的反应体系的酶活为100%,计算不同金属离子或化合物下的相对酶活。
2 结果与分析
2.1 产低温GOD菌株的筛选
通过对海泥样品的初步筛选,得到107株菌,分别进行摇瓶发酵复筛,同时测定产胞外GOD活力,得到有酶活细菌3株(见表1),其中菌株8-III产酶活力最高,达到0.75 U/mL,将其作为出发菌株,进行下一步研究。

表1 野生菌株酶活力Table 1 Enzyme activity of wild strain
2.2 菌株8-III的鉴定
2.2.1 形态特征鉴定
菌株8-III在LB培养基上生长快速,25 ℃培养3 d,直径5~8 mm,菌落呈现乳白色(见图1-a),有轻微酸味。通过扫描电镜观察,该菌株为无芽孢的中等大小的直杆菌,大小为2.63 μm×(0.276~0.561) μm。菌体两端钝圆,多成对存在,也有散在(图1-b)。
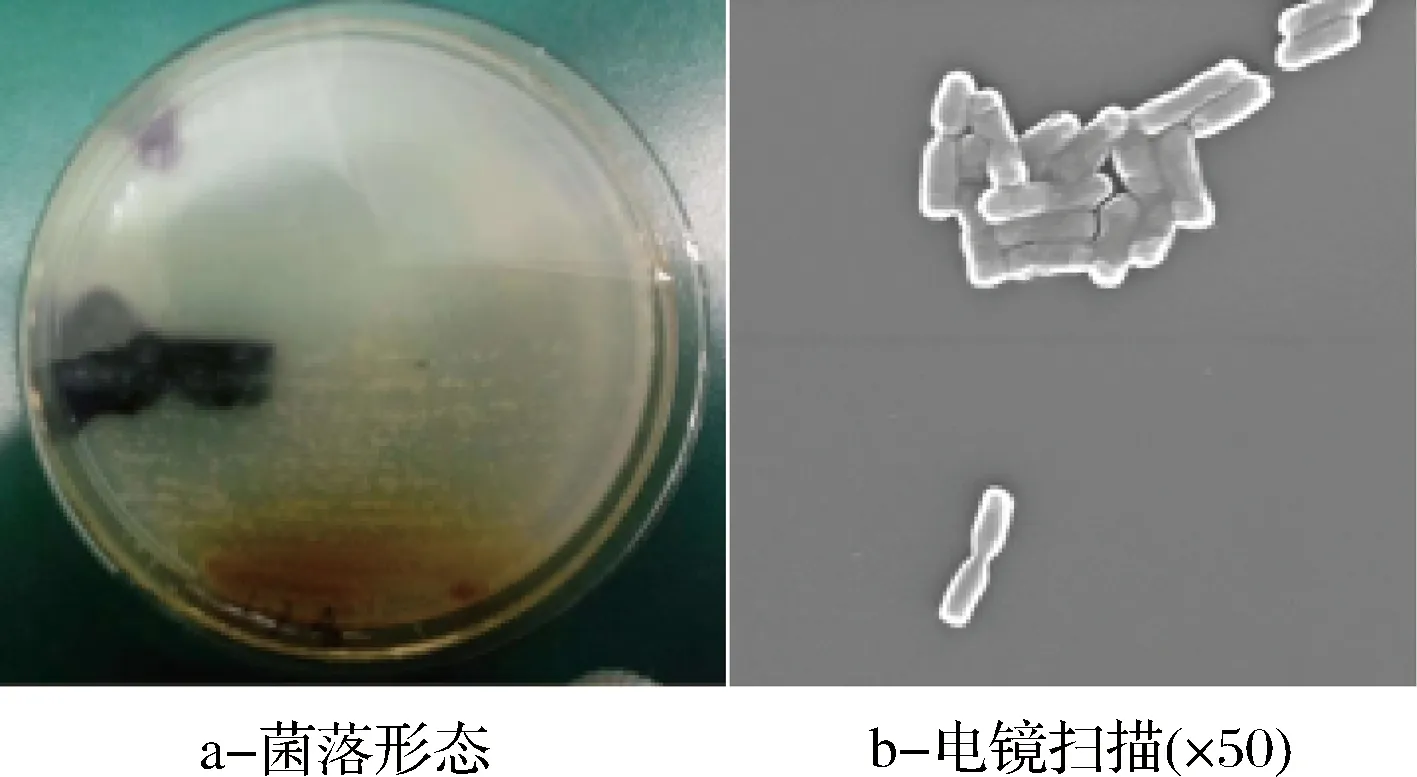
图1 菌株8-III的菌落形态(a)和电镜扫描(b)Fig.1 Strain 8-III colony morphology(a) and electron microscopy(b)
2.2.2 生理生化特性鉴定
菌株经自动微生物鉴定系统鉴定的结果如表2所示。8-III与柠檬酸杆菌(Citrobacterfreundiistrain ATCC 8090)的相似度为99%,初步鉴定为柠檬酸杆菌属。

表2 8-III菌株部分生化特征Table 2 Partly biochemical characteristics of strain 8-III
注:“+”为阳性;“-”为阴性。
2.2.3 分子生物学鉴定
菌株8-III的形态学特征和培养特征与柠檬酸杆菌非常相近,为进一步确定其种属,对其进行16S rDNA测序。将结果与GenBank数据库基因序列进行比较,搜索得到同源性达到99%以上的菌株,均为柠檬酸杆菌。结合形态学特征和培养特征综合比较,确定菌株8-III为柠檬酸杆菌属,系统发育树如图2所示。

图2 菌株8-III及其相关菌株 16S rRNA基因构建的系统发育树Fig.2 Phylogenetic tree constructed by the neighbor-joining approach based on the 16S rRNA gene of strain 8-III and related strain
2.3 菌株诱变结果
2.3.1 紫外诱变结果
绘制紫外诱变致死率曲线,从图3可以看出,随着紫外诱变时间的延长,菌体致死率明显上升,紫外照射10 min后,菌体的致死率已经达到92.79%。工业育种一般以存活率小于10%的照射量为诱变育种的参考量。故本实验选取10 min的紫外诱变时间,进行诱变育种。将菌株8-III在紫外条件下处理10 min后,共得到诱变菌株69株,测定其产GOD酶活力。最终得到4株菌株的产酶能力有较大提高,其中突变菌株8-III-a9的产酶活力提高最大,达到原始菌株的1.96倍(表3)。

图3 菌株8-III紫外诱变致死率曲线Fig.3 UV mutagenic lethal rate of strain 8-III

菌株酶活/(U·mL-1)提升率/%8-III100±2.308-III-a9196±4.2968-III-a22137±1.9378-III-a41169±7.6698-III-a58162±5.562
2.3.2 化学诱变
由图4可知,随着化学诱变时间的延长,菌体致死率上升,诱变30 min后,菌体的致死率已经达到93.3%。故本实验选取30 min进行化学诱变育种。将菌株8-III经NaNO2处理30 min后,稀释涂布在LB固体平板上,25 ℃培养3 d,共得到菌株57株。25 ℃,160 r/min摇瓶发酵2 d,测定GOD酶活,有2株菌株的产酶活力有较大提高,结果如表4所示。

图4 菌株8-III化学诱变致死率曲线Fig.4 Mortality rate of chemical mutagenesis of strain 8-III

菌株名称酶活/(U·mL-1)提升率/%8-III100±2.308-III-b12134±1.5348-III-b49126±1.826
2.3.3 复合诱变结果
先紫外照射10 min,再避光化学处理30 min。涂布筛选,得菌株63株,测定其产GOD酶活力,有7株菌株的产酶活力有较大提高,结果如表5所示。其中,复合诱变后菌株8-III-a44产酶量提高2.36倍。

表5 复合诱变结果Table 5 Results of combined mutagenesis
2.4 突变菌株遗传稳定性
对产酶活力提高较大的4株突变株(8-III-c3、8-III-c25、8-III-c44、8-III-a9)进行传代稳定性检测,结果如表6所示。8-III-c3从第3代开始,酶活力明显降低,而8-III-c25、8-III-c44、8-III-a9经传代后酶活稳定。

表6 突变菌株遗传稳定性试验Table 6 Genetic stability of mutants
2.5 酶学性质分析
复合诱变菌株8-III-a44酶活力最高且传代稳定性最好,因此对菌株8-III-a44所产GOD进行酶学性质研究。
2.5.1 酶最适作用温度
如图5所示,酶的最适反应温度为15 ℃,10~35 ℃相对酶活力可以保持在80%以上,高于35 ℃相对酶活力逐渐下降。此外该酶在0 ℃时相对酶活达到60%,符合低温酶特性。

图5 温度对酶活影响Fig.5 Effect of temperature on enzyme activity
2.5.2 酶的热稳定性
如图6所示,15 ℃为该酶适宜作用温度,在10~35 ℃时该酶可保持80%以上的相对酶活,40 ℃后稳定性迅速下降。此外,该酶在0 ℃时可保持60%以上相对酶活且稳定性快速提升,10 ℃后可达到80%以上相对酶活,说明该酶具有低温酶特性,在低温下仍可长时间保持较高酶活力。
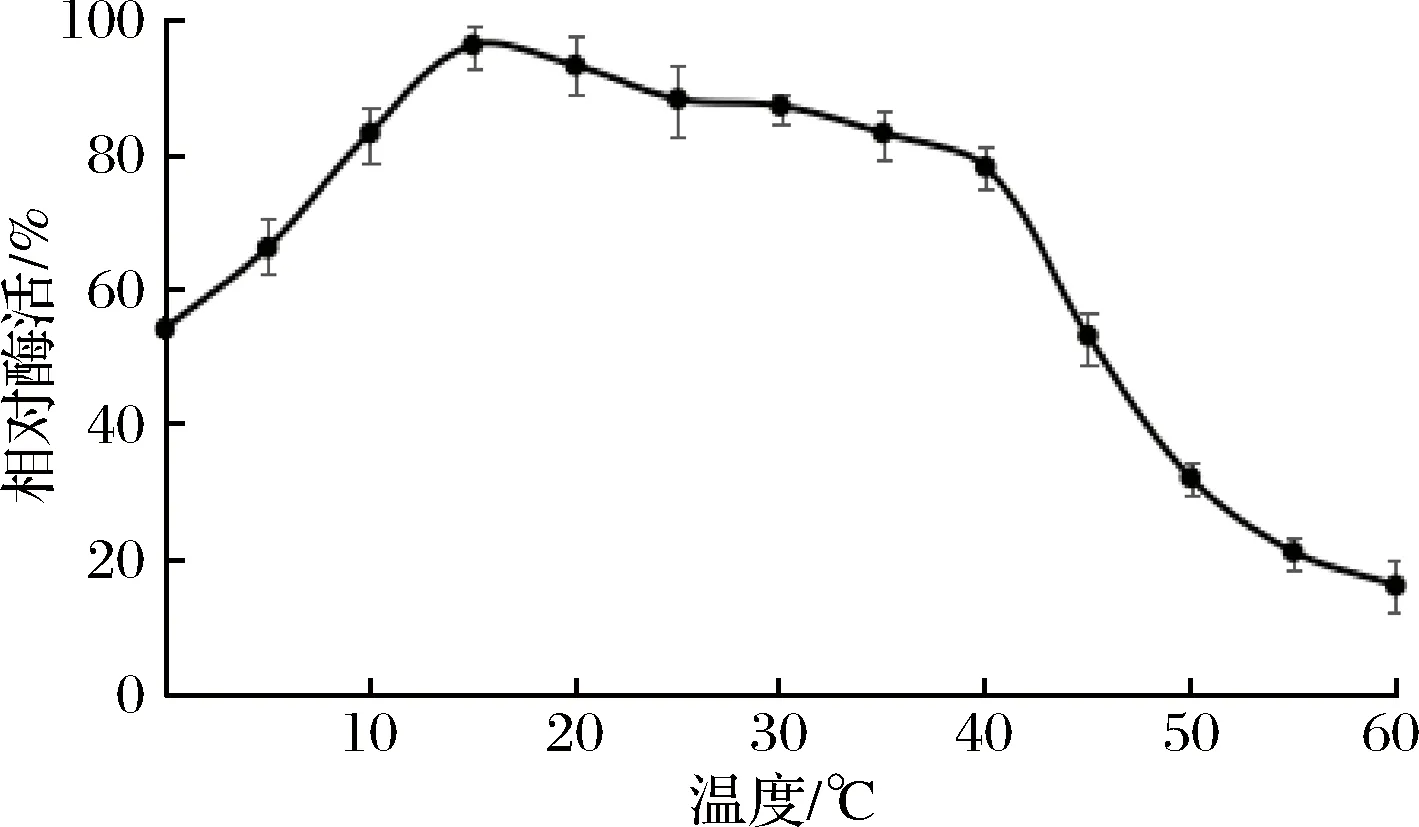
图6 酶的热稳定性Fig.6 Enzyme activity and thermal stability
2.5.3 酶最适作用pH值
将菌株8-III-a44所产GOD在pH 4.0~9.0以0.5为梯度孵育5 min,结果如图7所示。酶的最适反应pH值为6.5,在pH值为6.0~7.5时,有80%以上的相对酶活,表明该酶属于中性GOD。
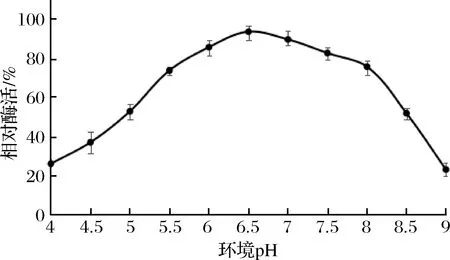
图7 pH值对酶活力的影响Fig.7 Influence of pH on enzymatic activity
2.5.4 酶的pH值稳定性
将菌株8-III-a44所产GOD在pH 4.0~10.5以0.5为梯度孵育30 min,结果如图8所示。该酶在pH 6.5时稳定性最好,在pH 5.5~7.5酶稳定性可保持80%以上相对酶活力,pH 9.5以后稳定性快速降低。推测GOD在pH 9.5以上会产生结构变化,影响酶活。
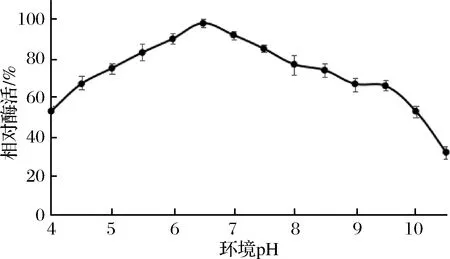
图8 酸碱稳定性Fig.8 Acid-base stability
2.5.5 金属离子及螯合剂对酶活的影响
由表7可知,K+、Ni2+对GOD的活性有明显促进作用;Na+、Fe3+对诱变菌株GOD活性有一定抑制作用,但残留相对酶活保持在50%以上;Cu2+、Ag+、Ca2+、Fe2+、EDTA对诱变菌株GOD活性抑制明显,残留相对酶活在30%以下,甚至没有酶活。这可能是由于这些离子与酶中心的功能基团结合,进而引起酶失活。

表7 金属离子及螯合剂对8-III-a44酶活力的影响Table 7 Effects of metal ions and chelating agents on 8-III-a44 enzyme activity
3 结论
本实验从海泥中分离得到产GOD的细菌8-III,经紫外诱变、亚硝酸盐诱变和二者复合诱变后酶活力提升2.36倍,说明诱变育种对提升GOD酶活力是一种有效的手段。但诱变菌株8-III-a44酶活力相对于工业生产菌株的酶活力还有一定差距,如何运用其他手段提升酶活力将会是一个新的研究方向。此外,菌株8-III-a44所产GOD在20 ℃以下时仍具有较高酶活并且稳定性良好,在饲料低温处理方面有很好的应用前景。因此8-III-a44具有潜在的开发利用价值,为GOD的工业生产提供新型的菌株。

