斑蝥素酸镁诱导BEL-7402 人肝癌细胞凋亡的机制
黄渝茜, 晏旭航, 晏 容,, 刘 云, 杨明洁, 陈威天, 古宸廷, 李 埝,罗明星, 李晓飞,∗
(1.遵义医学院基础医学院,贵州 遵义563000;2.遵义医学院贵州省普通高等学校特色药物肿瘤防治特色重点实验室,贵州 遵义563000)
斑蝥是一种重要的抗肿瘤虫类中药,对原发性肝癌可达到良好效果[1-2]。课题组前期研究发现,斑蝥体内含有游离斑蝥素和斑蝥素盐类物质,主要包括斑蝥素酸钙、斑蝥素酸镁、斑蝥素酸钾等[3-4],其中斑蝥素酸镁对肝癌治疗效果较游离斑蝥素和其他斑蝥素盐类物质效果更佳[5-7];后续研究发现,经过斑蝥素酸镁作用后肝癌细胞出现凋亡现象[8-9],但具体机制不清。因此,本实验观察斑蝥素酸镁对人肝癌细胞BEL-7402 增殖抑制和凋亡诱导作用,并与同为蛋白磷酸酶2 A(PP2A) 抑制剂的促癌物冈田酸进行比较,探讨斑蝥素酸镁的抗肝癌机制,为其进一步研发提供依据。
1 材料
1.1 试药 斑蝥素酸镁是将斑蝥素与氢氧化镁反应制备而来,干燥后得到白色结晶粉末,含有量在90%以上;斑蝥素酸镁由课题组自主合成,制备方法已授权国家发明专利(ZL201110149288.5)[10]。 冈田酸购自美国Sigma公司。BEL-7402 人肝癌细胞株购自中国科学院上海细胞库;RMPI-1640 购自美国Gibco 公司;胎牛血清、0.25%胰蛋白酶购自美国HyClone 公司;活性氧(ROS)、线粒体膜电位、Annexin V-FITC 细胞凋亡检测试剂盒、HRP 标记山羊抗兔二抗、HRP 标记羊抗鼠二抗购自上海碧云天生物技术有限公司;BCA 蛋白定量试剂盒购自美国Thermo 公司;兔抗细胞外调节蛋白激酶(ERK1/2) 单克隆抗体、兔抗磷酸化ERK1/2多克隆抗体、兔抗Cyt-C 多克隆抗体、小鼠抗半胱天冬酶-3(Caspase-3) 单克隆抗体、兔抗裂解半胱天冬酶-3(Cleaved-Caspase-3) 多克隆抗体均购自英国Abcam公司。
1.2 仪器 3131 型CO2培养箱、Multiskan spectrum 全波长酶标仪,购自美国Thermo 公司;超净工作台,购自苏州净化设备有限公司;FC500 MCL 流式细胞仪,购自美国Beckman 公司;mini protean 3 cell 电泳仪,购自美国Bio-Rad 公司;SP-9 型电转仪,购自大连竞迈科技有限公司。
2 方法
2.1 细胞培养 完全培养基(RPMI1640) 培养细胞,并置于37 ℃、5%CO2培养箱中,待细胞在培养瓶长成致密单层时用于后续实验。
2.2 磺酰罗丹明B(SRB) 染色法 将对数生长期细胞接种于96 孔板中,1 块作为对照组(T0),另1 块作为实验组(T)。培养20 h 后将T0取出,预冷的50%三氯乙酸(TCA)固定[11],实验板中加入不同浓度(1.668、3.336、5.004、6.672 μmol/L) 斑蝥素酸镁,同时以加入等量培养基的肿瘤细胞作为空白对照组(C),实验组、空白对照组分别设5 个复孔,培养24 h 后参照文献[12] 报道进行固定、染色、溶解,于530 nm 处测定光密度(OD) 值,计算细胞生长抑制率,公式为生长抑制率= [1-ODT-ODT0/ODC-ODT0] ×100% (设置对照组是为了排除加药前细胞生长速度差异对最终细胞生长的影响,能更好地反映药物对肿瘤细胞增殖的抑制作用)。
2.3 细胞凋亡率检测 细胞按1×104/孔密度接种于6 孔板,37 ℃、5%CO2培养箱中培养20 h,再分别加入配置好的冈田酸 (终浓度0.072 nmol/L) 和不同浓度 (2.43、4.86、9.72 μmol/L) 斑蝥素酸镁,对照组加等量培养基,每组平行3 次,37 ℃、5%CO2培养箱中培养24 h。然后,采用Annexin V-FITC 细胞凋亡检测试剂盒说明书进行操作,流式细胞仪进行检测,Annexin V-FITC 为绿色荧光,对应BD 流式细胞仪FL1 检测通道;碘化丙啶(PI) 为红色荧光,对应BD 流式细胞仪FL2 检测通道。
2.4 活性氧(ROS) 水平检测 同法培养细胞和分组,按照ROS 检测试剂盒说明进行操作。收集细胞后,加入500 μL DCFH-DA 工作液(10 μmol/L),无血清细胞培养液洗涤细胞1~2 次,流式细胞仪检测荧光信号,通过CXP软件进行分析。
2.5 线粒体膜电位检测 同法培养细胞和分组,按照线粒体膜电位检测试剂盒说明进行操作。收集细胞后,加入0.5 mL JC-1 染色工作液,颠倒数次混匀,细胞培养箱中37 ℃下孵育20 min,37 ℃孵育结束后,4 ℃下600×g 离心3~4 min,沉淀细胞,弃上清后用预先配置好的JC-1 染色缓冲液 (1X) 洗涤2 次,加入1 mL JC-1 染色缓冲液(1X) 重悬细胞,4 ℃下600×g 离心3 ~4 min,沉淀细胞,弃上清,再加入1 mL JC-1 染色缓冲液(1X) 重悬细胞,4 ℃下600×g 离心3~4 min,沉淀细胞,弃上清,适量JC-1染色缓冲液(1X) 重悬后上流式细胞仪检测[13]。然后,通过CXP 分析软件进行分析。
2.6 细胞色素c(Cyt-C)、半胱天冬酶-3(Caspase-3)、裂解半胱天冬酶-3(Cleaved-Caspase-3)、细胞外调节蛋白激酶(ERK1/2) 蛋白磷酸化表达检测 采用Western blot 法。细胞加药培养24 h 后弃上清,收集细胞,RIPA 裂解,提取蛋白。BCA 定量后,20 μg 提取蛋白进行SDS-PAGE 电泳,半干式电转至硝酸纤维素膜后室温封闭1 h,一抗(GAPDH,1 ∶ 10 000; ERK1/2,1 ∶ 1 000; p-ERK1/2,1 ∶1 000;Cyt-C, 1 ∶ 1 000; Caspase-3, 1 ∶ 1 000;Cleaved-Caspase-3,1 ∶800)4 ℃下孵育过夜,TBST 漂洗3次,每次5 min,置于HRP 标记羊抗兔二抗(或HRP 标记羊抗鼠二抗) (1 ∶10 000)37 ℃下孵育1 h,TBST 漂洗3次,每次5 min,将其浸入ECL 液中2 min。最后,X 光胶片进行曝光、显影、定影,并进行灰度分析。
2.7 统计学方法 通过SPSS 17.0 软件进行处理,数据用表示,组间比较采用单因素方差分析。P<0.05 表示有显著性差异。
3 结果
3.1 斑蝥素酸镁对BEL-7402 人肝癌细胞的抑制作用 图1 显示,1.668 μmol/L 斑蝥素酸镁对细胞有明显抑制作用,并随着其浓度升高抑制率逐渐增大。以斑蝥素酸镁浓度为横坐标(X),纵坐标为抑制率(Y) 进行回归,得方程为Y=13.765X-16.95(R2=0.995 4),IC50为4.86 μmol/L。
3.2 斑蝥素酸镁对BEL-7402 人肝癌细胞凋亡率的影响图2 显示,斑蝥素酸镁组细胞凋亡率与对照组比较均显著增加(P<0.01),并呈浓度依赖效应,但冈田酸组显著减少(P<0.01)。
3.3 斑蝥素酸镁对ROS 水平的影响 图3 显示,与对照组比较,2.43 μmol/L 斑蝥素酸镁组ROS 水平显著增加(P<0.01),并呈浓度依赖效应,但冈田酸组显著减少(P<0.05)。
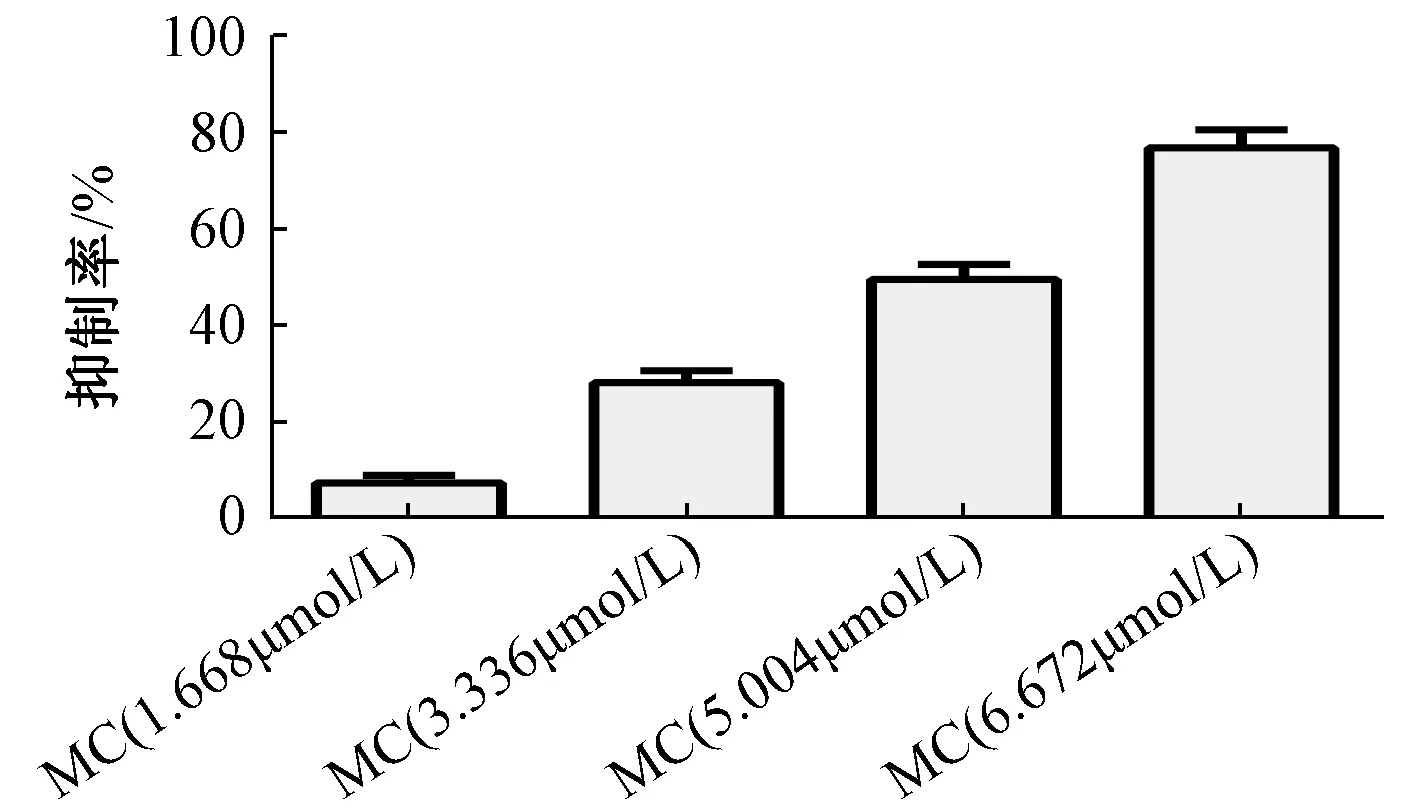
图1 斑蝥素酸镁对BEL-7402 人肝癌细胞的抑制作用
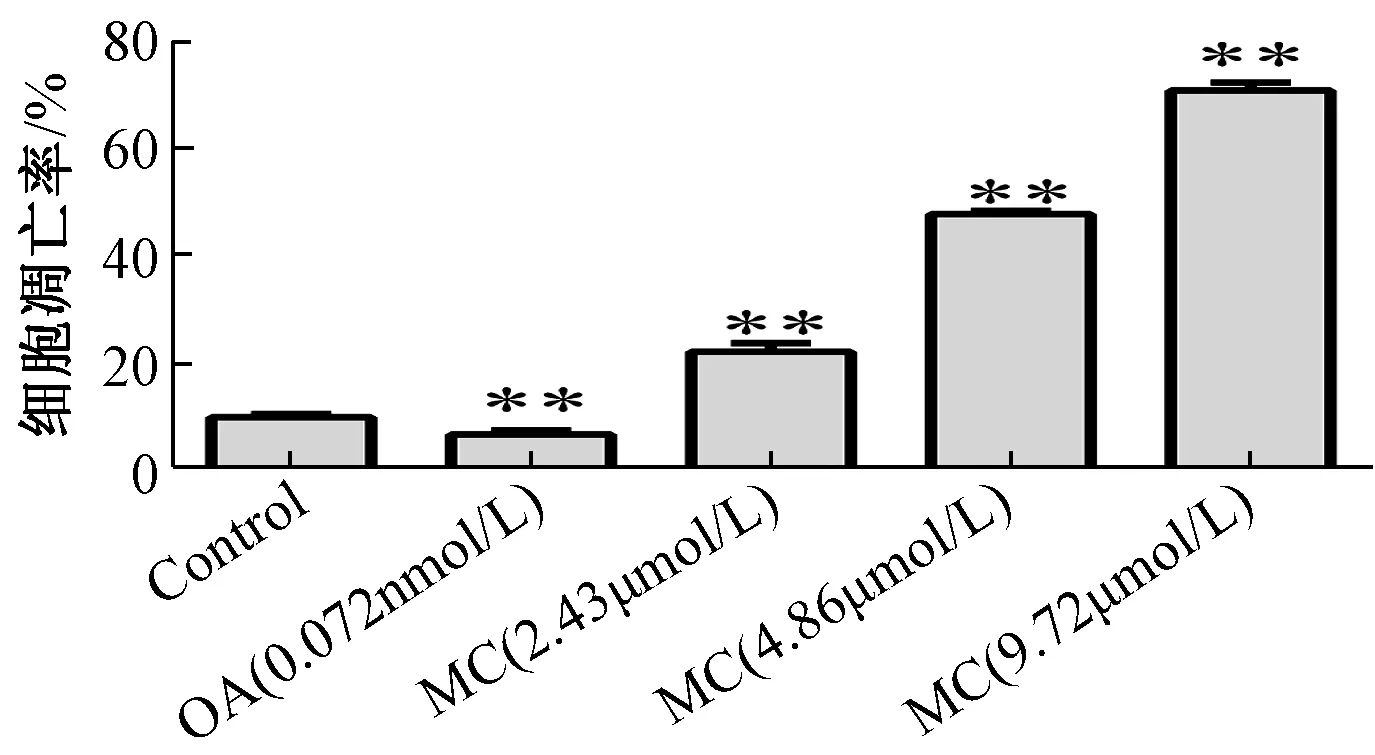
图2 斑蝥素酸镁对BEL-7402 人肝癌细胞凋亡率的影响
3.4 斑蝥素酸镁对线粒体膜电位的影响 图4 显示,斑蝥素酸镁组线粒体膜电位与对照组比较均显著降低 (P <0.01),并呈浓度依赖效应,但冈田酸组无显著变化(P>0.05)。
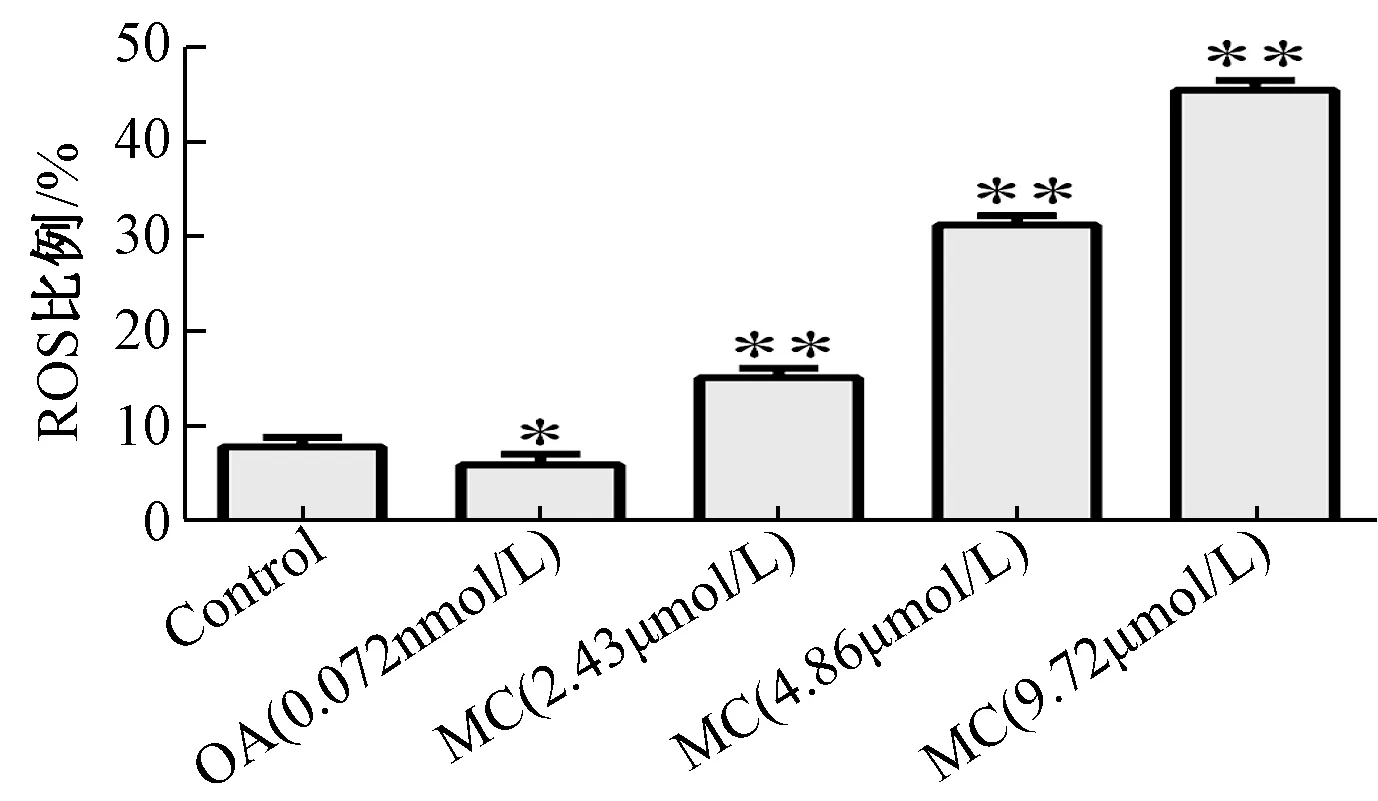
图3 斑蝥素酸镁对ROS 水平的影响
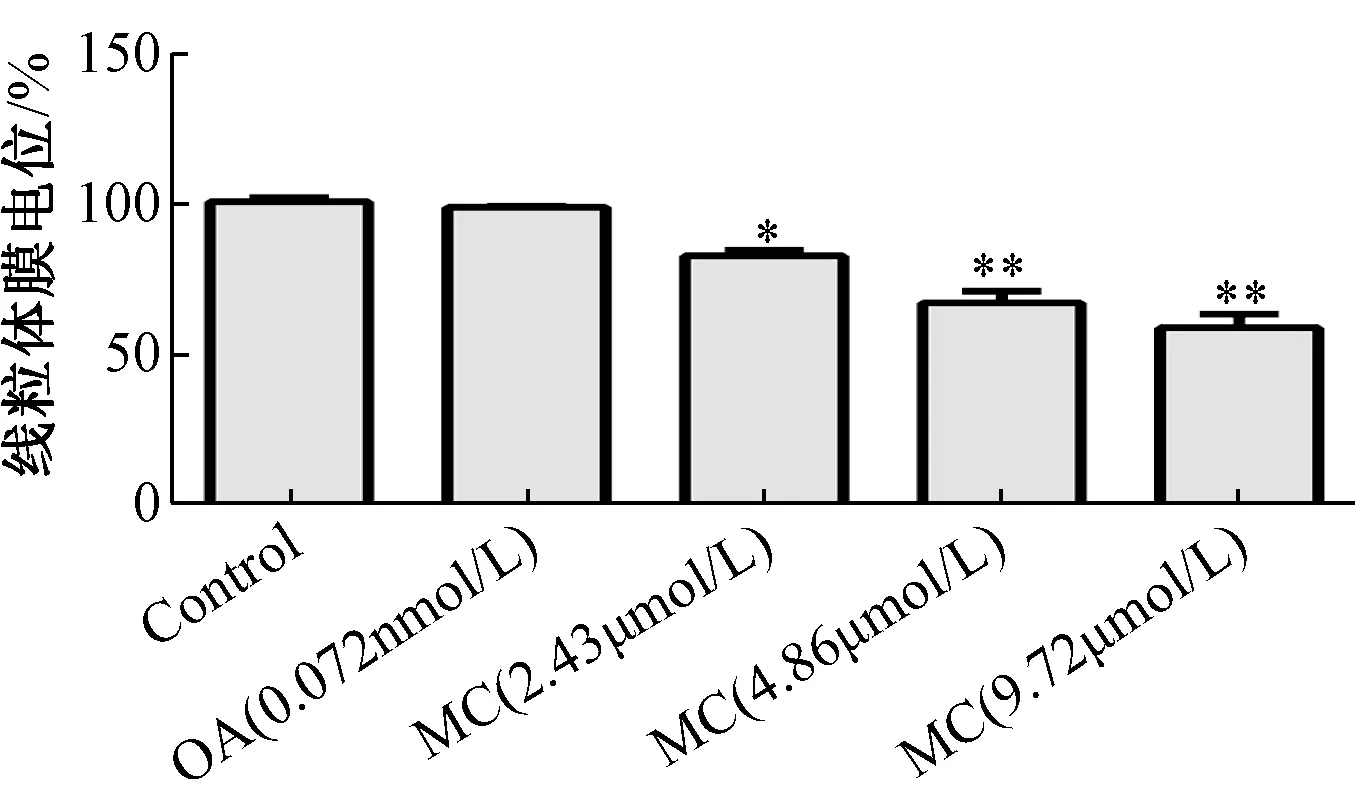
图4 斑蝥素酸镁对线粒体膜电位的影响
3.5 斑蝥素酸镁对Cyt-C、Cleaved Caspase-3、Caspase-3 蛋白表达的影响 图5 显示,与对照组比较,2.43 μmol/L 斑蝥素酸镁组Cyt-C、Cleaved-Caspase-3、Caspase-3 蛋白表达显著上调(P<0.01),并呈浓度依赖效应,但冈田酸组显著下调(P<0.01)。
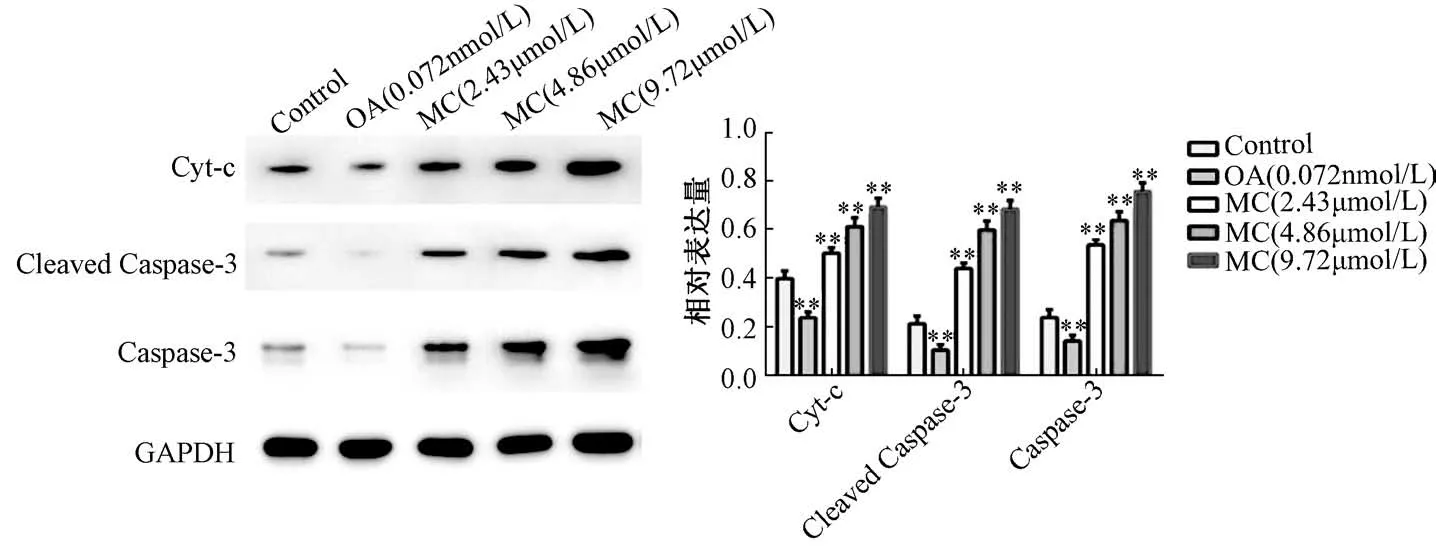
图5 斑蝥素酸镁对Cyt-c、Cleaved Caspase-3、Caspase-3 蛋白表达的影响
3.6 斑蝥素酸镁对ERK1/2 蛋白磷酸化表达的影响 图6显示,与对照组比较,2.43 μmol/L 斑蝥素酸镁组ERK1/2蛋白磷酸化表达显著下降(P<0.01),并呈浓度依赖效应,但冈田酸组显著上升(P<0.01)。
4 讨论
细胞凋亡是一种多种基因调控的主动程序化死亡过程,经典的途径分为3 条,包括死亡受体、线粒体凋亡、内质网应激[14],其中在动物细胞中线粒体途径是最普遍的凋亡机制和细胞凋亡核心[15]。在细胞凋亡过程中,线粒体产生大量ROS,引起线粒体膜电位下降,cyt-C 释放到细胞浆中,从而激活半胱天冬酶-9(Caspase-9), 并激活下游Caspase-3[16-17],它是Caspase 家族重要组成部分,在凋亡过程中充当凋亡执行蛋白者的角色[18-19],而Caspase-3 活化过程中能产生Cleaved Caspase-3,其活性和细胞凋亡情况可由表达程度反映[20],本实验发现2.43 μmol/L 斑蝥素酸镁作用24 h 后能显著升高肝癌细胞内ROS 水平,具有浓度依赖效应。细胞凋亡过程中首先会引起活性氧大量增加,线粒体功能发生障碍,释放cyt-C[17],本实验发现斑蝥素酸镁组线粒体膜电位明显下降,cyt-C 表达明显升高,符合上述理论。在此基础上,又检测凋亡执行蛋白Caspase-3、Cleaved Caspase-3 蛋白表达,发现斑蝥素酸镁组两者明显升高,具有浓度依赖效应,表明该成分可能通过线粒体凋亡途径来诱导BEL-7402 人肝癌细胞发生凋亡。
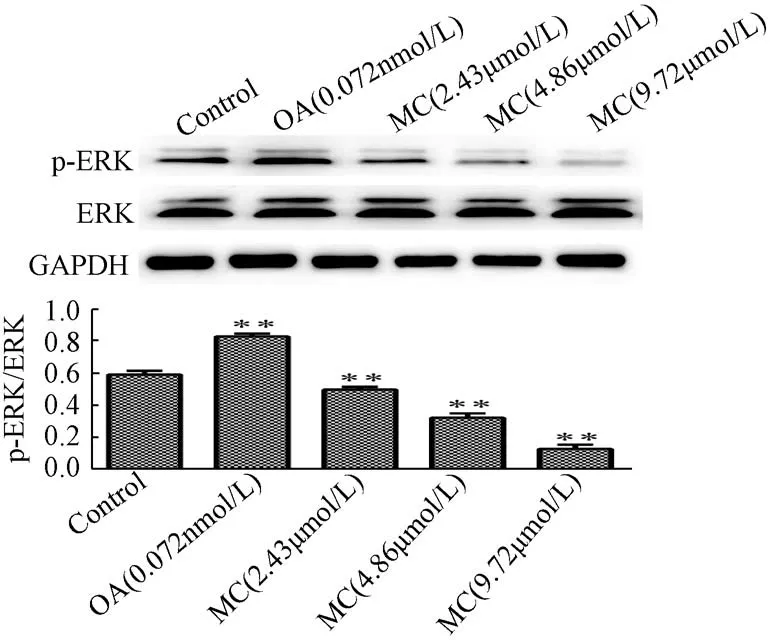
图6 斑蝥素酸镁对ERK1/2 蛋白磷酸化表达的影响
课题组前期发现,斑蝥素酸镁能显著下调人肝癌细胞SMMC-7721 的ERK1/2 磷酸化水平,提示ERK1/2 通路可能在该成分抑制肝癌细胞生长中发挥重要作用。细胞外信号调节激酶1/2(ERK1/2) 是细胞内重要的信号蛋白,属于增殖相关蛋白激酶(MAPK),在调控细胞凋亡中发挥重要作用[21],前期报道苦参碱衍生物WM130 诱导肝癌细胞凋亡与ERK1/2 通路的抑制密切相关[22],本实验结果与其相符,即2.43 μmol/L 斑蝥素酸镁组ERK1/2 蛋白磷酸化表达显著下调,具有浓度依赖效应,而细胞凋亡率却明显升高,提示ERK1/2 通路可能与斑蝥素酸镁诱导的BEL-7402人肝癌细胞凋亡呈负相关。
研究表明,丝裂原活化蛋白激酶(MAPK) 信号通路可以将凋亡信号传递给线粒体[23],线粒体凋亡途径主要包含B 淋巴细胞瘤-2 基因(Bcl-2) 家族成员,它和BCL-2-Associated X 的蛋白质(Bax) 在细胞中凋亡中发挥着重要的调节作用[24]。据文献[25] 报道,大黄素能抑制细胞中ERK1/2 磷酸化,随之Bcl-2 表达下调,cyt-C 释放到胞浆,最终引起Caspase-3 活化,引起细胞凋亡的发生;本实验发现,斑蝥素酸镁可明显降低线粒体膜电位,导致cyt-C 释放,进而激活Caspase-3,同时还能明显抑制ERK1/2 磷酸化水平,故推测斑蝥素酸镁可能通过抑制ERK1/2 磷酸化水平,反向调节线粒体凋亡途径,最终诱导BEL-7402 人肝癌细胞发生凋亡,但对ERK1/2 通路具体调节线粒体凋亡途径的机制还有待进一步研究。

