血清高迁移率族蛋白B1、血小板平均体积在急性胰腺炎患者病情及预后中的价值
汪武贵,周勇,李伟,卢小岗,湛小波
急性胰腺炎(acute pancreatitis,AP)是胰腺的急性炎性反应,以急性上腹痛、恶心、呕吐、发热和血胰酶增高等为主要特点,是临床常见的急腹症[1-3]。大多数患者以胰腺水肿为主,病情呈自限性、预后良好,称为轻症AP[4]。少数患者可出现胰腺出血坏死,导致多种并发症发生和多器官衰竭,病死率高、预后差,称为重症AP。轻症AP中有10%~20%的患者病情恶化可发展为重症AP,而重症AP的病死率可达20%以上[5]。目前认为,早期准确评估AP患者病情,并以此为指导制定合理的治疗方案,对改善患者预后有重要意义。血小板平均体积(mean platelet volume,MPV)是血小板活化的一个重要指标,近年来研究认为[6],在AP疾病的进展过程中血小板的体积和功能存在明显变化。高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)是一种促炎性因子,近年来研究表明,HMGB1在AP的发生、发展中起到重要作用[7]。现分析HMGB1、MPV与AP患者病情严重程度及预后的关系,以期为临床评估提供数据支持,报道如下。
1 资料与方法
1.1 临床资料 选取2017年8月—2018年8月陆军军医大学第二附属医院急诊科收治的AP患者143例作为研究对象,根据病情严重程度分为轻症AP组(n=71)和重症AP组(n=72)。轻症AP组男42例,女29例,年龄34~59(41.29±3.29)岁;发病时间6~48(29.64±3.71)h;疾病类型:酒精性19例,饮食性16例,特发性19例,混合性17例;诱因:饮酒27例,胆结石18例,暴饮暴食20例,其他6例;症状:急性上腹痛21例,恶心、呕吐20例,发热18例,血胰酶增高12例;基础疾病:高血压12例;吸烟史18例,酗酒史22例,阳性家族史8例。重症AP组男46例,女26例,年龄33~59(41.49±4.02)岁;发病时间5~46(30.18±4.06)h;疾病类型:酒精性21例,饮食性17例,特发性21例,混合性13例;诱因:饮酒25例,胆结石19例,暴饮暴食22例,其他6例;症状:急性上腹痛19例,恶心、呕吐23例,发热16例,血胰酶增高14例;基础疾病:高血压9例;吸烟史16例,酗酒史24例,阳性家族史6例。另选取同期于医院行健康体检的志愿者60例为健康对照组,其中男38例,女22例,年龄32~58(40.17±3.72)岁。3组患者性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,所有研究对象知情且签署知情同意书。
1.2 选择标准 纳入标准:(1)所有患者临床症状、影像学检查和实验室检查均符合“中国急性胰腺炎诊治指南”[8]中的相关标准;(2)患者均于发病时间48 h内入院;(3)患者年龄18~60岁;(4)均为首次发病;(5)患者临床资料齐全;(6)入院时急性生理学和慢性健康状况评分系统(acute physiology and chronic health evaluation score system,APACHEⅡ)评分≥8分。排除标准:(1)伴有糖尿病及慢性炎性反应等全身疾病者;(2)合并其他影响患者心、肝、肾功能的疾病;(3)入组前2周内服用非甾体抗炎药物者;(4)合并恶性肿瘤者;(5)妊娠期或哺乳期妇女;(6)伴有血液病、凝血异常及有明显出血倾向者。
1.3 观察指标与方法
1.3.1 血清学指标检测: AP患者于入院次日、对照组于体检当日采集清晨空腹静脉血9 ml,分为A、B、C管。A管离心取上清液,冻于-70℃冰箱中保存待测。采用酶联免疫吸附试验检测HMGB1水平,试剂盒购自上海信裕生物技术有限公司。B管采用Beckman Coulter LH750全自动血细胞仪检测MPV。C管采用日本奥林巴斯生物公司生产的AU2700全自动生化分析仪检测肝功能指标:丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBil)。
1.3.2 APACHEⅡ评分: APACHEⅡ评分由年龄评分、急性生理学评分、慢性健康状况评分组成,分值越大,疾病严重程度越高[9]。
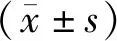
2 结 果
2.1 各组HMGB1、MPV、肝功能、APACHEⅡ评分比较 重症AP组、轻症AP组HMGB1、MPV、APACHEⅡ评分均高于健康对照组,且重症AP组高于轻症AP组(P<0.01);重症AP组ALT、TBil、AST高于健康对照组、轻症AP组(P<0.05);轻症AP组ALT、TBil、AST与健康对照组比较差异无统计学意义(P>0.05),见表1。
2.2 AP患者不同预后组HMGB1、MPV、肝功能、APACHEⅡ评分比较 根据临床结局,将患者好转出院的AP患者作为存活组(n=115),将住院期间死于AP及其并发症者作为死亡组(n=28),其中存活组HMGB1、MPV、ALT、TBil、AST、APACHEⅡ评分均低于死亡组(P<0.01),见表2。
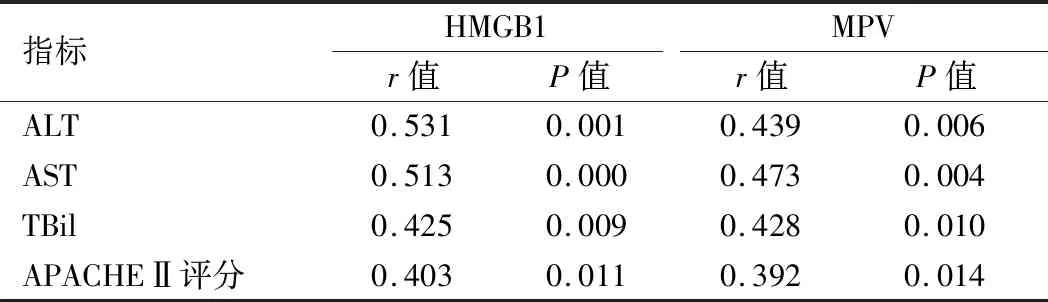
2.3 AP患者HMGB1、MPV与肝功能、APACHEⅡ评分的相关性分析 Pearson相关性分析结果显示,HMGB1、MPV与ALT、TBil、AST、APACHEⅡ评分均呈正相关(P<0.05), 见表3。
2.4 HMGB1、MPV联合检测对AP患者预后的诊断价值
表3HMGB1、MPV与肝功能、APACHEⅡ评分的相关性分析
指标HMGB1r值P值MPVr值P值ALT0.5310.0010.4390.006AST0.5130.0000.4730.004TBil0.4250.0090.4280.010APACHEⅡ评分0.4030.0110.3920.014
2.4.1 HMGB1、MPV指标单独应用对AP的诊断价值: 以本研究资料为样本,将HMGB1、MPV水平划分成8~10个组段,建立ROC诊断分析模型,见图1。经ROC分析发现,二者均有一定的AP诊断价值,在其理论阈值点处,曲线下面积(area under curve,AUC)均>0.7,见表4。
2.4.2 血清HMGB1、MPV指标联合应用对AP的诊断价值: 以2指标各自的阈值为诊断阈值,对各样本做阴性(预后较好)或阳性判断(死亡风险大)。当2指标均为阳性或阴性时给出阳性或阴性的联合诊断,2指标一阴一阳则进行复测,复测未改变时则认可MPV的诊断结果或与临床医师会商。结果:血清HMGB1、MPV联合检测诊断AP的灵敏度和特异度分别为0.805和0.807,较2指标单独应用有明显提高,见表4。
3 讨 论
长期临床实践表明[10],早期客观准确地判断AP患者病情严重程度及预后,并及时进行合理的干预,对于改善AP患者存活率具有积极的临床意义。目前临床主要检测血、尿淀粉酶作为实验室检测指标,但也有不少研究显示血、尿淀粉酶的高低并不一定能如实反映AP患者病情严重程度,且出血坏死型AP患者其血、尿淀粉酶值可能显示正常,甚至低于轻症AP患者[11]。APACHEⅡ评分也常用于评估患者病情,其分值越高,病情越重,预后也越差,但该评分量表具有一定主观性[12]。此外,AP的主要病理变化是胰腺出血或坏死,伴随着疾病进展,可引起全身炎性反应,炎性因子在肝脏内浸润引起肝细胞损伤、破裂,导致肝功能损伤,但肝功能损伤在AP疾病早期表现并不明显[13]。因此,探讨早期评估患者病情程度及预后的灵敏指标具有积极的临床意义。

表1 3组HMGB1、MPV、肝功能、APACHEⅡ评分比较
注:与健康对照组比较,aP<0.05;与轻症AP组比较,bP<0.05

表2 AP患者不同预后组HMGB1、MPV、肝功能、APACHEⅡ评分比较

表4 血清HMGB1、MPV指标诊断AP的ROC分析
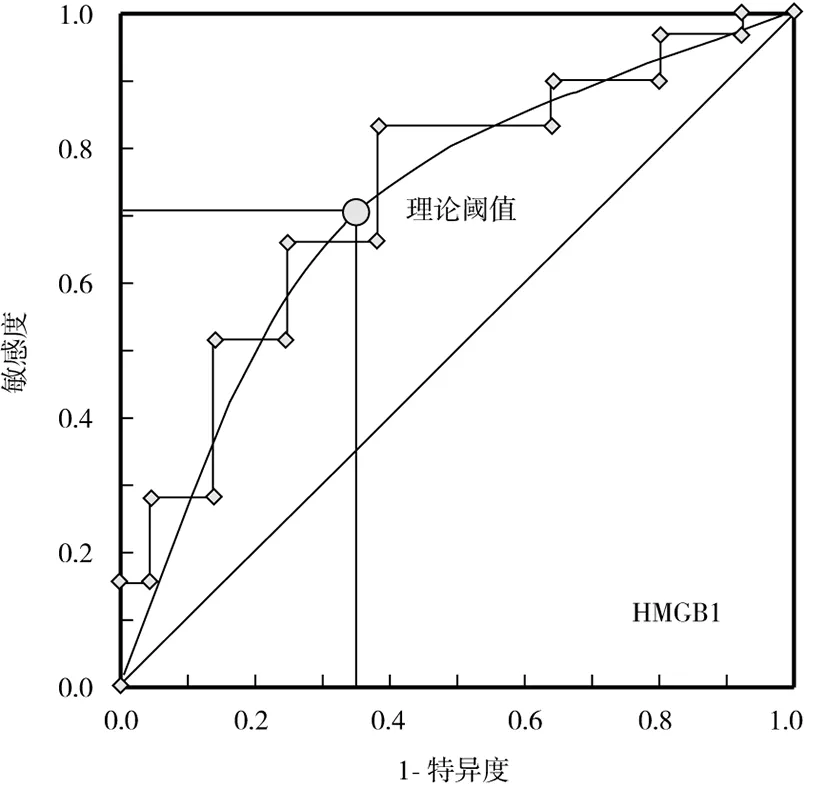
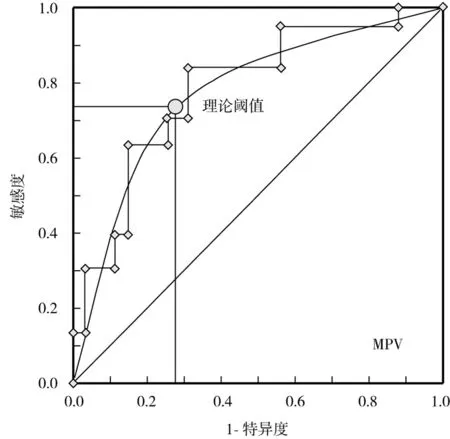
图1 血清HMGB1、MPV指标诊断AP的ROC曲线
HMGB1作为广泛存在于真核细胞的非组蛋白染色体蛋白,对于稳定核小体和调节基因转录有重要作用。当机体处于正常状态时,体内HMGB1水平较低,而当机体处于炎性反应状态时,活化的单核细胞和巨噬细胞可大量分泌HMGB1,加剧机体炎性反应[14]。既往研究表明,HMGB1作为晚期炎性因子,可通过诱导其他炎性因子以及黏附因子分泌等参与炎性瀑布级联反应,对机体器官形成二次打击,加重机体损伤。重症AP患者发病过程中常伴有血小板功能的变化,而血小板的动态变化又可影响该病的预后。近年来MPV作为血小板活性参数,在多种炎性疾病及促血栓事件中成为研究热点[15]。除此以外,MPV作为临床常用检测指标,检测成本低、耗时短,便于监测和动态观察患者病情进展。本研究中将HMGB1、MPV作为主要检测指标,以探讨其在AP病情进展及预后中的可能作用机制。
本研究中,HMGB1、MPV、APACHEⅡ评分均随着病情严重程度的增加而增加,可见HMGB1、MPV均参与着AP的病情进展,AP患者胰腺细胞受损后,炎性因子大量释放,通过被激活的单核巨噬细胞炎性因子刺激进而释放到细胞外,正向调节炎性的级联反应,同时炎性因子又可促进HMGB1分泌,形成恶性循环[16]。而MPV表达升高的可能机制为患有AP时,大量细胞因子及炎性因子被释放入血,进而使血小板活化,而体积大、差异程度高的血小板含有更多的颗粒及更高的活性,进一步加重患者病情[17]。肝脏作为AP病情发展常见的受累器官,肝细胞受损后导致ALT、TBil、AST释放入血,本研究中ALT、TBil、AST等肝功能指标在重症AP患者中呈现高表达,但在轻症AP患者中其水平与健康对照者相差不大,可见AP早期患者肝功能受累不明显,但伴随着病情进展,肝功能损伤逐渐加重。郭婉薇等[18]通过动物实验证实,重症AP时,大鼠肝内胆管细胞出现不同程度功能及病理损伤,部分细胞因子呈现异常高表达,肝内胆管细胞的凋亡率亦逐渐增高。这与本研究中细胞因子的异常释放加重炎性级联反应,引起靶器官损伤的可能机制基本一致。同时本研究结果还显示,存活患者其HMGB1、MPV、ALT、TBil、AST、APACHEⅡ评分均低于死亡患者,可见上述指标均与AP患者的预后存在一定关系。HMGB1可通过提高T细胞介导的免疫抑制,进而诱导免疫耐受,影响凋亡细胞及微生物的吞噬清除,最终对胰腺及胰外器官形成二次打击,加重机体损伤,甚至导致死亡。章忠渭等[19]对重症AP大鼠胰腺组织给予抗氧化剂治疗,结果显示可有效降低晚期炎性因子HMGB1表达水平,进而改善胰腺组织损伤。而MPV的持续升高,一方面可对内皮细胞造成损伤,使机体其他炎性细胞因子更易于浸润内皮;另一方面可使局部长期处于高凝状态,造成循环血中血小板明显减少,血流携带免疫防御物质减少,进而影响患者预后[20-21]。
另外相关性分析结果显示,HMGB1、MPV与AST、TBil、ALT、APACHEⅡ评分均呈正相关,提示HMGB1、MPV联合检测对于客观评估患者病情及预后具有一定的参考价值。
ROC分析显示HMGB1、MPV对AP患者预后具有一定的预测价值,而联合2项指标检测对AP患者预后价值更高。通常,预测AP患者预后的理想方式应便于检测、可重复操作、创伤小,且可有效反映疾病生理病理过程。过去常用APACHE Ⅱ评分,其受主观因素影响较大,HMGB1、MPV水平可随AP病情进展而变化,具有较高敏感性,可重复检测,因此更适合用于临床。
综上所述,AP患者中血清HMGB1、MPV升高,两者均与AP病情严重程度、肝功能损伤及预后存在相关性,参与AP的发生、发展过程,临床对上述指标进行联合检测可能有助于疾病诊断及病情严重程度的判断。
利益冲突:无
作者贡献声明
汪武贵:设计研究方案,实施研究过程,论文撰写;周勇、卢小岗:实施研究过程,资料搜集整理,论文修改;李伟:进行统计学分析;湛小波:提出研究思路,课题设计,分析试验数据,论文审核

