远志活性成分优呫吨酮铜(Ⅱ)配合物的抗肿瘤活性研究*
宋路路,于 俏,齐学洁,杨爱红,张昕阳,申 蕊,寇晓娣,赵利花(.天津中医药大学中药学院,天津 3067;.天津大学仁爱学院化工系,天津 30636)
呫吨酮(Xanthone)是传统中药远志、藤黄、龙胆等的化学成分与药效物质基础之一[1-3]。呫吨酮在其线性排列的二苯并γ-吡喃酮环上有8个可以取代的位置(图1a),所以容易形成多样的结构并且表现出广泛的生物活性,如抗肿瘤[4-5]、抗菌[6]、抗氧化[7]、抑制乙酰胆碱酯酶[8]、抑制α-葡萄糖苷酶[9]、抑制神经氨酸酶等[10]。优呫吨酮(Euxanthone,图 1b)是中药远志、尾叶远志等中的有效化学成分,属于1、7位二氧取代呫吨酮,具有生长刺激、抑制血小板聚集、抑制肿瘤细胞增殖等活性[11]。根据中药有效化学成分的配位化学学说[12],优呫吨酮结构中1位羟基氧原子与9位羰基氧原子的位置特殊,极易与金属离子配位,产生协同或拮抗作用,影响原有的生物活性或产生新的生物活性。而且优呫吨酮的三环结构具有良好的平面性和共轭体系,可以与DNA的碱基对发生堆积作用[13]。而DNA是临床常用抗肿瘤药物的靶向分子之一。小分子药物可以通过直接或间接的方式造成DNA损伤来发挥其抗肿瘤作用[14]。所以小分子与DNA的作用方式对于药物设计、药理、毒性等研究都有重要的意义。本实验拟以优呫吨酮为配体,合成优呫吨酮铜(Ⅱ)配合物,利用金属离子的特殊生理活性,提高优呫吨酮对食管鳞癌细胞(ECA109)、胃癌细胞(SGC7901)和宫颈癌细胞(Hela)的体外抑制活性,并且利用光谱学方法研究配合物与小牛胸腺DNA的相互作用,为进一步研究基于中药活性成分的金属配合物抗肿瘤作用机制和中药配伍理论研究提供实验依据。

图1 呫吨酮(a)和优呫吨酮(b)的分子结构Fig.1 The structure of Xanthone(a)and Euxanthone(b)
1 仪器与试剂
1.1 仪器 元素分析仪(Perkin Elmer EA 2400Ⅱ),傅里叶红外光谱仪(Perkin-Elmer FTIR),酶标仪(Bio-Tek),荧光分光光度计(Hitachi F-4600),紫外可见光谱仪(Varian Cary100),圆二色谱仪(Bio-Logic MOS-450)。
1.2 试剂 小牛胸腺DNA(ct-DNA)、DMEM培养基、胰蛋白酶、新生小牛血清、噻唑蓝(MTT)、溴化乙锭(EB)、三羟甲基氨基甲烷(Tris)、二甲基亚砜(DMSO)、乙二胺四乙酸二钠(Na2EDTA)、十二烷基硫酸钠(SDS)购于Solarbio公司,其他试剂均为分析纯。
2 实验方法
2.1 优呫吨酮铜(Ⅱ)配合物的合成 将0.20 mmol优呫吨酮溶于10 mL乙醇中,室温搅拌至完全溶解,加入0.20 mmol的NaOH,继续搅拌20 min。然后加入0.10 mmol的CuCl2,室温搅拌8 h,陈化 24 h,离心分离。沉淀用乙醇洗涤,80℃下真空干燥,得到优呫吨酮铜(Ⅱ)配合物。
2.2 细胞毒性 取对数生长期的ECA109、SGC-7901、Hela细胞制成5×104/mL的单细胞悬液,接种于96孔板,37℃、5%CO2的培养箱中培养12 h。加入不同浓度的待测物(0、1.56、3.125、6.25、12.5、25.0、50.0 μg/mL),培养 44 h。然后加入 5 mg/mL 的MTT(10 μL/孔),继续培养 4 h。移走培养基后加入DMSO,震荡摇匀后测定各孔570nm处的光密度(A)。细胞生长抑制率IR=(1-A/A0)×100%。待测物用含有DMSO的培养基溶解(DMSO终体积<0.5%)。
2.3 优呫吨酮铜(Ⅱ)配合物与DNA的相互作用 DNA热稳定性实验使用1 mmol/L Tris、0.1 mmol/L Na2EDTA的Tris-HCl缓冲溶液(pH=7.3),其他与DNA相互作用实验使用5 mmol/L Tris、50 mmol/L NaCl的Tris-HCl缓冲溶液(pH=7.3)。铜(Ⅱ)配合物用含有DMSO的缓冲溶液溶解(DMSO终体积<0.5%)。
2.3.1 铜(Ⅱ)配合物对DNA-EB复合体系荧光光谱的影响 样品池中加入DNA-EB溶液([DNA]=20 μmol/L,[EB]=2 μmol/L),Ex=500.0 nm 激发,测定520~720 nm的DNA-EB复合体系荧光光谱。然后逐渐增加铜(Ⅱ)配合物浓度,测定DNA-EB复合体系荧光光谱的变化。根据Stern-Volmer方程F/F0=1+Kq[Q],计算动态猝灭常数 Kq[15]。
2.3.2 铜(Ⅱ)配合物对DNA溶液紫外光谱的影响 样品池中加入10 μmol/L DNA溶液,测定DNA在230~320 nm的吸收光谱;然后逐渐增加铜(Ⅱ)配合物浓度,测定DNA紫外光谱的变化。
2.3.3 铜(Ⅱ)配合物对DNA溶液圆二色谱的影响 样品池中加入5 μmol/L DNA溶液,测定DNA在200~450 nm的圆二色谱;然后加入铜(Ⅱ)配合物溶液([配合物]=5 μmol/L),测定 DNA 圆二色谱的变化。
2.3.4 铜(Ⅱ)配合物对DNA热稳定性的影响 样品池中分别加入DNA溶液([DNA]=5 μmol/L)和DNA-铜(Ⅱ)配合物溶液([DNA]=5 μmol/L,[配合 物]=5 μmol/L),在 50~100 ℃间检测 DNA 在260 nm处吸光值的变化,升温速度为2℃/min,tm为熔解温度。
3 实验结果
3.1 优呫吨酮铜(Ⅱ)配合物的元素分析 红外光谱铜(Ⅱ)配合物为黄绿色粉末,产率65.25%。C、H元素含量由元素分析仪测定,Cu金属含量用EDTA络合滴定法(二甲酚橙作为指示剂)[16]测定。元素分析按 C26H14O8Cu计算值(%):C,60.29;H,2.71;M,12.27。实验值(%):C,60.51;H,2.69;M,11.78。IR(KBr,cm-1):3203(νO-H),1620(νC=O),1563(νC=C),1266(νAr-O),1033(νC-O-C),807(δAr-H),679(ρw O-H)。优呫吨酮γ-吡喃酮环上羰基的特征伸缩振动峰(νC=O)为 1 652 cm-1,与 Cu2+配位后振动减弱,向低波数方向移动了32 cm-1左右。
3.2 细胞毒性优呫吨酮铜(Ⅱ)配合物对肿瘤细胞的作用 对ECA109、SGC7901和 Hela肿瘤细胞呈现浓度依赖性抑制,并且明显优于优呫吨酮,见图 2。其半抑制率浓度(IC50)分别(22.27±1.28)、(28.61±1.57)和(21.11±1.19)μg/mL。表 1。
3.3 优呫吨酮铜(Ⅱ)配合物与DNA的相互作用 随着铜(Ⅱ)配合物浓度的增加,DNA-EB复合体系在587 nm附近的特征荧光峰强度逐渐减弱,并在550 nm附近出现等电势点,动态猝灭常数Kq=1.62×104(图3),而DNA紫外光谱在260 nm附近的征吸收峰则发生了明显的增色效应(图4)。DNA的圆二色谱在加入铜(II)配合物后,原来在245 nm处由双螺旋结构引起的负吸收峰和275 nm处由碱基对堆积引起的正吸收峰都明显增强,见图5。DNA的热稳定性实验表明铜(II)配合物与DNA作用后,DNA的熔解温度上升了6.5°C,见图6。

图2 优呫吨酮(●)和铜(Ⅱ)配合物(■)对ECA109、SGC7901和Hela细胞的抑制作用Fig.2 Inhibition ratio of Euxanthone(●)and complex(■)on ECA109,SGC7901 and Hela cells

表1 优呫吨酮和铜(Ⅱ)配合物对ECA109、SGC7901和Hela细胞的半抑制率浓度Tab.1 IC50of Euxanthone and complex against ECA109,SGC7901 and Hela cells

图3 铜(Ⅱ)配合物对DNA-EB复合体系荧光光谱的影响Fig.3 Fluorescence emission spectra of DNA-EB upon addition of Cu(Ⅱ)complex

图4 铜(II)配合物对DNA溶液吸收光谱的影响Fig.4 Ultraviolet absorption spectra of DNA upon addition of Cu(II)complex
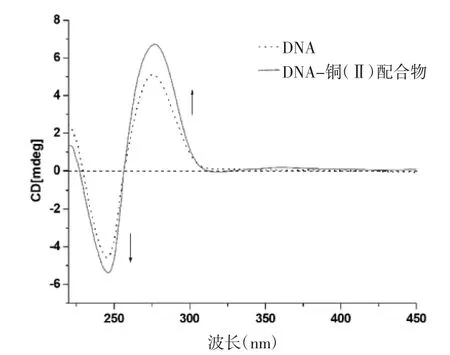
图5 铜(Ⅱ)配合物对DNA溶液圆二色谱的影响Fig.5 Circular dichroic spectra of DNA in the absence and presence of Cu(Ⅱ)complex

图6 铜(II)配合物对DNA热稳定性的影响Fig.6 Thermal denaturization curves of DNA
4 讨论
本实验通过元素分析、红外光谱推测优呫吨酮铜(II)配合物的化学组成为Cu·(L)2(L=失去1位羟基氢的优呫吨酮),即Cu2+与两个优呫吨酮分子的二苯并-吡喃酮环上的羰基氧和1位上失去质子的羟基氧以双齿形式配位,形成四配位的结构,见图7。铜(II)配合物使EB-DNA复合体系的荧光减弱,说明配合物与DNA发生了类似于EB的插入作用,竞争了EB与DNA结合的位点。并且DNA-EB体系荧光光谱变化F/F0与配合物浓度[Q]的线性关系良好,说明配合物与DNA为单一插入作用。DNA紫外光谱的增色效应说明配合物插入DNA双螺旋碱基对间,改变了构成碱基堆积力的疏水作用力和范德华力,影响了双螺旋结构。圆二色谱实验结果进一步证明了配合物与DNA发生了插入作用,增强了碱基的堆积作用稳定了DNA的双螺旋结构,这一点从DNA的热稳定性实验中也得到了证实。根据上述结果笔者推测优呫吨酮与Cu2+配位后,可能影响了平面芳香体系电子云密度的分布,进而影响了优呫吨酮的药理活性。同时Cu2+配位后,芳香体系的平面性更好,更利于插入DNA的碱基对,引起肿瘤细胞的DNA损伤,进而抑制细胞生长,表现出较好的抗肿瘤活性并且活性明显优于优呫吨酮。由于细胞的复杂性,优呫吨酮铜(Ⅱ)配合物具有细胞毒性的其他可能机制也在进一步的研究中。
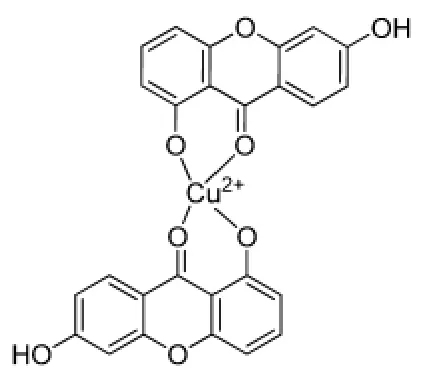
图7 优呫吨酮铜(Ⅱ)配合物的结构Fig.7 The structure of Euxanthone Cu(Ⅱ)complex

