PNF技术调整骨盆控制能力改善卒中患者步行及平衡功能的临床研究*
励志英,李 晶
(天津中医药大学第一附属医院,国家中医临床医学研究中心,天津 300193)
中国脑卒中发病率约为每年274/10万人[1]。虽然近年来患者急性期病死率明显下降,但急性期治疗后,75%的患者会遗留不同程度的肢体功能障碍,重度残疾占40%,严重影响其日常生活活动及回归社会[2]。
步行障碍是脑卒中患者最为常见的功能障碍之一,患者通常会因患肢肌力下降和肌张力异常等使躯干旋转不足、髋关节和膝关节屈曲受限、踝关节过度跖屈,造成身体重心偏离支撑面,进而导致步行不稳,表现出明显的偏瘫步态;这也是患者平衡能力下降、跌倒风险增加的重要原因[3]。躯干是身体活动的基础;而骨盆和髋关节则连接躯干与下肢,在力学传导中起到承上启下的作用,是维持躯干稳定、步态和平衡的核心。不同卒中阶段的骨盆倾斜和躯干控制之间存在显著相关性[4]。
本体感觉神经肌肉促进技术(PNF)是利用牵张、关节挤压和牵引及施加阻力等本体刺激,应用螺旋形和对角线运动模式,达到促进相关神经肌肉反应,增强相应肌肉的收缩能力的技术,同时通过调整感觉神经的兴奋性来改变肌张力、缓解肌痉挛,使之以正常的运动方式进行活动的一种康复训练方法。目前,已有一些研究发现PNF技术能够改善脑卒中患者的下肢运动功能和姿势控制能力[5]。
笔者临床尝试应用PNF技术调整卒中患者的骨盆控制能力,在改善卒中患者躯干稳定性和步行能力、降低抗跌倒风险方面取得了一定疗效,现总结如下。
1 材料与方法
1.1 临床资料
1.1.1 诊断标准 根据中华医学会第四次全国脑血管病学术会议修订的《各类脑血管疾病诊断要点》[6],并经头颅计算机断层扫描(CT)或核磁共振(MRI)确诊。
1.1.2 纳入标准 1)年龄45~75岁,性别不限。2)符合诊断标准,发病时间≤3个月。3)存在偏侧下肢肢体运动功能障碍,徒手肌力法(MMT)检测患侧肌力≤3级。4)10 m步行测试(10MWT)显示可借助辅助器具行走10 m以上。5)Berg平衡量表(BBS)评分≤45分。6)无认知功能障碍,简易精神状况量表(MMSE)评分≥23分。7)自愿参加本研究,并签署知情同意书。
1.1.3 排除标准 1)短暂性脑缺血发作。2)由脑肿瘤、脑外伤、代谢障碍、风湿性心脏病、冠心病及其他心脏病合并房颤引起脑栓塞。3)偏侧肢体失认。4)视、听或理解能力有严重障碍。5)存在骨关节病或其他神经肌肉疾病及类风湿、骨折、外伤等严重影响肢体功能的疾病。6)继发癫痫、精神病或伴有帕金森氏综合征。7)病情不稳定者。8)合并有肝、肾、造血系统和内分泌系统等严重原发性疾病患者。9)服用可能会干扰药效评价的药物。
1.1.4 剔除、脱落及中止试验标准 1)纳入后发现不符合纳入标准的病例,需予剔除。2)纳入病例发生严重不良事件、出现并发症不宜继续接受该项治疗,自行退出或未完成整个疗程而影响安全性判断或疗效的病例,均应视为脱落。3)临床试验中出现严重不良反应或并发症者应视情况而中止试验或脱落病例。
1.2 研究方法
1.2.1 样本量估算 根据参考文献[7],醒脑开窍针法治疗卒中恢复期患者的美国国立卫生院脑卒中量表(NIHSS)评分为2.77分(标准差为 1.20),笔者采用PNF技术期望将患者的NIHSS评分降至1.80。因此根据公式n=2σ2×f(α,β)/(μ1-μ2)2计算[8],得n=32,即每组需病例32例;按20%脱落率计算,每组应纳入病例39例。
1.2.2 分组方法 依据上述纳入排除标准,共纳入2017年5月—2018年2月在天津中医药大学第一附属医院针灸部住院的脑卒中患者78例。将患者按随机数字表法随机分入对照组和PNF组,每组各39例。随机方法为:采用SPSS17.0随机数字生成器生成78个随机数字(固定值为39),按大小顺序排列,将排序为1-39的随机数字所代表的患者编号分入对照组,将排序为40-78的随机数字所代表的患者编号分入PNF组。
78例患者中,共有男40例,女38例;其中对照组男22例,女17例;PNF组男18例,女21例。平均年龄为对照组(62.03±8.94)岁,PNF组(62.60±9.93)岁。发病时间为对照组(2.05±0.32)个月,PNF组(1.92±0.60)个月。其中有脑缺血61例(78.2%),脑出血 17例(21.8%);高血压 59例(75.6%);糖尿病13例(16.7%);高胆固醇血症23例(29.5%);缺血性卒中史17例(21.8%),出血性卒中史7例(9.0%),短暂性脑缺血发作史2例(2.6%)。两组患者在性别、年龄、治疗前NIHSS评分等方面均无统计学差异,具有可比性(均P>0.05),见表1。所有患者均完成为期1个月的临床试验观察。
1.2.3 治疗方法 两组患者均参照《中国脑血管病防治指南》给予抗血小板、降压、降糖、降脂等常规对症支持治疗及常规针刺治疗。针刺穴位处方以醒脑开窍针法为主,包括内关、三阴交、极泉、尺泽、委中,再随症配以风池、完骨、天柱、曲池、外关、合谷、阳陵泉、足三里、悬钟、太冲、丰隆等穴。每日针刺1次,每次30 min,每周6次。在此基础上,对照组给予常规康复训练,包括被动运动患肢、主动翻身练习、站立、平衡、起坐及步行训练等。PNF组则予以PNF技术进行治疗,包括:1)骨盆的前伸和后缩模式训练。患者侧卧位,健侧在下,臀部屈曲至100°,膝盖屈曲至45°,脖子由枕头支撑并弯曲到30°,脊柱呈中立位。医师站在患者身后,双手交叠放在患者髂嵴上,手指朝前;阻力的方向为向后、向下拉。患者听从口令,尽力收缩肌肉以使骨盆向上、向前移动;医师则在肌肉完全收缩但肢体尚未开始移动之前对肌肉进行轻柔牵拉并施以向后、向下的阻力,使肌肉得以充分协调的运动。然后,医师将掌根放于坐骨结节上,手指朝向对侧肩关节,患者听从口令收缩肌肉将骨盆向后、向下运动,医师则同法给予肌肉轻柔牵拉及向前、向上方的阻力[9]。2)对角线或螺旋式的下肢运动模式训练。操作1:患者仰卧,医师站于患肢脚侧,一手握患足背,另一手放于患者大腿上部。以患肢髋关节为轴心,先自下肢D1伸模式(伸展-外展-内旋位)令患者向上、向内用力抬脚,并逐步运动至下肢D1屈模式(屈曲-内收-外旋位),当所有协同肌均充分收缩时施以反方向牵张操作;到位后再令患者用力向下、向外伸脚,返回下肢D1伸模式,同法施以反方向牵张操作。操作2:患者仰卧并稍向对侧倾斜,医师一手握患足背,另一手放于患者大腿上部。以患肢髋关节为轴心,由D2伸模式(伸展-内收-外旋位)向令患者向上、向外用力抬脚,并逐步运动至D2屈模式(屈曲-外展-内旋位),当所有协同肌均充分收缩时施以反方向牵张操作;到位后再令患者用力向下、向外伸脚,返回下肢D2伸模式,同法施以反方向牵张操作[10]。治疗过程中根据患者肌肉力量调节反方向牵张操作的力度,并通过运用徒手接触、节律启动、缓慢逆转、快逆转等技术,以增加关节活动度和增强肌力。两组患者每日均进行相应训练2次,45分/次,每周治疗6 d。治疗均持续1个月。

表1 患者的基线情况Tab.1 Baseline characteristics of patients
1.3 疗效评价标准
1.3.1 疗效评价 治疗前后,采用NIHSS评价患者的神经功能缺损程度[11];并根据NIHSS评分变化评价治疗效果[12],其中治愈:NIHSS评分降低≥90%;显效:NIHSS评分降低50%~89%;有效:NIHSS评分降低20%~49%;无效:NIHSS评分降低<20%或上升。总有效率为治愈率、显效率、有效率之和。
1.3.2 肌张力评价 采用改良Ashworth量表(MAS)对患者髋、膝、踝关节肌张力进行评价[13]。该量表分级为 0、1、1+、2、3、4 级,为方便统计,分别记为 0、1、2、3、4、5 分;分数越高,表明肌张力越高。主要评价的肌肉为臀大肌、股四头肌、胫前肌、胫后肌、腘绳肌、腓肠肌、比目鱼肌、小腿三头肌、长屈肌、趾长屈肌、趾短屈肌等。
1.3.3 肢体运动功能及生活自理能力评价 Fugl-Meyer量表中的下肢量表评价肢体运动功能[14];改良的Barthel指数量表(MBI)评价患者日常生活活动能力[15]。
Fugl-Meyer量表是临床上应用普遍的评价患者运动功能、平衡功能、感觉功能、关节活动度的量表。其中下肢FMA(FMA-LE)总分为0~34分;分数越低表示运动功能越差。MBI量表通过患者日常生活活动的10个方面来评价患者不受协助的独立生活能力。其总分为0~100分,分数越高表明独立生活能力越强。
1.3.4 平衡功能及步行能力评价 BBS评价患者平衡能力;计时起立行走测试(TUG)评价患者跌倒风险;10MWT评价患者步行功能。
Berg量表共含14项内容,每项计0~4分,合计56分,分数越低提示平衡功能越差;其中,≤20分提示须使用轮椅,高跌倒风险;21~40分提示可在辅助下行走,中等跌倒风险;≥41分提示生活完全自理,低跌倒风险[16]。TUG测验要求患者自坐位站起以正常步速行走3 m后返回并坐下,记录所用时间。其中,≤12 s提示低跌倒风险;>12 s提示高跌倒风险[17]。10MWT测试用于评价患者行走10m(前后1m不计)所需的时间[18]。
1.3.5 步态分析 采用足印法收集步态资料,行走距离不少于10 m,每侧不少于3个连续足印。获得患侧步长、步速、步态周期等数据。
2 统计分析
使用SPSS 20.0软件进行数据分析。计量资料以均数±标准差(x±s)表示;组内前后比较采用配对t检验,两组间比较采用两独立样本t检验。计数资料组间比较采用χ2检验,等级资料组间比较采用秩和检验。P<0.05为差异有统计学意义。
3 结果
3.1 两组临床疗效比较 以NIHSS评分变化来评价两组患者临床疗效,两组比较差异有统计学意义(Z=-2.08,P=0.037),见表 2。

表2 两组患者临床疗效比较Tab.2 Comparison of clinical efficiencies between two groups 例
3.2 患者治疗前后肌张力变化 治疗后,两组患者髋、膝、踝关节MAS评分均较治疗前显著降低(均P<0.01),且PNF组的改善情况明显优于对照组(P<0.05,P<0.01),特别是对髋关节的改善更为显著(P<0.01),见表 3。
3.3 患者治疗前后肢体运动功能和日常生活能力比较 治疗后,两组患者的下肢运动功能评分(FMA-LE)较治疗前显著提高(均 P<0.01),且 PNF组的改善情况明显优于对照组(P<0.01),见表4。治疗后,两组患者的日常生活能力(MBI)评分较治疗前显著提高(均P<0.01);且PNF组的改善情况明显优于对照组(P<0.05),见表 4。

表3 两组患者髋、膝、踝关节MAS评分比较(x±s)Tab.3 Comparison of MAS scores in hip,knee and ankle joints between two groups(x±s) 分
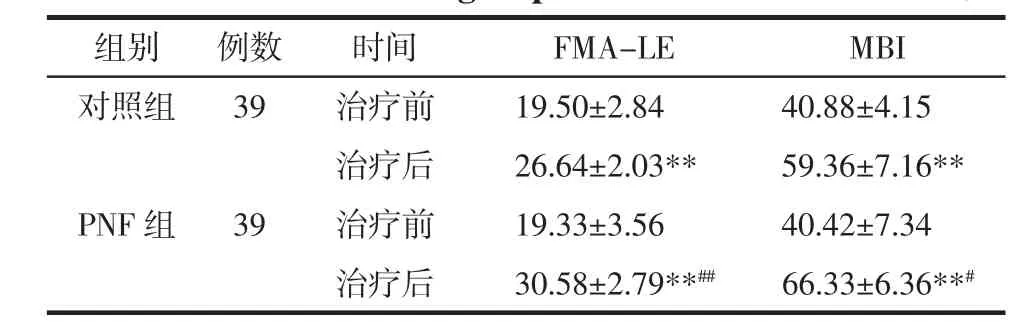
表4 两组患者FMA-LE和MBI评分比较(x±s)Tab.4 Comparison of FMA-LE and MBI scores between two groups(x±s) 分
3.4 患者治疗前后步行及平衡能力、跌倒风险的比较 治疗后,两组患者的BBS较治疗前显著提高(P<0.01),TUG 和 10MWT 均明显下降(P<0.01),且PNF组的改善情况明显优于对照组(P<0.05),见表5。
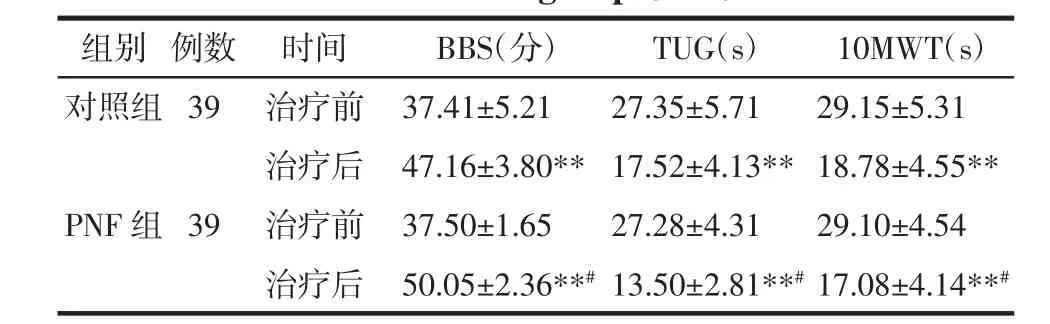
表5 两组患者BBS、TUG和10MWT结果比较(x±s)Tab.5 Comparison of results of BBS,TUG and 10MWT between two groups(x±s)
3.5 患者治疗前后步态参数比较 治疗后,两组患者的步长、步速明显增加,而步态周期则明显降低(P<0.05,P<0.01);特别是 PNF 组上述指标改善更为明显,与对照组相比差异有统计学意义(P<0.05,P<0.01),见表 6。
4 讨论
脑卒中患者的肢体运动功能障碍发生率达75%[2],其中步行障碍是最为影响其日常生活活动能力的功能障碍之一。虽然多数患者能逐步恢复其步行能力,但其中大部分并未获得良好步态,甚至某些不正确的训练还强化了其步态异常。

表6 两组患者患侧步态参数变化(x±s)Tab.6 Changes of gait parameter of patients between two groups(x±s)
脑卒中偏瘫患者的主要临床特点为运动模式粗大、肌张力增高、腱反射亢进等。其发生的根本原因可归于脑卒中后上运动神经元受损,大脑皮质作为调节躯体运动机能的高级中枢受到抑制;而脊髓水平的反射则因高位中枢受损而脱抑制,其控制的原始反射和肢体整体运动模式被释放出来,干扰了正常运动的传导,从而引起肢体活动的异常[19]。患者通常会因患肢肌力下降、重心偏离支撑面和左右两侧肌张力不对称而导致步行时左右摇摆以拖拽身体前行,其步态周期中摆动相时长可达站立相时长的2倍以上,这种左右摇摆的异常步态也导致患者步行能力和平衡能力下降,跌倒风险增加[20]。
PNF技术利用典型的对角线模式来刺激肌肉和肌腱内的本体感受器,从而增加肌肉力量,改善肢体功能、灵活性和平衡能力。骨盆在水平面上的旋转、倾斜及侧向移位均与步态密切相关。研究显示,PNF技术不仅能有效提高中风患者躯干和骨盆的控制能力,还能改善患者步态异常,提高行走稳定性[21-23]。Kumar等[24]纳入卒中发病6个月以内的偏瘫患者并采用PNF技术进行治疗,每次30 min,每周3次,共持续4周,发现调整骨盆功能显著改善患者的步态及功能活动。Shinde等[3]也发现,PNF技术改善了急性卒中患者躯干稳定性及平衡能力。另一项随机对照试验发现,PNF治疗期间(0~4周)患者威斯康星步态量表评分(WGS)持续改善,即使治疗结束后2周患者的WGS评分也未出现显著下降,提示PNF技术有助于促进躯干、骨盆的运动和稳定性,从而增强患者的神经肌肉运动控制能力[25]。经PNF治疗后,卒中患者的步长时间、双足支撑相和站立相百分比较对照组明显下降;而步速、步长则明显增加,提示PNF技术可改善卒中患者的步态异常[26]。PNF技术的起效机制目前尚不清晰,有研究显示骨盆的前伸和后缩模式训练增强了附着于脊柱和骨盆的诸如腹肌、椎旁肌、臀肌和腰多裂肌等肌群的力量,而这些肌群对维护脊柱和骨盆的稳定意义重大[27]。PNF技术中牵张、挤压、施加阻力等手法的运用也能刺激更多的运动神经元产生兴奋性冲动,促使肌肉收缩以增加随意收缩的力量或肌张力,亦可抑制靶运动神经元使肌肉放松,缓解肌痉挛。此外,治疗过程中髋、膝、踝关节的主动和被动的运动,不仅增强了关节活动度,也有助于形成新的感觉运动通路,促使患者下肢神经功能的恢复[28]。
正常的肌张力是人体维持各种姿势和运动模式的基础。脑卒中后人体的姿势控制系统遭到破坏,肌张力异常扰乱了肢体姿势控制的协调性、平衡性以及肌群对姿势变化的自主调整等,导致肢体生物力学发生变化及异常躯体运动模式的出现[29]。本研究发现,患者治疗前患侧与健侧下肢髋伸展、膝屈曲和踝背伸具有明显的不对称性,患侧下肢各关节屈肌无力而伸肌痉挛,髋、膝、踝关节MAS评分均较高,说明肌群肌张力不对称导致关节活动受限,并进一步影响步行能力。治疗后,患肢各关节MAS评分降低,且PNF组的改善效果更为明显,提示PNF技术可缓解痉挛肌群肌张力,促进患肢运动功能的提高。
Barthel指数及FMA量表是脑卒中后常用的评价患者日常生活能力和运动功能评价量表,均具有严格的效度和信度[30-31]。Berg平衡量表、TUG测试和10MWT测试上述3个量表均具有较好的效度和信度,且TUG与10MWT测试结果具有较好的相关性。本研究发现,患者治疗前患侧下肢运动功能受限,生活自理能力下降。步行呈明显偏瘫步态,姿势不稳、行走缓慢并伴随患肢伸直并外旋、骨盆抬高、膝关节伸展、足内翻等;患者的平衡能力、步行能力均较差,跌倒风险高。治疗后,其下肢运动功能明显改善,生活自理能力提高。偏瘫步态得以明显纠正,平衡能力提高,步行速度加快,步频提高,且PNF组的改善效果更为明显。此外,经PNF技术治疗后,改善的肌张力也有助于扩大关节活动度,进而改善患者的步行功能,降低跌倒风险。
5 小结
PNF技术通过调整骨盆控制能力来增强骨及躯干的稳定性,能有效改善脑卒中偏瘫患者患肢的肌张力,进而改善患者的步行功能,降低跌倒风险,提高生活自理能力。

