慢性阻塞性肺疾病合并阻塞性睡眠呼吸暂停低通气综合征与脂联素、8-异前列腺素F2α的关系*
符沙沙,欧宗兴,陈宗存,陈小庄
(1.海南省人民医院 老年病科,海南 海口 570311;2.中南大学湘雅医学院附属海口医院 呼吸内科,海南 海口 570208;3.海南医学院附属第二医院内分泌科,海南 海口 570311)
我国40 岁以上人群中慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)患病率约为9.3%[1]。COPD 患者中约11%合并阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome,OSAHS)[2],中重度COPD 患者中达65.9%[3]。COPD合并OSAHS 简称重叠综合征(overlap syndrome,OS),两者共存死亡风险增加[4]。目前对OS的认识尚有争议。近期报道OS 发病可能涉及炎症和氧化应激[5]。脂联素是COPD 新的炎症标志物[6]。8-异前列腺素F2α是氧化应激较好的标志物。本研究探讨OS 与血清脂联素及8-异前列腺素F2α之间的关系。
1 资料与方法
1.1 研究对象
选取2011年1月—2017年6月海南省人民医院呼吸内科、老年病科病房住院的稳定期COPD 患者 80 例,OS 患者40 例。COPD 组:男性57 例,女性23 例;平均年龄(64.94±8.23)岁。OS 组:男性29 例,女性11 例;平均年龄(66.93±8.22)岁。所有入选对象均行肺功能检查及多导睡眠图(Polysomnogram,PSG)监测。COPD、OSAHS 诊断标准:①COPD[7],存在慢性咳嗽、咳痰,进行性加重呼吸困难及有COPD 危险因素接触史,使用支气管扩张剂后FEV1%<70%;②OSAHS[8],白天嗜睡,夜间睡眠呼吸不规则和打鼾,每小时呼吸暂停+低通气≥5 次,或者每7 h 呼吸暂停+低通气次数>30 次。纳入标准:①年龄18 ~90 岁;②符合COPD 或OS 诊断标准者。排除标准:①精神病或其他原因不能配合检查者;②患有急性感染、严重高血压、高脂血症、糖尿病、冠状动脉粥样硬化性心脏病、肿瘤、心功能3 级以上者;③严重肝肾功能受损者;④患有血液系统、风湿免疫系统、其他内分泌系统疾病者;⑤近1 个月使用糖皮质激素、非甾体抗炎药物及免疫抑制剂者;⑥正服用巴比妥等抑制睡眠及呼吸中枢药物者;⑦COPD 急性加重期、合并其他呼吸系统疾病如支气管扩张、哮喘、肺炎者。研究经本院医学伦理委员会批准,患者知情并签署知情同意书。
1.2 研究方法
收集患者年龄、性别、体重指数(BMI)、血压、吸烟等基本资料。所有患者于清晨空腹抽取肘静脉血2 ml,3 000 r/min 室温离心20 min,EP 管收集离心所得血清,置于-80℃超低温冰箱保存待测。人脂联素试剂盒购自美国R&D 公司,8-异前列腺素F2α试剂盒购自上海索莱宝生物科技有限公司。采用ELISA 检测,酶标仪购自美国BIO-RAD 公司,由专人严格按试剂盒说明书操作。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用t检验,计数资料以例(%)表示,比较采用χ2检验,采用多重线性回归分别分析OS 与脂联素、8-异前列腺素F2α的相关性,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般情况比较
两组患者性别、年龄、吸烟情况、血压、血糖、血脂比较差异无统计学意义(P>0.05)。OS 组患者BMI 高于COPD 组(P<0.05),FEV1%低于COPD 组(P<0.05)。OS 组患者脂联素低于COPD 组(P<0.05),8-异前列腺素F2α高于COPD 组(P<0.05)。见表1。
2.2 脂联素与OS 的相关性
采用多重线性回归分析,调整BMI、FEV1%后,相对单纯COPD,OS 和血清脂联素有负向影响(P<0.05)。调整年龄、性别、BMI、FEV1%、吸烟、血糖、血脂、血压后,OS 和血清脂联素有负向影响(P<0.05)。见表2。
2.3 8-异前列腺素F2α 与OS 的相关性
采用多重线性回归分析,调整BMI、FEV1%后,相对单纯COPD,OS 与8-异前列腺素F2α有正向影响(P<0.05)。调整年龄、性别、BMI、FEV1%、吸烟、血糖、血脂、血压后,OS 和8-异前列腺素F2α有正向影响(P<0.05)。见表3。
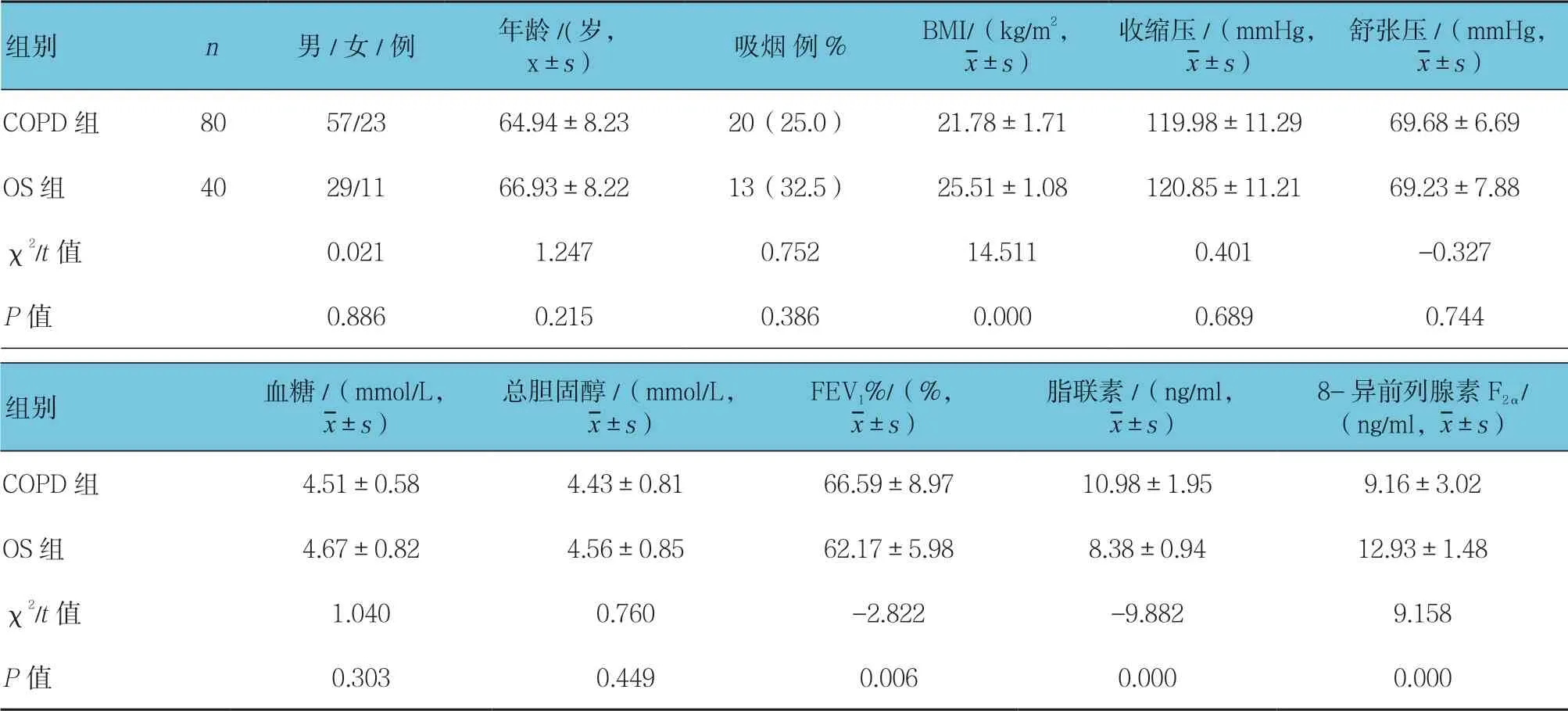
表1 两组患者一般情况比较

表2 脂联素与OS 联系的多重线性回归分析
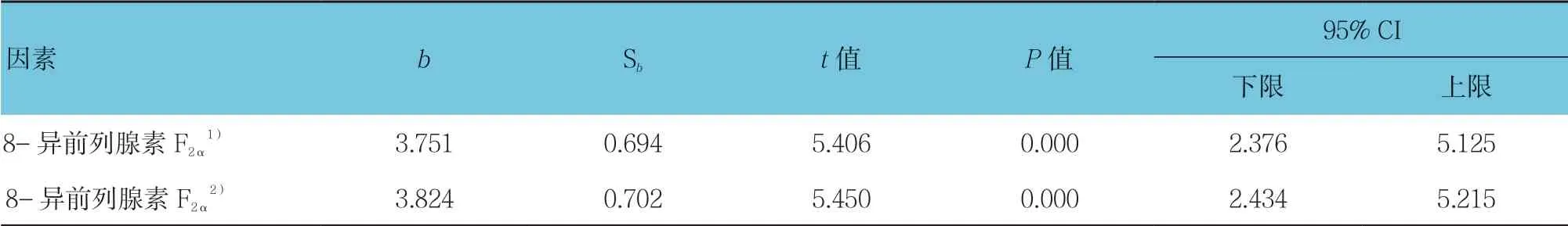
表3 8-异前列腺素F2α 与OS 联系的多重线性回归分析
3 讨论
OS 是指COPD 和OSAHS 同时存在的一种临床症候群。在COPD 患者中OSAS 的发病率高于普通人群,OS 患者的病死率明显高于单纯COPD 患者[4]。
本研究表明,OS 组较单纯COPD 组患者具有更高的BMI 和更低的FEV1%,提示OS 组患者肥胖更明显、肺功能更差。KIM 等[9]研究表明,体重每增加10%,OSAHS 发病风险增加30%。这可能与脂肪组织在咽喉黏膜沉积导致上呼吸道的塌陷有关。FEV1%是评价肺功能的重要指标。罗遐杰等[10]研究表明OS 患者FEV1%较单纯COPD 患者低,这可能与OSAHS 加重COPD 患者的气道阻塞有关。
本研究单因素分析提示OS 组脂联素水平较单纯COPD 组低,而8-异前列腺素F2α水平高。多重线性回归分析表明,在调整BMI、FEV1%等重要的混杂因素后,OS 组较单纯COPD 组具有更低的脂联素、更高的8-异前列腺素F2α水平。单因素及多因素分析均提示OS与脂联素、8-异前列腺素F2α相关。既往研究表明,在单纯COPD 患者中,传统炎症因子如白细胞介素-6、肿瘤坏死因子-α、C 反应蛋白水平均有升高[11]。而OS 患者肿瘤坏死因子-α、C 反应蛋白水平高于单纯COPD 患者,提示OSAHS 加剧COPD 患者的炎症反应过程[12]。本研究采用的脂联素是一种由脂肪细胞分泌的新炎症介质,具有抗炎、抗动脉硬化等作用,是目前新的调节炎症反应新的药物靶点之一[13]。本研究表明,OS 较单纯COPD 的脂联素水平更低,与传统炎症因子反应升高不同,说明相对于COPD,OS 不仅存在促炎作用增强,还存在抗炎作用减弱,这在目前国内外研究中鲜有报道,对药物干预OS 的炎症失调具有一定参考价值。近年来研究表明,脂联素与胰岛素抵抗和动脉粥样硬化也相关[14],因此,OS 患者脂联素降低提示该类患者较单纯COPD 患者还可能存在抗胰岛素抵抗作用和抗动脉粥样硬化作用减弱,故可能导致多种代谢紊乱加剧和心脑血管疾病风险增加,如更易发生糖尿病、冠状动脉粥样硬化性心脏病等。脂联素降低可能的机制是:①OS 患者夜间反复缺氧和微觉醒,可导致交感神经系统活性增强,儿茶酚胺分泌增多,通过G(S)蛋白-PKA 依赖途径抑制脂联素基因表达[15]。②夜间低氧可活化核因子-κB,从而激活白细胞介素-6、肿瘤坏死因子-α,抑制过氧化物酶增生物激活受体介导的脂联素基因启动子[16]。8-异前列腺素F2α是脂质过氧化的产物,是氧化应激的理想指标之一。COPD患者丙二醛水平升高,提示COPD 与氧化应激相关[17]。本研究进一步表明OS 较单纯COPD 氧化应激反应更明显,提示OS 发病涉及氧化应激增强。基础研究表明,阻塞性睡眠呼吸暂停综合征模型大鼠中丙二醛水平升高,超氧化物歧化酶水平降低,可能与缺氧导致中性粒细胞在肺内聚集、激活,释放大量活性氧相关[18]。因此,COPD 与OSAHS 并存加剧炎症反应及氧化应激的病理生理过程,且两者可以相互促进[19],共同参与OS 的发生、发展。OS 患者可能由于肥胖、缺氧等原因,导致炎症异常加剧和氧化应激增强。另外,患者反复低氧伴间歇性呼吸暂停,使机体处于低氧-再氧合交替的状态,类似缺血再灌注损伤,将加重激活氧化应激及炎症反应[18]。
OS 患者不仅发病率较高,而且病死率也较高,但目前临床上对OS 认识不足,应引起重视。本研究为OS 的调节炎症及抗氧化治疗提供一定依据,对减少OS 的发生和进展具有重要的临床意义。由于样本量相对较小,具有一定局限性,今后需要多中心、大样本研究进一步验证。

