DAPT对肺纤维化小鼠Th17细胞分化的影响*
徐芳,王爱利
(武汉市第一医院 呼吸科,湖北 武汉 430022)
肺纤维化(pulmonary fibrosis)是一种病因未明、发病机制复杂的弥漫性肺部疾病[1],目前公认是肺损伤后过度修复导致细胞外基质过度沉积的结果。课题组前期研究显示,肺纤维化中辅助性T 细胞17(T helper cell 17,Th17)的高表达与肺纤维化进展呈正相关[2]。本研究发现,NOTCH 信号通路在肺纤维化中被激活,促进成纤维细胞表型转化[3],加重细胞外基质的沉积。Th17 高水平分泌和表达白细胞介素-17(Interleukin 17,IL-17)的过程受多种信号通路的调控。有研究表明,在小鼠和人促Th17 细胞分化的细胞因子环境中均有NOTCH 信号通路的活化[4]。本研究采用γ-分泌酶抑制剂DAPT 阻断NOTCH 信号通路,探讨NOTCH 信号通路对肺纤维化模型小鼠Th17细胞的影响,为肺纤维化治疗寻找新的免疫靶向药物提供理论和实验基础。
1 材料与方法
1.1 材料
选取15 只雄性昆明鼠(批号:42000600006205),体重约25 ~30 g,购自武汉大学动物中心;博来霉素(4 mg/支,天津太和制药有限公司,批号:081102),DAPT(美国Sigma 公司),鼠α- 平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、NOTCH 1 及IL-17 等相关抗体(美国Santa Crue 公司);酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(美国R &D 公司),Quantscript RT Kit 逆转录试剂盒(大连TaKaRa 公司),SYBR Green/Floursecein试剂盒(立陶宛Fermentas 公司),异硫氰酸荧光素标记的CD3、CD4 抗体及藻红蛋白标记的IL-17A 单克隆抗体(美国eBioscience 公司)。
1.2 动物模型的复制及实验分组
按随机数字表法分为3 组:对照组、模型组及DAPT组,每组5只。各组小鼠用4%水合氯醛(0.01 ml/g)腹腔注射,麻醉后固定于手术台上,颈部气管切开注药。对照组注入生理盐水(1.25 ml/kg)设立阴性对照,模型组及DAPT 组注入博来霉素(5 mg/kg),DAPT 组于模型复制次日起开始用DAPT 溶液灌胃[5 mg/(kg·d)],隔天1 次,直到处死。
1.3 肺组织病理学观察
各组小鼠于模型复制第28 天处死,取左肺相同部位组织,用4%甲醛固定,常规病理学方法脱水、包埋、切片、HE 染色,观察肺泡炎和肺纤维化程度。
1.4 实时荧光定量聚合酶链反应(qRT-PCR)检测肺组织中NOTCH 1、IL-17 及α-SMA mRNA的表达水平
取50 mg大小的肺组 织,用Trizol法提取总RNA。各样本取相同质量的RNA 逆转录成cDNA,qRT-PCR 检测NOTCH 1、IL-17 及α-SMA mRNA 的表达水平。反应体系中的引物均由武汉巴菲尔生物技术服务有限公司设计。循环参数:95℃预变性2 min,95℃变性30 s,60℃退火30 s,72℃延伸30 s。共40个循环。见表1。

表1 引物序列
1.5 ELISA 检测外周血NOTCH 1、IL-17 的含量
各组小鼠于处死日心包取血,应用ELISA 检测各组小鼠外周血上清中NOTCH 1 及IL-17 的含量。参照试剂盒说明书步骤进行操作,最后经酶标仪在450 nm处读取吸光度值,并在标准曲线上计算其浓度值。
1.6 流式细胞术检测Th17 的比例
各组小鼠处死日心包取血3 ml,用小鼠淋巴细胞分离液分离外周单个核细胞。取培养后细胞悬液100 μl 于流式管中,加固定液、孵育、破膜、重悬细胞,用CD3-FITC 抗体、CD4-FITC 抗体、IL-17-PE-A 单克隆抗体标记,逐步挑选出CD3+CD4+IL-17+3 种阳性细胞上流式细胞仪检测。
1.7 统计学方法
数据分析采用SPSS 16.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用单因素方差分析,两两比较采用LSD-t检验;相关分析采用Pearson法,P<0.05 为差异有统计学意义。
2 结果
2.1 肺组织病理学变化
对照组肺组织肺泡间隔正常,肺泡的连续性未受到破坏,肺泡的直径和面积大小均匀,大部分区域终末小气道及血管周边无明显炎症浸润表现,未发现纤维化形成。模型组肺泡间隔增宽,肺泡的连续性受到破坏,肺泡大小不均匀,终末小气道及血管周边有明显的炎症细胞浸润,同时伴有纤维化形成,纤维化以支气管周边区域较为明显。DAPT 组与模型组比较,肺组织结构比较完整,肺组织炎症程度明显减轻,肺泡腔内残留少量炎症细胞,肺泡间隔明显缩小,纤维组织明显减少。见图1。
2.2 肺组织中NOTCH 通路的激活对IL-17 的影响及DAPT 对其阻断效应
3 组NOTCH 1 mRNA的相对表达水平分别为(1.023±0.112)、(4.278±1.021)和(1.876±0.114),经方差分析,差异有统计学意义(F=7.129,P=0.000);3 组α-SMA mRNA 的相对表达水平分别为(1.012±0.087)、(2.378±0.998)和(1.687±0.092),经方差分析,差异有统计学意义(F=5.448,P=0.001);3组IL-17 mRNA 的相对表达水平分别为(1.232±0.778)、(5.198±1.265)和(2.729±1.123),经方差分析,差异有统计学意义(F=3.676,P=0.024)。见图2、3。

图1 各组小鼠组织病理学改变 (HE×200)
2.3 DAPT 对肺纤维化小鼠外周血NOTCH 1、IL-17 表达水平的影响
3 组NOTCH 1 和IL-17 表达水平比较,差异有统计学意义(P <0.05);DAPT 组外周血IL-17 和NOTCH 1 的表达水平较模型组下降(P <0.05)。见表2。
2.4 NOTCH 1 与IL-17 的相关性
Pearson 相关分析显示,肺组织中NOTCH 1 mRNA水平与IL-17 呈正相关(r=0.643,P=0.031),DAPT组外周血Th17 的下降与NOTCH 1 呈正相关(r=0.602,P=0.033)。
2.5 各组Th17 比例
对照组、模型组及DAPT 组CD3+CD4+IL-17+细胞比例分别为0.44%、19.10%和8.92%,3 组比较,差异有统计学意义(F=21.067,P=0.036)。见图4。
图2 肺组织中NOTCH 1、IL-17 及α-SMA mRNA 的表达
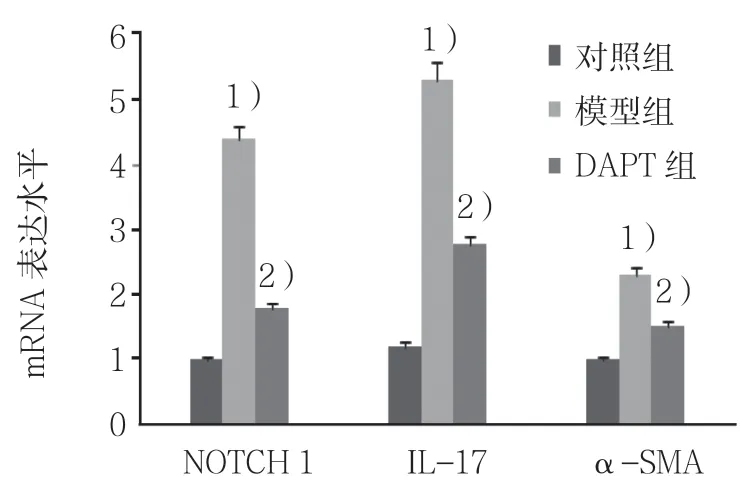
图3 各组肺组织中NOTCH 1、IL-17 及α-SMA mRNA的表达水平 (n=5,±s)
表2 各组血清中NOTCH 1 及IL-17 表达水平的比较 (n=5,±s)
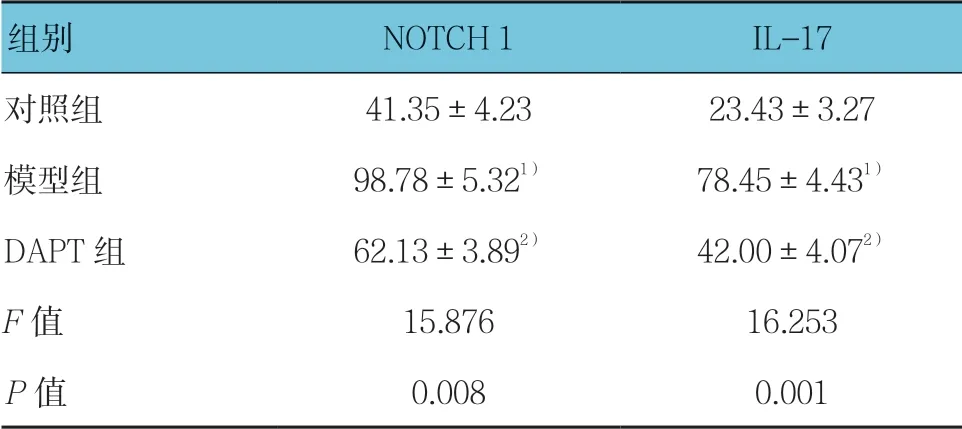
表2 各组血清中NOTCH 1 及IL-17 表达水平的比较 (n=5,±s)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05
组别 NOTCH 1 IL-17对照组 41.35±4.23 23.43±3.27模型组 98.78±5.321) 78.45±4.431)DAPT 组 62.13±3.892) 42.00±4.072)F值 15.876 16.253P值 0.008 0.001
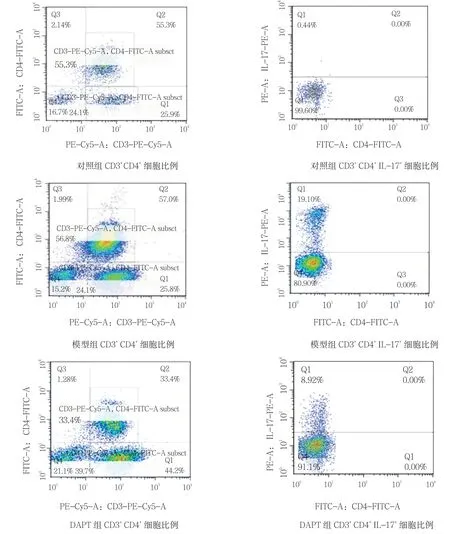
图4 Th17 流式细胞分析
3 讨论
肺纤维化的发病机制不明,目前公认为肺泡上皮反复损伤与过度修复是发病的关键[5]。反复损伤的肺泡上皮细胞一方面分泌大量的转化生长因子β1(TGF-β1)、血小板衍生因子等炎症细胞因子,诱导成纤维细胞聚集及肌成纤维细胞的形成,特异性表达α-SMA;另一方面发生上皮-间充质转化,通过以TGF-β1为主的多种复杂途径调控疾病的发生、发展。在炎症反应过程中,T 细胞的免疫应答很关键。近年来发现的Th17/调节性T 细胞(regulatory cell,Treg)在功能和分化上相互拮抗、相互调节[6]。Th17 是以分泌IL-17 为特点的新型CD4+T 淋巴细胞的亚群。当免疫系统受到外源性的刺激后,炎症细胞释放的TGF-β和IL-6 诱导CD4+T 淋巴细胞转化成为Th17,分泌IL-17 并表达RORγt。在生理状态下两者保持动态平衡维持机体正常免疫功能及自稳状态[7],而一旦受到外界刺激后,这种平衡就发生紊乱,例如慢性阻塞性肺疾病患者不管是急性发作期还是缓解期都存在着CD4+T 细胞亚群的失衡[8]。本研究显示,模型组小鼠肺组织呈现明显纤维化表现,且外周血IL-17 的含量及肺组织中IL-17 的表达较对照组升高,说明IL-17活化加重肺纤维化的发生、发展。同时,CD3+CD4+IL-17+细胞数量增加,比例升高,提示这种平衡向Th17 方向漂移。
如果能抑制Th17 细胞介导的这一促炎症反应过程,在一定程度上稳定免疫内环境,可能达到抑制肺纤维化的作用。
有研究表明,NOTCH 信号通路能够上调小鼠胸腺及外周Treg 的数量并维持其转录因子Foxp3 的表达[9]。经典NOTCH 信号通路的激活主要是通过相邻细胞间的NOTCH 受体与配体的结合启动,诱导受体构型发生改变,受体的细胞外段被基质金属蛋白酶切割,γ-分泌酶裂开并释放NOTCH 胞内段(NICD),进而NICD 迁移到细胞核内,与下游效应蛋白CSL 结合,激活NOTCH 靶基因的转录[10-11],从而发挥促进细胞增殖、抑制细胞分化等生物学功能[12]。研究表明,NOTCH 信号的激活主要取决于γ-分泌酶的活性,DAPT 能够阻断NOTCH 受体活化的中心环节,使NOTCH 受体分子无法进一步转变为有效的活性片段,进而完全阻断NOTCH 信号通路的激活[13]。有研究表明,在小鼠促Th17 分化的细胞因子环境中有NOTCH信号分子的活化,阻断NOTCH 信号通路则明显下调Th17 细胞相关细胞因子的产生,减轻Th17 细胞及其效应细胞因子IL-17A 介导的炎症,且NOTCH 信号能直接调控Th17 细胞特异转录因子RORγt 的表达[14]。在哮喘的研究中发现,过敏性哮喘患儿外周血中IL-17含量增加,Th17/Treg 细胞失调,这种变化伴随着NOTCH1 的高表达,说明Th17 活化与NOTCH 的激活有关[15]。
本研究模型组中NOTCH1 表达增加,提示NOTCH信号通路在肺纤维化中激活,与Th17 相关。用DAPT抑制NOTCH 信号途径后,DAPT 组IL-17 的mRNA 及外周血水平均降低,与NOTCH1 呈正相关。上述结果表明,NOTCH 信号通路的激活可能促进T 细胞向Th17分化,DAPT 抑制NOTCH 信号则抑制Th17 细胞的活化。
NOTCH 信号通路较为复杂,不同的NOTCH 受体和配体结合对T 细胞亚型的分化及细胞因子的分泌出现不同的效应,加之NOTCH 与其他信号通路间有多维调控网络,使得目前NOTCH 信号通路对T 细胞调控的具体机制尚存在一定的争议。COUTAZ 等[16]认为,在一般情况下,NOTCH 负调节Th17 细胞的分化,但机体受到外界刺激时,NOTCH 能通过影响胞内细胞因子的转运而加速Th17 细胞因子的释放,从而抵消原有的效应,因此认为NOTCH 信号作用的发挥具有环境依赖性。而BAILIS 等[17]则认为虽然环境状态会影响基因表达的扩增,但NOTCH 调控关键转录因子的能力并无改变。即使在强极化条件下,NOTCH 也能直接调节T 细胞分化的关键转录因子,NOTCH 信号通过增强CD4+T 细胞各亚群的环境敏感性而对其亚群产生无偏移扩增。
本研究只是初步探讨肺纤维化动物模型中NOTCH 信号对Th17 的影响,将进一步深入靶向研究,了解更多的肺纤维化的发病机制。

