康复新液对人工诱导的大鼠慢性溃疡性结肠炎的作用及机制初探
刘胜帅,张 俊,戴莉萍,2,万 苹,3,耿福能,4,沈咏梅,4,张成桂,刘 衡
(1.大理大学云南省昆虫生物医药研发重点实验室,药用特种昆虫开发国家地方联合工程研究中心,中国西南药用昆虫及蛛形类资源开发利用协同创新中心,云南 大理 671000;2.大理白族自治州人民医院病理科,云南 大理 671000;3.云南省第一人民医院消化内科,云南 昆明 650032;4.药用美洲大蠊四川省重点实验室,四川 成都 610000)
溃疡性结肠炎(Ulcerative colitis,UC)是炎症性肠病中的一种,临床主要表现为腹痛、腹泻及黏液脓血便,其发病机制尚未清楚,属中医的“泄泻”“久痢”“便血”等范畴[1]。研究表明,UC的发病与免疫、遗传、环境、感染等因素密切相关,目前临床治疗UC的药物主要有5-氨基水杨酸类、肾上腺皮质激素类、免疫抑制剂类等[2-3],但尚未有特效的治疗方案和药物,且长期使用上述药物后不良反应较多,给患者带来更多痛苦,因此寻找治疗UC的有效药物显得尤为重要。随着中药防治溃疡性结肠炎的临床报道越来越多,中药以疗效好、毒副作用小[4]的优势创造了中国传统医药治疗UC的契机,也为抗UC新药提供了新的研究热点。
美洲大蠊(Periplaneta americanaL.)俗称蟑螂,入药始载于《神农本草经》[5],其在云南民间已有悠久的入药历史。现代医学研究发现,美洲大蠊具有抗肿瘤、增强机体免疫力、护肝、抗菌、消炎镇痛、组织修复等作用[6]。经过多年的临床使用,发现康复新液不仅对体表创伤有效,还能治疗胃及十二指肠溃疡、溃疡性结肠炎等多种顽固性消化道疾病[7]。本项目组成员前期研究发现,康复新液能有效缓解噁唑酮和2,4-二硝基氯苯诱导的UC大鼠的炎症程度[8]。本实验采用家兔结肠抗原致敏联合醋酸诱导SD大鼠UC模型,考察康复新液对慢性免疫型UC的疗效及作用机制,为康复新液用于UC临床治疗提供实验依据。
1 材料与方法
1.1 药物 将市售康复新液干燥成黏稠状浸膏,用生理盐水(NS)配成含稠膏167 g/L的高剂量溶液;再将高剂量溶液依次用NS等倍稀释成康复新中、低剂量溶液。柳氮磺胺吡啶肠溶片(上海信宜天平药业有限公司)。
1.2 动物 SPF级SD雄性大鼠60只,体重180~220 g,购自四川成都达硕实验动物有限公司,许可证号:SCXK(川)2015-030,批号:20160725;健康家兔20只,雌雄不拘,体重3.0~3.5 kg,大理大学实验动物中心提供;大理大学实验动物中心IVC系统(18℃,50%RH)适应性饲养。
1.3 主要试剂及仪器 隐血试剂盒、大鼠IL-17 ELISA试剂盒、大鼠EGF ELISA试剂盒、大鼠MPO试剂盒(南京建成生物工程研究所);大鼠TNF-α ELISA试剂盒、大鼠IL-8 ELISA试剂盒(购自欣博盛QuantiCyto©生物科技有限公司);201酶标仪(购自奥地利安图斯公司)。
1.4 方法
1.4.1 模型建立 随机选取50只大鼠,参照《药理实验方法学》[9]和文献方法[10]-[12],制备家兔抗原内容物冻干粉作为抗原,并加以改进实现模型建立。精密称取家兔结肠冻干粉520 mg,用2.75 mL NS溶解,待完全溶解后,取2.75 mL完全弗氏佐剂,涡旋混匀制备成抗原乳化液,分别于第1、8、15、22、29 d在大鼠左侧足跖、右侧足趾、腹股沟、背部皮下及腹腔注射抗原乳化液0.1 mL,现配现用;大鼠末次注射抗原乳化液后(末次注射不加佐剂),禁食不禁水24 h,异氟烷麻醉,聚乙烯导管插入大鼠肛门约8 cm处,缓慢注入5%醋酸水溶液1.0 mL,滞留15 s,4 mL NS冲洗干净,然后给予抗原(不含完全弗氏佐剂)溶液1.0 mL(含抗原8 mg),30 min后再用4 mL NS冲洗,造模完成。剩余10只大鼠为正常对照,按上述方法平行操作,用NS替代造模试剂。
1.4.2 分组及给药 将造模大鼠随机分为5组:模型对照组,SASP组(300 mg/kg·bw)(阳性药对照组),康复新液高剂量组(2.5 g/kg·bw)、中剂量组(1.25 g/kg·bw)、低剂量组(0.625 g/kg·bw),每组10只。正常对照组、模型对照组给予NS,其余各组灌肠给予相应体积的药物,各组于造模后第1天开始灌肠给药,连续14 d,并于给药第1、4 、7 、10 、14天参照 Hamamoto[13]对大鼠进行疾病活动指数(Disease activity index,DAI)评分。末次给药后,禁食不禁水24 h,用10%水合氯醛溶液(3.0 mL/kg·bw)麻醉大鼠,腹主动脉取血,离心取上层血清,按试剂盒说明书检测IL-8、IL-17的含量;取肝脏、脾脏、胸腺称重,计算脏器指数;沿肠系膜缘剪开肠腔,清洗后取结肠称湿重,参照Ekström G M等[14]和Luk等[15]标准进行结肠黏膜损伤指数(Colonmucosa damage index,CMDI)评分,切取病变严重结肠组织匀浆,离心后取上清液,按试剂盒说明书检测EGF、MPO、TNF-α含量。剩余结肠制作病理切片,参照Ekström G M等[14]标准进行病理组织学评分(Histopathological score,HS)。
1.4.3 统计学处理 采用统计软件SPSS 17.0进行检验,各组试验数据均以“±s”表示,符合正态分布的数据采用方差检验,不符合正态分布的数据,采用秩和检验,以P<0.05或P<0.01表示有统计学差异。
2 结果
2.1 康复新液对UC大鼠DAI评分的影响 造模后第1天,UC模型大鼠出现不同程度的厌食、懒动、体重下降、腹泻、血便等现象,DAI评分显著升高,提示模型成功,且给药期间模型稳定;随着治疗时间延长,各给药治疗组大鼠的DAI评分逐渐降低,造模后第14天,与模型对照组比较,各给药治疗组大鼠DAI评分显著降低,结果见表1。
表1 康复新液对UC大鼠DAI评分的影响(±s,n=10)

表1 康复新液对UC大鼠DAI评分的影响(±s,n=10)
注:与正常对照组比较,∗P<0.05,∗∗P <0.01;与模型对照组比较,△P <0.05,△△P <0.01;与 SASP组比较,▲P <0.05,▲▲P <0.01,下表同及下图同
组别________________________________________________DAI评分____________________________1 d 4 d 7 d 10 d 14 d正常对照组 2.00±0.82 1.80±0.79 1.30±1.06 1.70±0.48 1.40±0.84模型对照组 8.10±1.49∗∗ 6.90±2.07∗∗ 4.50±2.07∗∗ 4.10±1.66∗∗ 4.80±1.23∗∗SASP组 8.50±1.81∗∗ 6.90±1.20∗∗ 2.90 ±1.37∗△ 2.80±1.40∗△ 1.90 ±0.74△△康复新液低剂量组 7.50±1.12∗∗ 7.00±1.67∗∗ 4.20±1.37∗∗▲ 3.90±2.21∗∗ 2.70±0.82∗∗△△▲康复新液中剂量组 8.20±1.93∗∗ 6.70±2.78∗∗ 3.90±1.91∗∗ 3.30±1.83∗ 2.40±0.84∗∗△△_康复新液高剂量组 8.30±1.76∗∗ 6.20±1.89∗∗ 3.00±1.83∗ 2.60±1.71△ 2.00±0.79△△
2.2 康复新液对UC大鼠脏器指数的影响 经统计学分析,该模型及药物对大鼠肝脏、脾脏、胸腺指数均无影响。
2.3 康复新液对UC大鼠结肠的影响 模型对照组大鼠结肠指数显著增大、长度显著缩短及长宽比显著减小,各给药治疗组大鼠结肠指数显著减小,SASP组结肠长度、长宽比显著增大。正常对照组结肠黏膜无水肿、糜烂和溃疡的形成;模型对照组肠壁可见明显充血、水肿,沿肠系膜纵向剖开可见近肛段肠壁黏膜有散在的溃疡点和糜烂;各给药治疗组大鼠肠黏膜病变较模型对照组有不同程度好转。康复新液各剂量组大鼠CMDI显著降低,结果见表2。
表2 康复新液对UC大鼠结肠的影响(±s,n=10)

表2 康复新液对UC大鼠结肠的影响(±s,n=10)
__________组别 结肠指数/(mg/g) 结肠长/(cm) 长宽比 CDMI评分正常对照组 3.77±0.92 19.65±1.09 25.66±3.45 0.60±0.52模型对照组 7.17±0.87∗∗ 16.37±0.43∗∗ 18.50±3.87∗∗ 3.10±0.88∗∗SASP 组 4.21±0.66△△ 18.39±1.69∗△△ 22.64±1.87∗∗△△ 2.00 ±0.47∗∗△△康复新液低剂量组 5.68±0.55∗∗△△▲▲ 16.73±1.52∗∗▲▲ 19.79±1.59∗∗▲ 2.30±0.67∗∗△△康复新液中剂量组 4.93±0.75∗∗△△ 17.01±0.65∗∗▲▲ 21.27±1.48∗∗△ 2.20±0.42∗∗△△____康复新液高剂量组 4.57±0.98∗△△ 17.33±0.94∗∗▲ 22.48±1.64∗∗△△ 2.10±0.57∗∗△△
2.4 康复新液对大鼠UC血清IL-8、IL-17水平表达的影响 模型对照组大鼠血清IL-8、IL-17的表达显著增加;给药治疗后,各给药治疗组大鼠血清IL-8、IL-17含量显著降低,结果见图1、图2。

图1 康复新液对大鼠UC血清IL-8水平表达的影响

图2 康复新液对大鼠UC血清IL-7水平表达的影响
2.5 康复新液对UC大鼠结肠组织EGF、MPO、TNF-α水平表达的影响 模型对照组大鼠结肠MPO、TNF-α表达显著增加、EGF表达显著降低;各给药治疗组大鼠结肠中TNF-α表达均显著减少,柳氮磺胺吡啶肠溶片组及康复新液高剂量组结肠中EGF表达显著增高、MPO表达显著减少;康复新液高剂量组结肠中EGF、MPO、TNF-α表达水平与SASP组相当,结果见图3、图4、图5。
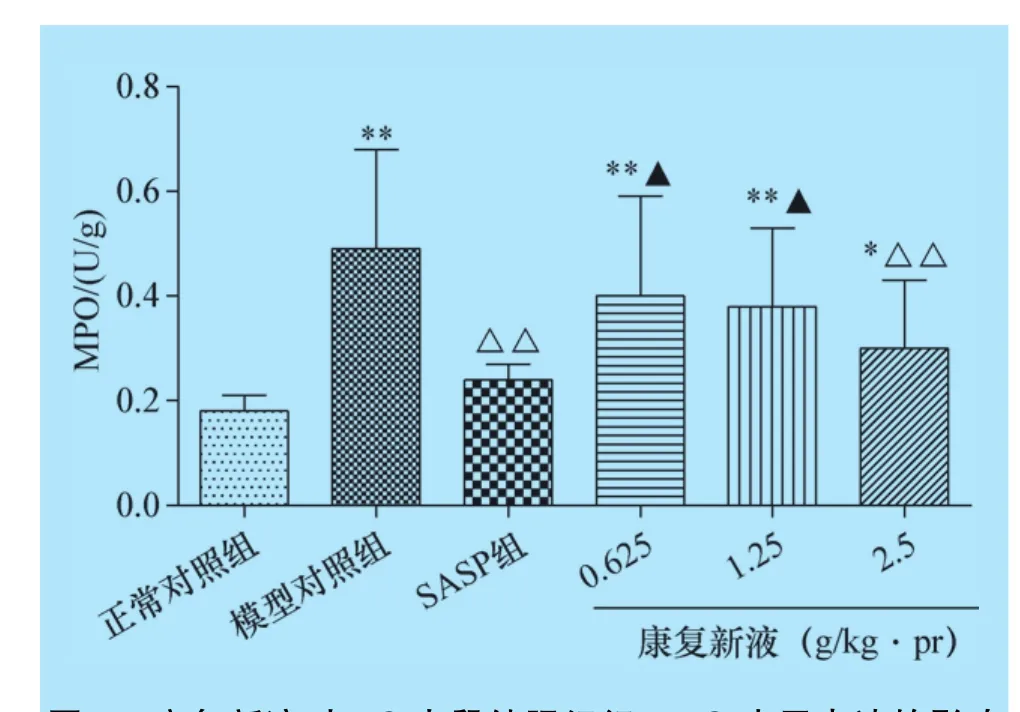
图4 康复新液对UC大鼠结肠组织MPO水平表达的影响

图5 康复新液对UC大鼠结肠组织TNF-α水平表达的影响
2.6 康复新液对UC大鼠结肠组织HS分值的影响 正常对照组大鼠结肠结构完整,黏膜层、黏膜下层、肌层及浆膜层完整清晰,肠黏膜上皮完整,腺体排列整齐,隐窝正常,细胞形态正常,整体无充血水肿现象,无炎性细胞浸润;模型对照组大鼠上皮细胞、炎性细胞及HS评分显著升高;各给药治疗组大鼠上皮细胞、炎性细胞和HS评分均显著降低,其中康复新液高剂量组与SASP组评分数值相当,无统计学差异,结果见图6、图7、图8及中插彩版图9。
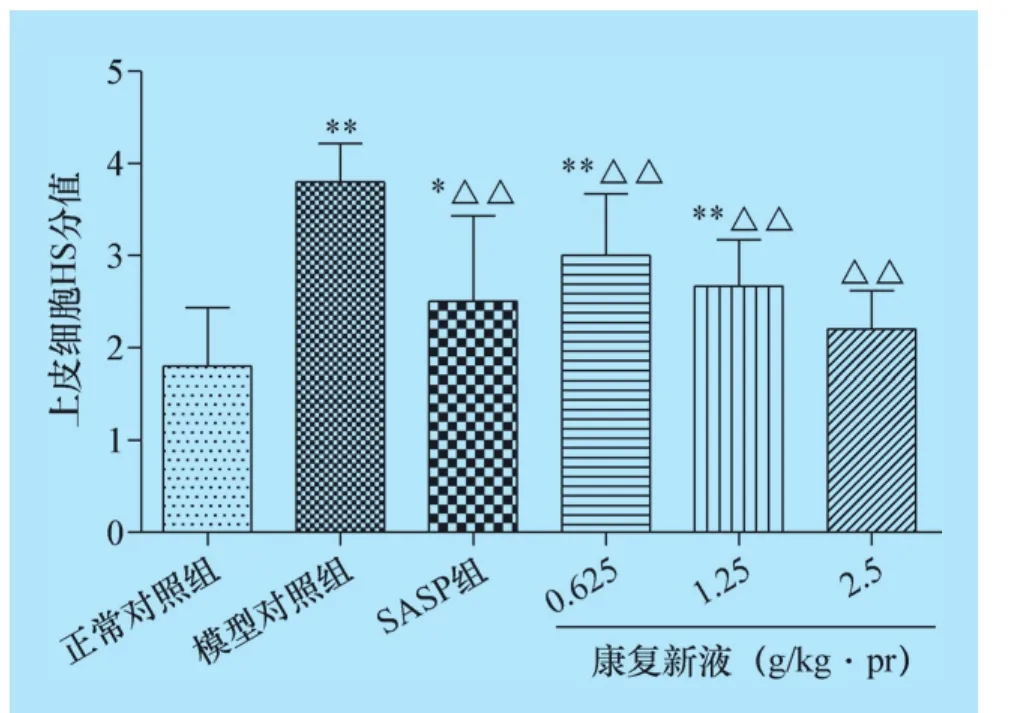
图6 康复新液对大鼠结肠组织上皮细胞的影响
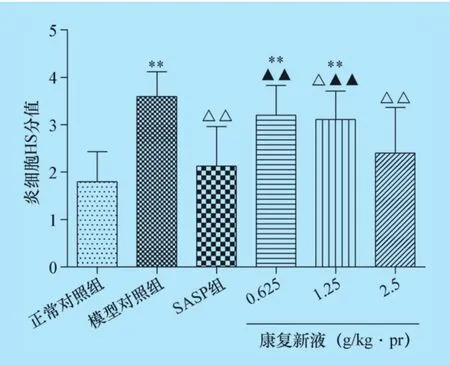
图7 康复新液对大鼠结肠组织炎细胞的影响
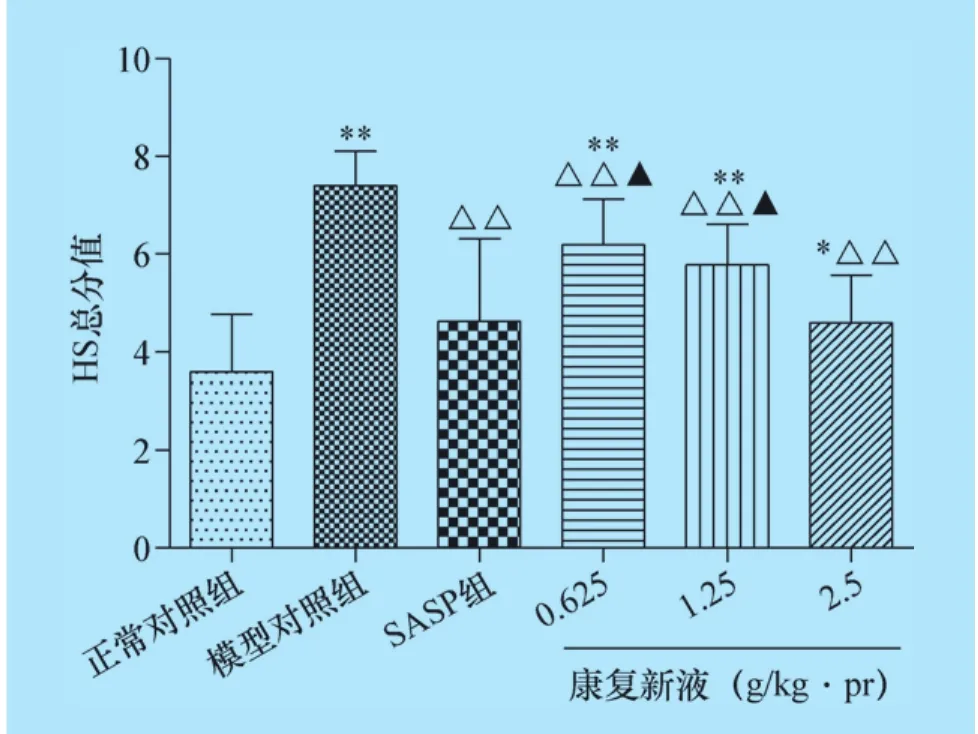
图8 康复新液对大鼠结肠组织HS总分值的影响

图9 UC大鼠结肠组织病理切片 (H.E.染色,×200)
3 讨论
本试验采取家兔结肠抗原致敏联合醋酸诱导大鼠慢性溃疡性结肠炎,UC大鼠结肠病变特征与人类溃疡性结肠炎的病变较为相似[16]。完全弗氏佐剂可以加强机体对抗原的反应并刺激局部免疫反应,多次多点注射后,引起大鼠免疫过度或者无节制免疫反应[17]。乙酸破坏肠黏膜,增加血管通透性,激活激肽,干扰凝血,启动炎症[18],形成局部炎症病变,最后给予抗原灌肠,引发大鼠全身性的免疫反应,达到全身免疫变化异常和局部炎症病变的结合,最终诱导成慢性溃疡性结肠炎。
造模后大鼠出现典型UC症状,经康复新液灌肠治疗后,与模型对照组相比较,UC大鼠体征及各项炎症指标均不同程度的改善。炎性趋化性因子IL-8,能趋化嗜中性粒细胞作用于炎症部位,MPO含量的变化可反映嗜中性粒细胞对组织的浸润程度,康复新液灌肠后 UC大鼠IL-8和MPO的表达均显著降低,证实康复新液灌肠能有效减轻UC的炎症;Th17细胞是一类产生IL-17的Th细胞亚群,与许多炎症反应和自身免疫性疾病的发生和发展有关,IL-17通过促进释放TNF-α前炎性细胞因子来放大炎症反应,而TNF-α又是公认的介导UC的细胞因子参与了UC的发生、发展[19-21],上述试验中模型对照组大鼠IL-17和TNF-α表达显著增加,经康复新液灌肠后UC大鼠 IL-17和TNF-α的表达显著减少,推测康复新液通过参与免疫调节起到缓解UC的症状;EGF能促进细胞的增殖、分化,在UC大鼠肠道黏膜损伤和修复中发挥着重要作用[22],康复新液灌肠给药后,UC大鼠CMDI分值降低、结肠EGF的表达显著增加、HS评分上皮细胞分值显著下降,证实康复新液促进肠损伤黏膜修复,起到缓解UC症状的作用。

