miR-183的调控功能及在畜禽动物上的研究进展
谢 清,杨冰洁,罗国栋,杨成迎,杨 阳,杨昌沛,黄华宇,甘 玲,2
(1.西南大学动物科学学院,重庆 荣昌 402460;2.重庆市兽医科学工程研究中心,重庆 荣昌 402460)
MicroRNA-183(miR-183)是 miR-183簇(miR-183 Cluster,miR-183C)包括定位于人7号染色体(7q31~34)上的 miR-183、miR-182以及 miR-96的一员,在物种进化上高度保守[1]。近年来,miR-183的功能研究主要有:(1)miR-183的异常表达介导了肿瘤的发生发展及诸多癌症如肺癌[2]等调控其增殖、转移以及入侵等,起着肿瘤抑制剂或促癌的作用,可作为其潜在的诊疗靶标;(2)miR-183参与其他疾病比如白血病[3]等的调控;(3)miR-183参与了感觉器官和神经系统的发育及部分功能的调控;(4)miR-183在动物的应激反应及代谢调控中发挥重要作用。本文就miR-183的功能及在畜禽动物身上的研究进行综述,为畜禽miRNA的深入研究提供理论参考。
1 MicroRNA(miRNA)作用方式
miRNA是长度约为22 nt的内源性非编码单链小RNA,人类首次发现是在秀丽隐杆线虫(Caenorhabditis elegans,C.elegans)[4]。miRNA 通过和靶基因3′非翻译区(3′-UTR)结合而调控基因转录后的表达。通常,miRNA与靶mRNA的3′-UTR结合会降低蛋白质表达水平,然而,也有报道显示,miRNA可以诱导蛋白质表达增加[5]。且一个miRNA可以靶向多种mRNA发挥其广泛的调节功能;另一方面,mRNA也可被不同的miRNA调控[6]。由此可见,miRNA对其靶基因的作用方式存在协作性和发散性。
2 miR-183功能研究
2.1 miR-183对神经系统功能的调控 早前研究显示,miR-183在成年大鼠的背根神经节受损后其表达显著减少且与应激颗粒(Sstress granule,SG)蛋白的分布有关,暗示miR-183可能通过疼痛相关基因来调节慢性神经性疼痛[7]。大鼠脊髓神经结扎后miR-183显著下调,且减弱结扎诱导的机械性异常疼痛,表明神经系统中表达的miR-183可能介导神经性疼痛的过程[8]。Shi等[9]等也发现,miR-183-5p可通过抑制Twik相关的K+通道1(TWIKRelated K+Channel 1,TREK-1)减轻慢性压迫性损伤诱导的神经性疼痛。痛觉感受器一直是神经性疼痛镇痛药物开发的焦点,因此miR-183在痛觉感受器的研究可为神经性疼痛镇痛药物的开发提供新思路。
2.2 miR-183对感觉器官功能的调控 在听觉系统中,miRNA的功能研究主要体现在内耳发育[10]。正常大鼠耳蜗感觉上皮中miR-183在噪声暴露1天后的表达显著降低,且丝/苏氨酸激酶Tao1的翻译区有两个结合位点与miR-183序列完全互补[11]。最新研究显示,miR-183C在调节小鼠耳蜗细胞凋亡以及体内稳态方面发挥重要作用,且验证了翅缘缺刻1(Notch1)等是miR-183C的靶点[12]。
2.3 miR-183对应激反应的调控 哺乳动物急性应激下,海马CA1和中央杏仁核中的miR-183表达显著升高,预测显示miR-183靶向肌动蛋白结合蛋白(profilin-2,PFN2)等[13],而PFN2能调节肌动蛋白聚合,是决定神经元中树突棘形态的关键因子,敲除PFN2基因将严重影响神经递质稳态和小鼠的行为[14]。Zhou等[15]研究发现,慢性不可预见的轻度压力可导致海马组织中miR-183-5p显著上调,暗示其可能与压力引起的抑郁症有关。
2.4 miR-183参与疾病的调控 在转基因小鼠及其体外模型以及非酒精性脂肪变性患者的肝活检标本中发现环氧合酶-2(Cyclooxygenase-2,COX-2)通过降低miR-183的表达来上调胰岛素受体底物1,从而保护肝细胞免受胰岛素抵抗[16]。Chandel等[17]发现,二乙基亚硝胺诱导的大鼠纤维化肝中miR-183C被显著上调,提示miR-183C与慢性肝病相关,可能在纤维化维持和进展中发挥作用。当前对miR-183在肝疾病方面的研究仅限于人和模型动物,而产生动物临床上的疾病也越来越多,而miR-183在兽医临床方面的研究却未见相关报道。
3 miR-183在动物生产上的研究
随着高度集约化养殖生产模式的推进,畜禽疾病的发生趋于复杂化和多元化。而miR-183在畜禽疾病方面的研究报道却相对较少。
3.1 牛miR-183的研究进展 越来越多的证据表明,miRNA参与动物机体重要的生理过程,早先Salilew等[18]从牛发情周期的从属卵泡和优势卵泡颗粒细胞进行miRNA差异表达分析发现,优势卵泡颗粒细胞中miR-183C的上调尤为显著。随后,Gebremedhn等[19]发现,miR-183C通过协同靶向叉头框蛋白O1(Forkhead box protein O1,FOXO1)促进牛颗粒细胞的增殖和G1/S转换,表明miR-183能通过靶向FOXO1对颗粒细胞的增殖发挥关键的调节作用。然而当前,miR-183在牛的其他疾病方面的研究未见相关报道。
3.2 山羊miR-183的研究进展 Chen等[20]分析发现,miR-183能通过靶向乳腺上皮细胞中的哺乳动物Ste20样激酶1(Mammalian sterile 20-like kinase 1,MST1)基因来抑制山羊乳脂的合成。且miR-183在山羊前脂肪细胞分化过程中上调并显著增加成脂基因过氧化物酶体增殖物激活受体γ(Peroxisome proliferator-activated receptor γ,PPARγ)等的表达,且验证显示Smad蛋白4(SMAD family member 4,Smad4)是其靶标,miR-183的过度表达显著抑制Smad4的mRNA和蛋白质水平,而Smad4的抑制大大加速了脂质沉积并增加脂肪形成基因的表达[21]。由此可见,miR-183通过抑制Smad4的表达来促进山羊前脂肪细胞的分化。该研究为进一步提高山羊的肉品质提供了科学依据。
3.3 猪miR-183的研究进展 Chen等[22]在大白猪和梅山猪雌猪的背膘组织中发现miR-183在梅山猪的表达高于大白猪,WRP信号通路的表面辅助受体组分低密度脂蛋白受体相关蛋白6(Low-density lipoprotein receptor related protein 6,LRP6)在其UTR区有miR-183特定的结合位点,即 LRP6可能是miR-183的潜在靶标。LRP6辅助受体对调节脂肪形成和潜在的白色脂肪组织发展至关重要[23],所以miR-183可能通过靶向LRP6调控脂肪的形成,然而miR-183是否在脂肪形成和脂肪沉积中真正起作用仍有待进一步研究。
动物海马从功能上可划分为背侧区和腹侧区。Yang等[24]首次考察了荣昌仔猪背侧海马(DH)和腹侧海马(VH)中miRNA的表达特征,发现VH中miR-183的表达显著高于DH,揭示miR-183可能参与了荣昌仔猪的采食调控。该研究也进一步评估了氧化应激(Oxidative stress,OS)仔猪海马miRNA的表达变化,结果表明,相对于 VH,miR-183在OVH中显著下调且靶向肾上腺髓质素2(Adrenomedullin 2,ADM2)。分析发现ADM2参与了对免疫和氧化应激相关基因表达途径的调控。该研究结果将对动物甚至人类与氧化应激相关疾病的防治研究提供了重要的信息。
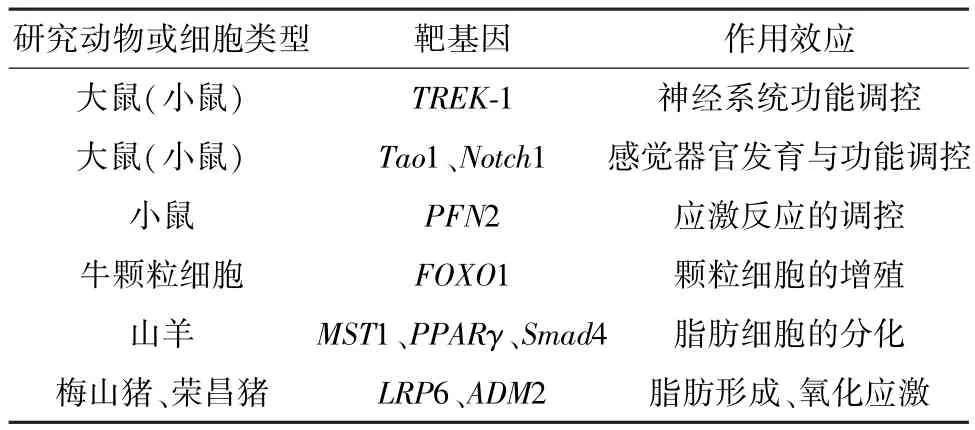
表1 动物miR-183的功能及靶基因
3.4 鸡miR-183的研究进展 禽类基底乳头与哺乳动物听觉器官有相似之处。Zhang等[25]发现在鸡听觉器官发育中,miR-183在所有前庭器官和基底乳头顶端部分的毛细胞中高度表达。该研究对养禽业中声音对鸡产生应激方面的调控研究提供重要信息。然而,miR-183在听觉系统方面的研究还有待进一步深化。
4 展望
综上所述,miR-183广泛参与了动物机体生命活动过程,并对肿瘤、免疫疾病的发生及发展过程具有重要的调控作用,当前miR-183在动物的主要调控功能研究如表1所示,大多是以病理细胞或模型动物为对象,所以miR-183的相关研究还处于比较局限的阶段,尤其在畜禽上miR-183仅限于表达水平的研究,对疾病的调控机制研究相对欠缺,而miRNA介导的转录后表达调控是疾病预防、诊断、治疗的切入点,目前,已有药物制造商生产出应用于临床的miRNA治疗试剂,比如激活剂(Mimic)及抑制剂(Inhibitor)[26],而动物生产与临床却未见报道,相信在不久的将来,随着miRNA在调控机制方面研究的不断深入与分子诊断技术不断完善及推广应用,miRNA在动物医学领域的研究与应用定会取得突破性进展。

