碳氮源和盐度对异养黄丝藻脂肪酸产量的影响
冯倩 王琳 蔡忠贞
摘要 [目的]以分離获得的一株黄丝藻ENN172(Tribonema sp.)为材料,优化异养培养工艺,提高脂肪酸产量。[方法]研究黄丝藻ENN172在1 g/L初始接种浓度黑暗培养时,不同葡萄糖浓度、不同氮源NaNO3、酵母提取物、蛋白胨、尿素以及NaCl浓度对细胞生物量和脂肪酸含量的影响。[结果]葡萄糖20 g/L时生物量最高但脂肪酸含量最低,随浓度增加,生长速率下降,脂肪酸含量增加,综合比较,30 g/L时脂肪酸产量最高。蛋白胨1 g/L培养10 d时,生物量达到对照组的2.3倍,脂肪酸产量是对照的2.1倍。添加2 g/L酵母提取物培养10 d时,生物量达到对照的1.7倍,脂肪酸产量是对照组的1.6倍。蛋白胨和酵母提取物对ENN172生物量及脂肪酸产量均有促进作用,添加硝酸钠和尿素对脂肪酸产量无显著促进。NaCl 10 g/L时在第6天脂肪酸含量达到最大27.03%(与初始相比提高3.4倍),添加NaCl可促进脂肪酸积累但不利于生物量增加。[结论]通过优化脂肪酸生产条件,葡萄糖30 g/L为低氮条件最佳诱导浓度,蛋白胨和酵母提取物可以作为脂肪酸生产优选氮源,在诱导期添加NaCl利于提高脂肪酸含量。综上结果,黄丝藻作为新型能源微藻具有一定异养生产脂肪酸的能力,深入优化培养条件仍有上升空间,有望成为微藻产业化养殖的潜力藻株。
关键词 黄丝藻;异养;氮源;盐度;脂肪酸
中图分类号 Q 939.97 文献标识码 A
文章编号 0517-6611(2019)12-0098-06
doi:10.3969/j.issn.0517-6611.2019.12.027
开放科学(资源服务)标识码(OSID):
Abstract [Objective] A strain of Tribonema sp. was used as a material to optimize the heterotrophic culture process and increase the yield of fatty acids.[Method] The effect of the concentration of glucose, different nitrogen sources including sodium nitrate, yeast extract, peptone, urea and sodium chloride on coded as ENN172 in this research was examined. The initial culture concentration was kept at 1 g/L for all experiments. [Result]The highest biomass production and the lowest fatty acid content was obtained with the glucose concentration at 20 g/L. The biomass production decreased and fatty acid content increased with the increasing of glucose concentration, with the fatty acid content reaching the highest at 30 g/L of glucose.The addition of 1 g/L peptone and 2 g/L yeast extract increased the biomass significantly, with the biomass reaching 2.3 and 1.7 times, respectively, compared to that of the control in 10 days. However, there was no effect identified by introducing sodium nitrate and urea to the culture.The lipid content peaked at 27.03% (3.4 times)of the dried biomass in 6 days with sodium chloride concentration at 10g/L while the biomass production was suppressed as expected. [Conclusion] Overall, the optimized condition for lipid production is by keeping glucose at 30 g/L and nitrogen at a very low condition (1.5 g/L of NaNO3). In addition, peptone and yeast extract can be used as a nitrogen source, and sodium chloride was an effective way to generate high lipid concentration biomass when needed. In conclusion, this particular Tribonema strain is capable of producing lipid with heterotrophic culture, which has the potential to be used as a commercial strain.
Key words Tribonema sp.;Heterotrophic;Nitrogen source;Salinity;Fatty acid
目前,有关微藻的研究主要集中在小球藻属(Chlorella spp.)、栅藻属(Scenedesmus spp.)和杜氏盐藻属(Dunaliella spp.)等单细胞微藻中,但这些藻类在培养过程中不仅难以收获,而且还容易遭受原生动物的吞食[1-2]。自然界中存在许多丝状藻类,隶属于不同的门类,如绿藻门、黄藻门和蓝藻门等[3]。黄丝藻(Tribonema sp.)隶属于黄藻纲、黄丝藻属,普遍分布于淡水环境中,共有27种,我国有16种,2变种[4]。丝状藻类中,螺旋藻(Spirulina sp.)应用较为普遍,具有生长快、蛋白含量高和抗污染等优点,广泛应用于保健品和食品行业[5]。黄丝藻可以在没有絮凝剂的条件下进行过滤收获,收获率高达98.69%[6],且Wang等[2,6]研究发现,细胞尺寸较大的藻类能够很好地抵抗原生动物的吞食。一些黄丝藻具有良好的氮、磷吸收能力,常应用在污水处理中[7-8]。目前,有关黄丝藻的研究大多基于生态治理方面,而对其资源利用的报道相对较少。新奥科技有限公司生物质能技术中心自主分离获得一株黄丝藻ENN172,具有生长速度快、易稳定培养、易收获等优点,且富含不饱和脂肪酸EPA(二十二碳五烯酸)、多糖等。人体缺少合成EPA的酶系统,自身不能合成EPA,只能通过从外界摄取来满足自身需求[9-10]。EPA对婴幼儿大脑发育有明显的促进作用,且能够预防和治疗人类多种疾病[11]。藻多糖对正常细胞无毒副作用,对防止癌症、降低血糖血脂具有獨特效应,已成为开发新药特药的主要方向之一[12]。探索黄丝藻培养及脂肪酸诱导方式,实现生物质与脂肪酸更高更快积累,将为其大规模培养提供有力保障。
目前,微藻的大规模商业化培养主要限于在光生物反应器中进行,具有占地面积大、生产周期长、藻类生长密度较低等缺陷,变相增加了生产的成本,限制了微藻培养的规模化发展。寻找一种高密度、低成本培养微藻的方法,对微藻培养产业化的进一步发展极为重要。1953年,Lewin[13]首先发现了一些藻类能利用有机物作为唯一碳源和能源进行异养生长,由此拉开了微藻异养培养研究的序幕。利用工业发酵方法异养培养微藻,可以节省空间,提高产量,避免杂藻和细菌的污染,且培养条件容易控制,是微藻大规模产业化生产的发展趋势,国内外对此的研究也越来越多。
而黄丝藻异养培养积累脂肪酸的研究很少。Wang等[14]研究5种黄丝藻自养、异养和混养条件下的脂肪酸积累情况发现,异养和混养时脂肪酸都有较高的产量。 Zhou 等[15]优化了黄丝藻的异养培养条件,在葡萄糖和尿素培养时,最大生物质浓度达30.8 g/L,脂肪酸产量30.8 mg/(L·d);其中异养培养时葡萄糖浓度、氮源种类对脂肪酸影响较大。另据文献报道,盐度对藻类脂肪酸积累也有不同程度的影响[16]。因此,该研究对黄丝藻异养碳源、氮源和盐度对其脂肪酸积累速度和含量进行了探索,为黄丝藻快速应用提供支持。
1 材料与方法
1.1 材料
1.1.1 藻种。新奥科技发展有限公司生物质能技术中心自主分离的一株黄丝藻,编号ENN172,保藏于内部藻种库。
1.1.2 主要试剂。BG11培养基的营养成分:NaNO3 1.5 g/L,K2HPO4 0.04 g/L,MgSO4·7H2O 0.075 g/L,CaCl2·2H2O 0.036 g/L,NaHCO3 1 g/L,Citric acid 0.006 g/L,FeSO4·7H2O 12 mg/L、A5微量元素液1 mg/L。葡萄糖,蛋白胨,酵母提取物,尿素。其他试剂均为常规分析试剂。
1.1.3 主要仪器。电子天平(梅特勒 SI114);恒温电热鼓风干燥箱(GZX-9140MBE);上海博迅;家用电冰箱(BCD238f /X1);高压灭菌锅(上海鼎谦生物科技 MJ-54A);无菌工作台(SW-CJ-1FD)。
1.2 试验方法
1.2.1 藻细胞培养。
异养藻种预培养:以淡水微藻常用的BG11 培养基为基础,添加10 g/L葡萄糖作为异养黄丝藻培养基,在250 mL玻璃三角瓶装液量100 mL,后在无菌工作台内接种少量活化的黄丝藻进行初级异养藻种扩培;后将初级藻种接种至300 mL上述培养基中进行二级藻种扩培;藻种扩培中使用的培养基及玻璃器皿均高压灭菌。
1.2.2 不同葡萄糖浓度培养。
将黄丝藻二级藻种用300目绢筛过滤清洗,获得浓缩藻丝后加入无菌水稀释待用,标记为初始藻液。取等量初始藻液用绢筛过滤浓缩后分别加入不同葡萄糖浓度的700 mL BG11培养基中溶解,记为试验藻液。糖浓度分别为20、30、40、60 g/L,后将各试验藻液分为6份,每份100 mL接种至200 mL三角瓶。置于摇床中25 ℃、140 r/min黑暗培养,分别于第6、第8、第10天每组各取出2瓶,检测干重、脂肪酸含量,滤液检测总糖含量。
1.2.3 不同氮源培养。
同“1.2.2”方法获得初始藻液。取等量初始藻液绢筛过滤浓缩后分别接种至不同氮源种类和浓度的700 mL BG11培养基中,添加葡萄糖50 g/L,记为试验藻液。各试验组条件:NaNO3浓度0.5、1.5、3.0 g/L,蛋白胨1.0、3.0、5.0 g/L,酵母提取物2.0、4.0、6.0 g/L,尿素1.0、3.0、5.0 g/L。后将各试验藻液分为3份,每份100 mL接种至200 mL三角瓶,培养方法同“1.2.2”。
1.2.4 不同盐度培养。
同“1.2.2”方法获得初始藻液。取等量初始藻液绢筛过滤浓缩后分别接种至不同氯化钠浓度的700 mL BG11培养基中溶解,添加葡萄糖60 g/L,记为试验藻液。氯化钠浓度分别为0、1、5、10 g/L。后将各试验藻液分为6份,每份100 mL接种至200 mL三角瓶。培养方法同“1.2.2”。
1.3 检测方法
1.3.1 干重测定。
移取三角瓶内的全部藻液,用300目筛绢过滤除去培养基,并用去离子水重复清洗过滤3次,将收获的湿藻细胞置于冻干机中干燥2 d后,称重,相同方法获得初始接种质量M1,最终质量M2,干重浓度DCW(g/L)=(M2-M1)/V,式中,V为培养体积(L)。
1.3.2 脂肪酸检测。
1.3.2.1 试样制备。取有代表性的样品2 g(精确至0.001 g),混合均匀,用滤纸筒包裹。将索氏提取器及水洗接收烧瓶各部位充分洗涤并用蒸馏水清洗、烘干。水洗接收烧瓶在105 ℃干燥箱内干燥至恒重(前后2次称量差不超过0.002 g)。将上述包裹藻粉的滤纸筒置于提取器中,连接至注入了氯仿-甲醇(2∶1,V/V)100 mL的接收瓶。连接回流冷凝管。将底瓶放在水浴锅上加热。水浴温度为80 ℃,提取20 h(直至提取器中溶剂呈无色)。
1.3.2.2 水洗。配制质量百分数为0.71%的NaCl溶液,对底瓶中溶液进行水提。关闭分液漏斗下方旋塞,将底瓶中溶液倒入分液漏斗(使用前先检查是否漏水)中,按照氯仿∶甲醇∶NaCl溶液=8∶4∶3(体积比)的比例加入NaCl溶液,盖上上方玻璃塞,180°翻转15次,混合均匀后静置分层。分层后,打开下方旋钮,取下层溶液,放入已恒重的接收烧瓶中,蒸发除去溶剂,直至烧瓶中无溶剂流动。
1.3.2.3 烘干、称量。将接收烧瓶在105 ℃烘干2 h,干燥箱内干燥冷却至室温,稱量准确至0.1 mg,前后2次称量差不超过0.002 g。脂肪酸含量等于脂肪质量除以样品质量,其计算公式为X=m1-m0m2×100,式中,X为样品中总脂肪的含量(%);m1为接收瓶和总脂肪的质量(g);m0为接收瓶的质量(g);m2为样品的质量(g)。
1.3.3 总糖检测。
取 1 mL黄丝藻藻液,在13 000 r/min条件下离心3 min 后,吸取上清液,放入测试管中,用于测定培养基中残糖量。
采用 3,5-二硝基水杨酸法[17]测定培养基中的残糖浓度,葡萄糖残糖浓度(x,g/L)的直线回归方程为A520 nm=20.132x(r=0.998 8)。
1.3.4 脂肪酸产量计算。
脂肪酸产量=DCW× TFAs,式中,DCW为生物质浓度(g/L);TFAs为总脂肪酸含量(%)。
2 结果与分析
2.1 不同葡萄糖浓度对黄丝藻生物量及脂肪酸的影响
碳源是黄丝藻异养培养的重要营养物质,是微藻细胞的能量来源和主要组成部分[18]。选取合适的碳源,对是否可以异养培养以及培养产量和产物组成等起着关键的作用。葡萄糖作为异养培养的优选碳源,具有应用广泛、利用率高、经济性佳的特点,该研究通过以BG11培养基为基础,在低氮(BG11培养基,1.5 g/L NaNO3)的条件下,优化培养基中葡萄糖的浓度,检测黄丝藻生物量,尤其是脂肪酸含量的差异,并对培养基中的残糖浓度进行监控,对比碳源利用效率,确定最佳葡萄糖浓度,提高葡萄糖对脂肪酸的转化率。添加20、30、40和60 g/L葡萄糖培养黄丝藻,生物量、脂肪酸和残糖浓度如图1所示,随着初始葡萄糖浓度的增加,最终生物量呈下降趋势,说明葡萄糖浓度过高对细胞生物量增加有一定的抑制作用,糖浓度为30和40 g/L时细胞中最终脂肪酸含量最高达25%,20 g/L时细胞脂肪酸含量最低,达15%。
结合生物量和脂肪酸对比脂肪酸产量及碳源对脂肪酸转化率,结果发现(表1),葡萄糖浓度30 g/L时脂肪酸产量最高,达1.13 g/L,葡萄糖利用率在20 g/L时达到最高10.27%,随着葡萄糖浓度的提高,脂肪酸产量和葡萄糖利用率都下降,且培养基中剩余葡萄糖浓度较高,生产中应根据培养周期、脂肪酸产量和葡萄糖利用率综合比较,确定最佳葡萄糖浓度。
2.2 不同氮源种类及浓度对黄丝藻生物量及脂肪酸的影响
氮也是微藻细胞培养的重要营养物质,是细胞内蛋白质、核酸等活性物质的重要组成成分[19]。Guo等[20]研究表明,黄丝藻(Tribonema sp.)具有独特的油脂积累规律,即在一个合适的氮浓度范围内,黄丝藻的油脂含量可随氮浓度的增加而增加,其生物质浓度和油脂含量均达到最高值,可同时实现高生物质浓度和高油脂含量的积累。另外,不同种类的氮源藻细胞生长速率和最终产物的含量具有差异性,该研究在葡萄糖充足(50 g/L)的条件下,对比单一氮源(硝酸钠、尿素)和复合氮源(酵母提取物、蛋白胨)对黄丝藻生物量、脂肪酸含量的影响。
2.2.1 硝酸钠。
利用0.5、1.5和3.0 g/L的NaNO3培养黄丝藻,对比不同培养时间生物量、脂肪酸含量的变化,结果如图2所示。添加NaNO3时最终生物量均比对照组高,尤其在培养6 d时,差异明显,随着NaNO3浓度的增加,生长速率下降,培养8 d时0.5和1.5 g/L NaNO3组生物量下降,3.0 g/L NaNO3组生物量继续增加,培养10 d时同样出现下降的情况,推测培养后期氮源耗尽,细胞进行脂肪酸积累,胞内蛋白等物质含量降低,细胞密度的差异导致生物量下降。对照组脂肪酸含量最高,添加 1.5 g/L NaNO3作为氮源时脂肪酸含量较高。综合比较脂肪酸产量,结果发现(表2),培养6 d生物量最高时,添加1.5 g/L NaNO3脂肪酸产量最高,培养8 d脂肪酸含量较高时,对照组脂肪酸产量最高。
2.2.2 蛋白胨。
蛋白胨富含有机氮化合物,能为微藻培养提供氮源、生长因子、维生素等营养物质,常作为微生物培养的氮源来源。添加1、3、5 g/L蛋白胨进行黄丝藻培养,生物量及脂肪酸含量结果如图3所示。由图3可知,试验组生物量均高于对照,蛋白胨1 g/L试验组生物量最高,在第10天蛋白胨1 g/L试验组生物量是对照的2.3倍。对照脂肪酸含量和添加蛋白胨培养时相差不大,说明添加蛋白胨可以显著提高生物量的同时,在培养后期脂肪酸积累不受影响,总体上可以大大提高脂肪酸产量,蛋白胨1 g/L时脂肪酸产量是对照组的2.1倍,蛋白胨可以作为黄丝藻ENN172脂肪酸生产优选氮源。
2.2.3 酵母提取物。
酵母提取物作为一种含有丰富氨基酸、维生素等营养物质的有机氮源,可提供藻细胞异养培养的多种营养元素需求,以其作为氮源培养ENN172黄丝藻,结果如图4所示。由图4可知,培养前期,添加酵母提取物时细胞生长速度较快,培养10 d后添加2 g/L酵母提取物生物量达到对照组的1.7倍;脂肪酸含量比较,酵母提取物添加2 g/L 时脂肪酸含量与对照组相差不大,在培养第6天时是对照组的1.1倍。综合比较,添加2 g/L酵母对生物量及脂肪酸含量均有促进作用,尤其添加2 g/L时,脂肪酸产量是对照组的1.6倍,酵母提取物可以作为黄丝藻异养培养的优选氮源。
2.2.4 尿素。
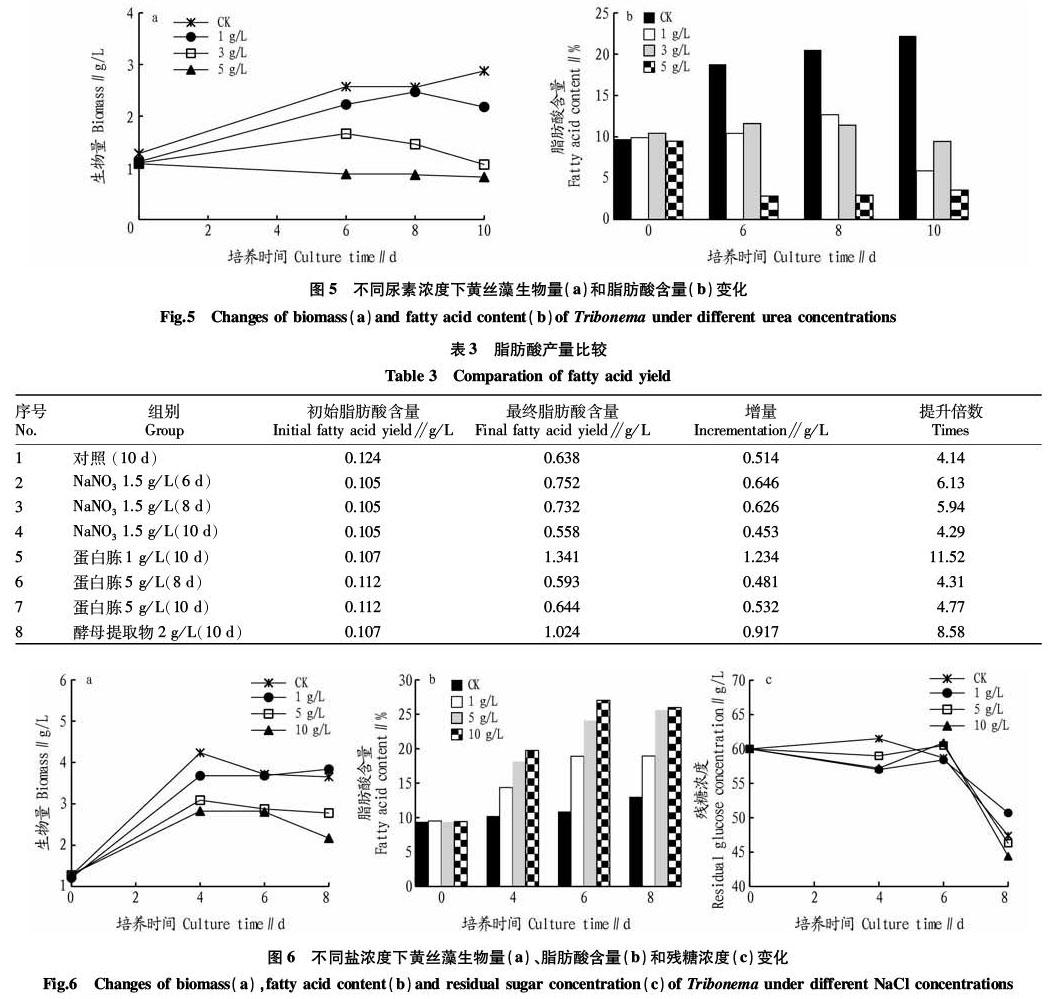
尿素是由碳、氮、氧、氢组成的有机化合物,是哺乳动物和某些鱼类体内蛋白质代谢分解的主要含氮终产物,也是目前含氮量最高的氮肥,其作为目前植物培育广泛使用的氮肥之一,具有性价比高、保存使用方便等特点。将尿素添加到微藻培养中,可用于提供氮元素同时调节培养液pH,防治原生动物及细菌污染,达到稳定养殖的目的。黄丝藻异养培养时添加尿素对比生物量和脂肪酸含量,结果如图5所示,添加尿素试验组生物量均低于对照组,添加尿素试验组脂肪酸含量均低于对照组。可见,添加尿素对ENN172生物量及脂肪酸含量没有明显促进作用。
综合上述结果,将脂肪酸产量较高的几组列表进行比较,结果发现(表3),其中,蛋白胨1 g/L时脂肪酸产量提升最大,达到初始时的11.5倍,其次为酵母提取物2 g/L,为初始时的8.6倍,可以作为优选氮源进一步优化和培养。
2.3 不同盐浓度培养对黄丝藻生物量及脂肪酸的影响
盐度可以调节细胞内外的渗透压,影响藻细胞的生理特性,对细胞生物量和脂肪酸含量产生影响。有研究显示[16],NaCl会不同程度地抑制小球藻(C.vulgaris)的生长,且浓度越高,抑制越明显。在浓度为0.1~0.4 mol/L的NaCl培养基中,藻细胞的生物量减少量不大,但是脂肪酸含量比未添加NaCl的有明显提高,当NaCl质量浓度为0.3 mol/L 时得到最高脂肪酸总产量1.04 g/L。该研究通过添加不同浓度的NaCl对比黄丝藻异养培养过程中的生物量和脂肪酸含量的差别,结果发现(图6),不同盐度培养ENN172黄丝藻,随着培养时间的延长,生物量呈先增后降的趋势,不同盐浓度组均在第4天达到最大,且随着盐浓度的提高,会对生物量的增加造成抑制。不同盐浓度对比脂肪酸含量发现,提高盐浓度可以促进脂肪酸含量增高,其中NaCl 10 g/L时在第6天达到最大(27.03%),之后出现下降但仍为最高,而对照组、NaCl 1 g/L和NaCl 5 g/L组均在第8天达到最高。培养基中剩余糖浓度结果显示(图6c),前6 d,ENN172对培养基中的糖消耗量不大,第8天时培养基中的糖均被消耗至50 g/L以下。
综上所述,盐的添加有利于细胞中脂肪酸的积累,但不利于细胞中生物量的积累。可以用于生物量积累结束的第二阶段脂肪酸诱导,达到脂肪酸提高的目的。
3 结论
黄丝藻作为一种丝状藻类,具有生长速度快、污染易控、采收成本低等培养优势,且其富含EPA、多糖等高附加值成分,是微藻多功能开发并实现产业化的优选藻株。自养培养具有占地面积大,受环境光照、温度等影响较大的特点,而异养培养可以提高单位占地面积的微藻产量,具有条件易受控、品质稳定等优势而成为目前的研究热点。黄丝藻异养培养条件优化和探索,是实现其快速生长和脂肪酸产量提升的重要手段。
该研究对比了低氮条件下不同初始葡萄糖浓度时黄丝藻ENN172的脂肪酸生产情况,葡萄糖20 g/L时生长速度和最终生物量最高,30 g/L时脂肪酸产量最高,随着葡萄糖浓度的增加,生物量大幅下降,且細胞脂肪酸含量也并未显著增加,葡萄糖浓度过高时,会对藻细胞生长造成抑制,Rai等[21]研究发现,当培养基中葡萄糖含量为5%~10%时小球藻的生长受到抑制,鞭金藻3011、三角褐指藻、绿色微囊藻在利用有机碳时也表现底物抑制作用。对比黄丝藻4种异养氮源不同浓度下的脂肪酸产量情况发现,酵母提取物和蛋白胨都可显著提高黄丝藻ENN172生物量和脂肪酸产量,推测可能与这2类物质中含有多种小分子氮源以及维生素有关,更能满足微藻细胞对营养元素的需求,可作为优选氮源进一步摸索条件提高最终脂肪酸含量。硝酸钠浓度对黄丝藻脂肪酸产量有一定的影响,但效果不显著,尿素对黄丝藻生物量呈负面影响,研究显示[22],不同藻类对氮的吸收利用途径会有所不同,进而引起培养基pH的变化,在吸收利用时会释放出OH-导致培养液的pH升高,吸收利用时会释放出H+使得培养液的pH降低,而在吸收利用CO(NH2)2时,培养液pH变化不大。该研究中培养液pH变化有可能是影响细胞生物量的主要因素。该株黄丝藻并未出现文献报道的随氮源浓度脂肪酸含量和生物量都增加的情况[20],黄丝藻藻株间有一定的差异性,或所选氮源等培养条件仍需优化。另外,提高氯化钠浓度可以促进黄丝藻ENN172脂肪酸的积累,但不利于生物量增加,对于脂肪酸诱导具有提升作用,说明盐度胁迫导致的渗透压变化对细胞吸收营养物质和胞内生化反应产生影响,不利于细胞生长繁殖,但可促使细胞积累脂肪酸。
生长速率和脂肪酸产量是决定一株藻是否能够产业化的标准,综合以上结果,黄丝藻ENN172在初步优化条件后培养6 d脂肪酸含量达到27.03%(与初始相比提高3.4倍),脂肪酸产量仍有巨大提升空间,是一株值得深入研究的潜力藻株。
参考文献
[1] RICHMOND A,HU Q.Handbook of microalgal culture[M].2nd ed.New Jersey:Wiley Blackwell,2013:208-211.
[2] WANG H,ZHANG W,CHEN L,et al.The contamination and control of biological pollutants in mass cultivation of microalgae[J].Bioresource technology,2013,128:745-750.
[3] GRAHAM L E,WILCOX L W.Algae[M].Upper Saddle River,NJ:Prentice-Hall,2000.
[4] 王全喜.中国淡水藻志[M].北京:科学出版社,2007:215-216.
[5] ZHANG L L,CHEN L,WANG J F,et al.Attached cultivation for improving the biomass productivity of Spirulina platensis[J].Bioresource technology,2015,181(1):136-142.
[6] WANG H,GAO L L,CHEN L,et al.Integration process of biodiesel production from filamentous oleaginous microalgae Tribonema minus[J].Bioresource technology,2013,142:39-44.
[7] 李晓敏,王兴玥,范文宏.水华束丝藻与铜绿微囊藻净化水体氮磷及其脂质积累过程比较[J].环境工程学报,2019,9(6):2795-2801.
[8] 徐梓钧,胡强,刘国祥,等.囊状黄丝藻在不同初始氮浓度条件下特殊的油脂积累规律[J].植物科学学报,2018,36(3):411-419.
[9] 张春艳.DHA和EPA的生理作用及开发利用研究进展[J].柳州师专学报,2005,20(3):118-121.
[10] KINSELLA J E.Seafoods and fish oils in human health and disease[M].New York:Marcel Dekker,1987:217-220.
[11] 郝颖,汪之和.EPA、DHA 的营养功能及其产品安全性分析[J].现代食品科技,2006,22(3):180-183.
[12] 徐静,谢蓉桃,林强,等.海洋生物多糖的种类及其生物活性[J].中国热带医学,2006,6(7):1277-1278.
[13] LEWIN J C.Heterotrophy in diatoms[J].J Gen Microbiol,1953,9:305-313.
[14] WANG H,ZHOU W J,SHAO H M,et al.A comparative analysis of biomass and lipid content in five Tribonema sp. strains at autotrophic,heterotrophic and mixotrophic cultivation[J].Algal research,2017,24:284-289.
[15] ZHOU W J,WANG H,CHEN L,et al.Heterotrophy of filamentous oleaginous microalgae Tribonema minus for potential production of lipid and palmitoleic acid[J].Bioresource technology,2017,239:250-257.
[16] 黄冠华,陈峰.环境因子对异养小球藻脂肪酸组分含量和脂肪總酸产量的影响[J].可再生能源,2009,27(3):65-69.
[17] 黄伟坤.食品检验与分析[M].北京:轻工业出版社,1989:19-21.
[18] 车绕琼,黄力,王琳,等.葡萄糖对单针藻异养和兼养生长及油脂合成的影响[J].中国生物工程杂志,2015,35(11):46-51.
[19] CAI T,PARK S Y,LI Y.Nutrient recovery from waste water streams by microalgae:Status and prospects[J].Renew Sust Energ Rev,2013,19(1):360-369.
[20] GUO F,WANG H,WANG J,et al.Special biochemical responses to nitrogen deprivation of filamentous oleaginous microalgae Tribonema sp.[J].Bioresource Technol,2014,158(4):19-24.
[21] RAI M P,NIGAM S,SHARMA R.Response of growth and fatty acid compositions of Chlorella pyrenoidosa under mixotrophic cultivation with acetate and glycerol for bioenergy application[J].Biomass and bioenergy,2013,58:251-257.
[22] WU J Y,WU S Y,SHU J J,et al.Effect of phosphate and nitrogen resources on lipidrich microalgae cultivation from textile waste water[C]//Environmental technology and innovations.Ho Chi Minh City,Vietnam:CRC Press,2016:65-70.

