丛枝菌根与土壤碳截获的研究进展
李艳红 李艳凤
摘要 土壤碳截获一直是研究陆地生态系统碳循环的重要领域,而丛枝菌根(Arbuscular mycorrhizal,简称AM)广泛存在于陆地生态系统中,对陆地生态系统碳循环有着重要作用。近年来,AM真菌在土壤碳截获中的应用日益受到人们的关注。综述了丛枝菌根在土壤碳截获功能中的作用机制,主要围绕AM与根系的关系、AM与光和碳截获、AM与土壤碳截获、环境因子对AM在土壤碳截获中的作用等方面进行了介绍。由于AM真菌对于调控碳循环具有不可替代的作用,因此全球气候变化下,AM真菌土壤碳截获的潜力研究、菌丝在土壤结构中的功能及菌丝网在生态系统碳固持中的作用必将成为研究热点。
关键词 丛枝菌根;碳循环;土壤碳截获;陆地生态系统
中图分类号 S 181.6;Q 89 文献标识码 A
文章编号 0517-6611(2019)12-0006-04
doi:10.3969/j.issn.0517-6611.2019.12.002
开放科学(资源服务)标识码(OSID):
Abstract Soil carbon capture has been important fields in study terrestrial ecosystem carbon cycle.Arbuscular mycorrhizal (AM) fungi widely exists in terrestrial ecosystems and plays an important role in carbon cycle.In recent years,the application of AM fungi in soil carbon capture has attracted increasing attention.This paper reviews the function mechanism of AM fungi in soil carbon capture,mainly around the relationship between AM fungi with root,photosynthesis,soil carbon capture and environmental factors.Under global climate change,the potential research about AM fungi effect on soil carbon capture,soil structure and ecosystem carbon will become research hotspot due to AM fungi has an irreplaceable role for regulating the carbon cycle.
Key words Arbuscular mycorrhizal;Carbon cycle;Soil carbon capture;Terrestrial ecosystem
在全球變化和可持续发展的大背景下,陆地生态系统碳库储量及其演变、农业和工业等领域的温室气体释放态势、减排潜力、途径等问题的研究成为国际科学界服务于全球变化控制的主流研究方向[1]。丛枝菌根(AM)是一类在陆地生态系统中广泛分布,能够与绝大多数高等植物根系形成共生体系的重要土壤微生物[2]。据统计,80%以上的陆地植物可以形成菌根共生体,其中60%左右形成的是丛枝菌根[3]。AM真菌作为植物的共生体发挥着重要生态学功能:AM真菌能够提高植物对营养元素的吸收,促进植物生长,改善植物对干旱及毒性污染的耐受性,增强植物的抗病性等。不仅如此,AM真菌还是植物与土壤之间的重要连接,在土壤碳截获中起到重要的作用:AM真菌能促进土壤团聚体的形成,改善土壤结构,增加土壤碳固持;AM真菌淀积了植物光合产物一定数量的碳,是土壤中一个不容忽视的碳库;AM真菌产生的球囊霉素相关土壤蛋白是土壤中一个重要碳库。笔者综合近几年国内国外AM与土壤碳截获的研究成果,了解AM在土壤碳截获的的作用和研究进展,旨在为真菌对全球的陆地生态系统碳循环的贡献提供相关理论依据。
1 AM真菌与根系的关系
1.1 AM真菌的来源
早在1900 年,人们就发现一种分布广泛且与农业生产关系密切相关的内生菌根真菌,名为泡囊-丛枝菌根(VesicularArbuscular mycorrhiza,VAM),它们能在植物根细胞内产生“泡囊”和“丛枝”两大典型结构,由于有一部分真菌不在根内产生泡囊,而大多数真菌都形成丛枝,故简称为丛枝菌根(Arbuscular mycorrhizal,简称AM)。植物根系被AM真菌感染形成菌根后,根系的外部形态很少或几乎没有发生变化,用肉眼一般很难看出有无丛枝菌根形成。AM真菌进入植物根系皮层细胞后,原初的菌丝在适当条件下可发育成泡囊、丛枝、根内菌丝和根内孢子等结构,经染色等技术处理后,在显微镜下才能观察到。
1.2 AM真菌在根系中的发展步骤
寄主植物根能够分泌独角金内酯,是日本科学家Akiyama等从寄主白麦根属植物根系分泌物中分离出来的。独角金内酯含有一个可以自发水解的乙醚键,因此能够在根的周围短期存在,被作为宿主植物根周围可靠的指示剂。独角金内酯是 AM真菌菌丝分支的诱导因子,能够诱使孢子萌发,菌丝大量分枝,增加真菌孢子数,提高菌丝的生理活性,还能诱使寄生植物的萌发,如独脚金种子。
AM真菌在根系中的发展步骤如图1所示[4]:真菌产生的菌根因子能够诱使钙离子在根表皮细胞活动,并且激活与植物共生相关的基因。AM真菌内成熟的菌丝能够产成特殊的附着胞,称为附着枝。植物细胞由于连续的化学和机械刺激产生侵入前体 (prepenetration apparatus,PPA)。然后附着枝延伸的菌丝进入PPA,在PPA的诱导下穿过根的表皮细胞进入到皮质。这时,真菌菌丝离开了植物细胞,进入到质外体,然后沿着根的轴进行分支和生长。这些菌丝诱使PPA类结构在内皮质细胞内生长,不断分枝形成了丛枝。
2 AM真菌与光和碳截获
植物进行光合作用的过程,简单地说就是植物在光下利用CO2和水合成光和有机物,并放出氧气的过程。在此过程中形成的光和有机物,最终以蔗糖形式在植物体内进行糖类物质的转运。AM真菌不能进行光和作用,必须向宿主植物提供矿物营养和水分作为交换,换取所需的碳水化合物。菌根菌丝将碳水化合物从植物体运载到土壤中的数量要远超过根际,并且释放出分泌物、酶、疏水糖蛋白、螯合剂、死细胞等构成菌丝际,明显区别于根际的微生物种群。这些分泌物能够激发微生物的活性,促进植物和土壤微生物的互利共生,协助植物根系获取营养,同时微生物又利用根际碳水化合物组成土壤呼吸的主要部分[5-7]。据估计,每年这一过程引起的碳循环可以达到大气CO2再循环的10%,远远大于化石燃料燃烧所释放的碳[8]。菌根真菌淀积了植物光合产物一定数量的碳,是土壤中一个不容忽视的碳库。
研究发现AM真菌从宿主植物体内获得它所需要的碳水化合物,大约消耗植物光合产物净碳的10%~20%[9],间接地影响了碳在土壤中的积累,但是很难精确定量宿主植物分配给菌根碳的数量。在营养缺乏的生境中,菌根能够提供植物所需的大部分营养(磷、氮、钾、铜、锌等)和水分,特别是磷,可以说AM真菌对植物磷的供应处于绝对支配地位,几乎能供给植物生长所需的全部磷[10]。对于大部分植物而言,氮和磷是限制植物生长的主要因子,AM真菌的存在减轻了宿主植物地上部氮和磷的限制,致使宿主叶面积增加,提高了光合速率,最终提高了宿主植物的初级生产力[11-12]。因此,菌根真菌通过直接控制植物的初级生产力,间接增加了植物体的光和碳固持。
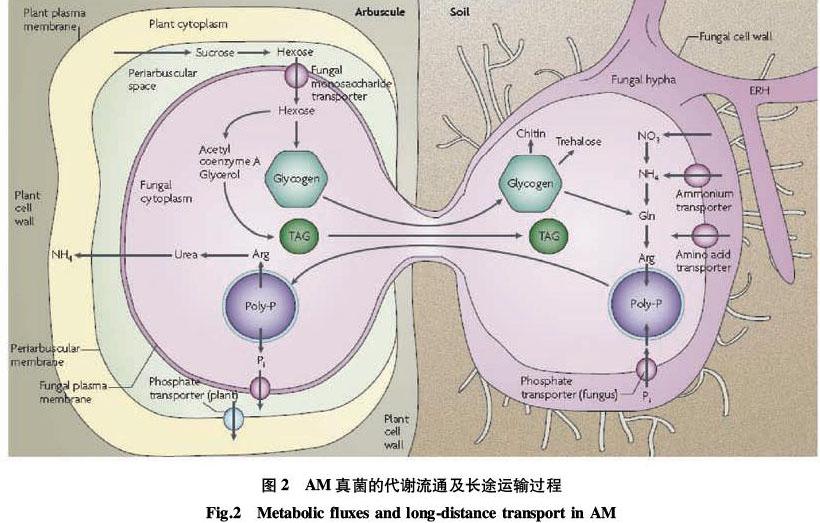
目前,有关AM真菌光合碳截获的研究已经扩展到无菌培养体系,并且具有限制和分离真菌、植物组织的能力,同时还应用同位素标记和原位核磁共振的方法来跟踪C流的方向。一般使用C14来跟踪光和化合物的产物,在数小时内从宿主植物一直跟踪到AM真菌菌丝内。植物进行光合作用产生的蔗糖被蔗糖合成酶和转化酶分解成多糖,然后再继续转化为其他物质分布到AM根部。如图2所示[4],植物光合作用产生的碳水化合物是通过共生界面的两层细胞膜运输到真菌的,首先是以蔗糖的形式释放到丛状枝周围,然后经过一系列酶反应分裂成已糖,穿过真菌离子体膜被AM真菌吸收。在真菌的细胞质内,已糖被转化为单糖颗粒和甘油三酯以供长距离的运输。从土壤中获得营养物质通过真菌质膜传递给植物细胞,首先长距离运输到根内菌丝,包括菌丝丛状物,随后到达真菌质膜和植物围丛枝膜进入植物细胞的细胞质中。
3 AM菌根与土壤碳截获
3.1 AM真菌在土壤碳截获中的作用
AM真菌的残留物对土壤碳库有着重要贡献。因为 AM真菌的菌丝细胞壁主要由几丁质组成,它是一种碳水化合物,很难分解[13-14],这种极难分解的特性致使AM真菌的残留物在土壤中长期累积,积少成多,无形中增加了土壤碳固持。
此外,菌丝具有黏结作用,这对土壤团聚体的形成和构造团聚体的粒级具有不可低估的作用[15]。菌丝通过“黏合—连接—打包”机制将土壤颗粒紧密联系在一起,增加了有机残片在土壤大团聚体中的存留时间[16],这一机制对改变生态条件恶劣的土壤尤其重要,将显著提高土壤有机碳的含量。Rillig等[17]认为,菌丝对土壤团聚体的形成包括3个过程:第一是物理作用,即AM真菌菌丝能将土壤颗粒或微团聚体束缚连接,改变土壤水分干湿交替,使土壤颗粒更加匀质化,然后排列土壤颗粒,产生粘结力,使土壤颗粒的排列从无序到有序,为土壤团聚体的形成奠定基础;第二是生化作用,菌丝体释放的分泌产物和活性菌丝产生的分泌物,将有序的土壤颗粒进一步黏结,形成土壤团聚体;第三是生物作用,菌丝在土壤颗粒中穿插、环绕、交织,改变了微生物群落,而微生物群落的变化则改变了食物网,使土壤团聚体继续发育完善。AM真菌就是通过上述物理、生化和生物3个过程,最终将小的土壤颗粒和微团聚体连接成大团聚体,而大团聚体对土壤有机碳的储存更有优势,即团聚体越大,土壤储存有机碳的含量越高[18]。Díad-Zorita等[19]指出大团聚体(>250 μm)主要是由土壤根系和菌丝胶结作用形成,而微团聚体(<250 μm)主要是通过多价阳离子桥和多糖形成,可见大团聚体比小团聚体含更多的新鲜有机物。总之,AM真菌促进了土壤团聚体的形成,改善了土壤质量,增加了土壤碳固持。
3.2 球囊霉素土壤相关蛋白
1996年,美国马里兰大学微生物系实验室的Wright等在AM真菌菌丝的表面发现的,一种能够和单克隆抗体(MAb32B11)发生免疫性荧光反应的未知蛋白,该蛋白非常稳定,不溶于水,且只有在121℃下用中性至碱性的柠檬酸钠溶液才能提取出来[20-21]。进一步的研究发现,该蛋白是由AM真菌分泌产生的一类含金属离子的糖蛋白,是迄今为止发现的唯一一种AM真菌分泌到土壤中的蛋白质,并命名为球囊霉素土壤相关蛋白(Glomalin related soil protein,GRSP)。GRSP产生于宿主植物根内的AM真菌菌丝或延伸到根际土壤中根外菌丝的表面,并能够从菌丝表面脱落进入菌丝际土壤中[22]。
GRSP在维持土壤有机碳平衡和土壤团聚体稳定有着不可忽视的作用。GRSP主要是由3部分組成:蛋白质主体、碳水化合物以及其中络合的铁及其他离子。因此,GRSP储存二氧化碳主要是其蛋白质和碳水化合物的二级单位(葡萄糖和蔗糖亚单位)。研究发现GRSP的含量是腐殖质含量的2~24倍,占到土壤有机碳源的27%左右[23]。由于GRSP难溶于水,不易被蛋白酶水解,在土壤中的性质极为稳定,因此GRSP也代表土壤中一个重要的碳库。
AM真菌通过菌丝分泌的GRSP影响土壤团聚体的结构和形成。AM真菌分泌GRSP的进入土壤后,通过自身的物理缠绕作用将土壤颗粒束缚在一起,同砂土、黏土颗粒以及有机质结合,最终形成团聚体结构。GRSP可以保护团聚体中相对不稳定的有机碳,从而减缓它们的分解速率。此外,GRSP等分泌物改变了土壤微生物环境,为土壤中有益微生物提供了生活的场所,影响了其他土壤微生物活性,刺激土壤细菌、放线菌等微生物的繁殖,进而影响土壤碳的变化。微生物的活动一方面可能加速土壤有机碳的分解,但同时也会加速腐殖化过程,使小分子量不稳定的碳素组分转变为稳定的腐殖物质,促使活性碳向稳定性的有机碳转化,起到稳定土壤碳库的作用。
3.3 AM菌根增强碳截获功能的分子机制
AM菌根与植物之间的共生关系在陆地生态系统中至关重要,尤其是由聚合菌 (glomeromycota fungi)形成的丛枝菌根。但是,关于碳水化合物是如何通过共生界面运输的机制仍然不清楚。目前已有研究发现了第一个聚合菌的单糖运输者——GpMST1(glomeromycotan monosaccharide transporter),其已被克隆出来,并被定性[24],是利用一种球囊菌(Geosiphon pyriformis)与蓝藻细菌所形成的独特共生体系完成的。GpMST1具有很低的GC含量(鸟嘌呤和胞嘧啶所占的比率),包含6种内含子。GpMST1有12个跨膜区域,其与葡萄糖、甘露糖、半乳糖、果糖有很高的亲和力,并且能作为质子与这些单糖共同运输。AM菌根吸收的单糖最后通过糖合成酶的作用转变为糖元。
研究表明,当植物体与AM真菌共生,AM真菌能引起植物根部的植物蔗糖合成酶的基因表达增加[25-27]。AM真菌从植物体摄取蔗糖后,宿主植物能提供酸转化酶将植物衍生的蔗糖分解為可被真菌吸收利用的果糖和葡萄糖[28]。目前研究发现,植物-真菌共生体中,只有植物体中含有标记菌根真菌碳代谢的分子基因,它能够引导植物酶控制菌根体内碳的分配。例如,通过植物酸转化酶和已糖转移酶基因的表达能够知道菌根体内碳分配的变化。通过这些基因的控制,使AM真菌能够更好地从宿主体内摄取碳水化合物供自身的新陈代谢,间接地影响了CO2在土壤中的积累。
4 环境因子对AM菌根碳截获的影响
环境因子对AM真菌的定殖、丰富度和多样性有重要影响。有研究显示,对农田进行轮流耕作,并减少农药和无机化肥使用的管理模式,能够更好地提高AM真菌物种的多样性[29]。多种生态环境因子如气候条件、植被类型、土壤特性、大气CO2浓度升高、土壤使用方式、耕作模式等均会影响到AM真菌的生长,进而影响GRSP的积累和组成[30-32]。在不同的土壤利用方式以及各个土层之间,GRSP的含量会出现明显的差异[33]。GRSP是土壤活性有机碳库中最重要的碳来源,在土壤中的周转时间长达6~24年,是稳定性有机碳的重要组成部分。土壤有机碳含量与GRSP含量成明显的正相关,并有极强的相关性,一方面是因为GRSP是有机碳的重要的组成成分,另一方面是他们之间相似的生物化学特性和错综复杂的交互效应。由此可知,不同的土壤利用方式能够间接的影响土壤活性有机碳库。Wilson等[22]进行了长达6~17年的研究,主要通过对草场进行燃烧和施加N肥改变土壤的环境,结果表明:对草场进行燃烧和施加N肥,能够提高土壤中菌丝的含量、球囊霉素土壤相关蛋白的含量、水稳性团聚体的量;反之则会降低它们的含量。由此可见,环境因子对AM菌根的生长有着重要作用,从而间接地影响土壤碳截获的功能。
5 结语和展望
随着全球变暖,人们对温室气体和碳循环的关注度越来越高。土壤是一个巨大的碳沉降库,通过微生物分解将植物体转变成有机质贮存起来。而丛枝菌根是一类在陆地生态系统中广泛分布,能够与绝大多数高等植物根系形成共生体系的重要土壤微生物,它对土壤碳截获的功能是不容忽视的。AM真菌通过提供给植物矿物营养和水分,来换取供自身生长所需要的碳水化合物,组成土壤呼吸的主体部分,与此同时,淀积了植物光合产物一定数量的碳。AM真菌的菌丝细胞壁主要由几丁质组成,是一种碳水化合物,很耐分解,这种极难分解的特性致使AM真菌的残留物在土壤中长期累积,积少成多,无形中增加了土壤碳固持。菌丝具有黏结作用,能够将土壤颗粒紧密联系在一起,增加了有机残片在土壤大团聚体中的存留时间,改善了土壤质量,增加了土壤碳固持。AM真菌还能够产生球囊霉素相关土壤蛋白,其也是土壤中一个重要碳库。在营养缺乏的环境中,AM真菌能够提供植物所需的大部分营养,提高了宿主植物的初级生产力,间接增加了生物体碳固持。在不同的环境因子的影响下,土壤中AM真菌的多样性和分泌物的含量都会发生显著变化。综上所述, AM真菌对于调控碳循环具有不可替代的作用,因此全球气候变化下AM真菌土壤碳截获的潜力、菌丝在土壤结构中的功能及菌丝网在生态系统碳固持中的作用必将成为研究热点。
参考文献
[1]金峰,杨浩,赵其国.土壤有机碳储量及影响因素研究进展[J].土壤,2000,32(1):11-17.
[2] SMITH S E,READ D J.Mycorrhizal symbiosis[M].London:Academic Press,1997.
[3] TRAPPE J M.Ecophysiology of VA mycorrhizal plants[M].Boca Raton:CRC Press,1987.
[4]PARNISKE M.Arbuscular mycorrhiza:The mother of plant root endosymbioses[J].Nature reviews microbiology,2008,6(10):763-775.
[5] LERAT S,LAPOINTE L,GUTJAHR S,et al.Carbon partitioning in a split-root system of arbuscular mycorrhizal plants is fungal and plant species dependent[J].New phytologist,2003,157(3):589-595.
[6] BOMBERG M,JURGENS G,SAANO A,et al.Nested PCR detection of Archaea in defined compartments of pine mycorrhizospheres developed in boreal forest humus microcosms [J].FEMS Microbiology Ecilogist,2003,43(2):163-171.
[7] LEAKE J R,JOHNSON D,DONNELLY D,et al.Networks of power and influence:The role of mycorrhizal mycelium in controlling plant communities and agroecosystem functioning [J].Canadian journal of botany,2004,82(8):1016-1045.
[8] RAICH J W,POTTER C S,BHAGAWATI D.Interannual variability in global soil respiration,1980-1994[J].Globe change biology,2002,8(8):800-812.
[9] JAKOBSEN I,SMITH S E,SMITH F A.Function and diversity of arbuscular mycorrhizae in carbon and mineral nutrition[M]//VAN DER HEIJDEN G A,SANDERS I R.Ecology study.Heidelberg:Springer,2002:75-92.
[10] SMITH S E,SMITH F A,JAKOBSEN I.Mycorrhizal fungi can dominate phosphate supply to plants irrespective of growth responses [J].Plant physiology,2003,133(1):16-20.
[11] READ D J,PEREZ-MORENO J.Mycorrhizas and nutrient cycling in ecosystems-a journey towards relevance?[J].New phytologist,2003,157(3):475-492.
[12] WRIGHT D P,READ D J,SCHOLES J D.Mycorrhizal sink strength influences whole-plant carbon balance of Trifolium repens L.[J].Plant,cell and environment,1998,21(9):881-891.
[13] ZHU Y G,MILLER R M.Carbon cycling by arbuscular mycorrhizal fungi in soilplant systems[J].Trends in plant science,2003,8(9):407-409.
[14] GLEIXNER G,POIRIER N,BOL R,et al.Molecular dynamics of organic matter in a cultivated soil[J].Organic geochemistry,2002,33(3):357-366.
[15] 石偉琦,夏运生,刘晓蕾.丛枝菌根在草原生态系统碳固持中的重要作用[J].生态环境,2008,17(2):846-850.
[16] MILLER R M,JASTROW J D.Mycorrhizal fungi influence soil structure[M]//KAPULNIK Y,DOUDS D D.Arbuscular mycorrhizas:Physiology and function.Dordrecht,The Netherlands:Kluwer Academic Publishers,2000:4-18.
[17] RILLIG M C,MUMMEY D L.Mycorrhizas and soil structure [J].The New phytologist,2006,171(1):41-53.
[18] 彭新华,张斌,赵其国.土壤有机碳库与土壤结构稳定性关系的研究进展[J].土壤学报,2004,41(4):618-623.
[19] DADZORITA M,PERFECT E,GROVE J H.Disruptive methods for assessing soil structure[J].Soil and tillage research,2002,64(1/2):3-22.
[20] WRIGHT S F,UPADHYAYA A.Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J].Soil science,1996,161:575-586.
[21] WRIGHT S F,UPADHYAYA A,BUYER J S.Comparison of N-linked oligosaccharides of glomalin from arbuscular mycorrhizal fungi and soils by capillary electrophyoresis[J].Soil biology and biochemistry,1998,30(13):1853-1857.
[22] WILSON G W T,RICE C W,RILLIG M C,et al.Soil aggregation and carbon sequestration are tightly correlated with the abundance of arbuscular mycorrhizal fungi:Results from long-term field experiments[J].Ecology letters,2009,12(5):452-461.
[23] COMIS D.Glomalin hiding place for a third of the worlds stored soil carbon[J].Agricultural research,2002,50(9):4-7.
[24] SCHSSLER A,MARTIN H,COHEN D,et al.Characterization of a carbohydrate transporter from symbiotic glomeromycotan fungi[J].Nature,2006,444(7121):933-936.
[25] BLEE K A,ANDERSON A J.Transcripts for genes encoding soluble acid invertase and sucrose synthase accumulate in root tip and cortical cells containing mycorrhizal arbuscules[J].Plant molecular biology,2002,50(2):197-211.
[26] FERROL N,BAREA J M,AZCNAGUILAR C.Mechanisms of nutrient transport across interfaces in arbuscular mycorrhizas[J].Plant and soil,2002,244(1/2):231-237.
[27] NEHLS U,GRUNZE N,WILLMANN M,et al.Sugar for my honey:Carbohydrate partitioning in ectomycorrhizal symbiosis[J].Phytochemistry,2007,68(1):82-91.
[28] SCHAARSCHMIDT D,TRCHSEL M, ACHERMANN R, et al.Importance of PCR for the diagnostics of canine babesiosis [J].SAT Schweizer Archiv für Tierheilkunde,2007,148(12):633-640.
[29] VERBRUGGEN E,RLING W F M,GAMPER H A,et al.Positive effects of organic farming on below-ground mutualists:Largescale comparison of mycorrhizal fungal communities in agricultural soils[J].New phytologist,2010,186(4):968-979.
[30] 田慧,劉晓蕾,盖京苹,等.球囊霉素及其作用研究进展[J].土壤通报,2009,40(5):1215-1219.
[31]RILLIG M C,WRIGHT S F,NICHOLS K A,et al.Unusually large contribution of arbuscular mycorrhizal fungi to soil carbon pools in tropical forest soils[J].Plant and soil,2001,233(2):167-177.
[32] RILLIG M C,RAMSEY P W,MORRIS S,et al.Glomalin an arbuscular mycorrhizal fungal soil protein,responds to land use change[J].Plant and soil,2003,253(2):293-299.
[33] 祝飞,赵庆辉,郑万刚,等.不同土地利用方式下球囊霉素土壤相关土壤蛋白与有机碳及土壤质地的关系[J].安徽农业科学,2010,38(23):12499-12502.

