低氘水对肺癌细胞Caspase-3表达的影响
焦 敏,李 敏,万凯华,杨 劲,李 岩
通常把氘体积分数低于0.015%(150 ppm)的水称为低氘水( deuterium depleted water, DDW)[1]。自然界中的生物,其氘含量并不是个定值,范围约从 120~160 ppm,自然界中的DDW主要存在于冰川中,喜马拉雅冰川水氘含量约为 130 ppm。自然界的水中氘的含量约为 150 ppm[2]。1990 年匈牙利国立研究所报道 DDW 能诱导宠物猫和狗自发性恶性肿瘤完全或部分消退[3],并注册申请其为动物临床抗肿瘤药物。俄罗斯医学科学院癌症科研所与医学生物问题研究所进行的动物实验研究[4-5]表明,长期饮用DDW可在一定程度上延长动物的寿命。Tyrysov et al[6]研究结果也得出,饮用氘含量低的水能显著减小鼠肺癌细胞移植瘤体积并延长宫颈癌移植小鼠的寿命。
细胞凋亡是一个复杂的级联式基因表达过程,而半胱天冬氨酸蛋白酶-3(cysteine protease protein,Caspase-3)蛋白是细胞凋亡过程中的核心调控蛋白[7],其表达水平的高低与细胞凋亡密切相关,该文通过实验研究DDW对肺癌细胞A549体外增殖抑制作用,观察处理后细胞的抑制率、细胞凋亡变化、检测凋亡蛋白Caspase-3的表达水平,为今后DDW保健用品的开发奠定理论基础。
1 材料与方法
1.1 材料DDW(体积分数为0.005%)购自新疆阿克特冰泉科技有限公司;胎牛血清、RPMI 1640培养基粉末购自美国Gibco公司;肺癌细胞A549购自中科院上海细胞库;CCK-8试剂盒购自北京索莱宝科技有限公司;凋亡检测试剂盒购自美国BD公司;抗体Caspase-3购自美国Cell Signaling Techonlogy;ECL显色试剂购自美国Thermo公司。
1.2 细胞培养肺癌细胞A549培养在含10%胎牛血清的RPMI 1640培养液、5%CO2、37 ℃条件下培养。DDW实验组50、75、100 ppm,对照组为正常 RPMI 1640培养液培养的细胞。
1.3 CCK-8法检测肿瘤细胞的增殖活性用CCK-8试剂盒对细胞增殖进行测定肺癌细胞接种96孔培养板中,24 h培养后,弃去原来培养基,加入由DDW配制的培养基,设3个复孔,分别培养12、24、48、72 h后,每孔分别加入10 μl CCK-8溶液继续培养3 h,在酶标仪上进行选择490 nm波长检测,测定各孔的光密度(optical denisity,OD)值。结果取3次实验平均值。计算DDW对细胞的抑制率,抑制率(%)=(1-实验组OD/对照组OD)×100%。
1.4 流式细胞术检测细胞凋亡将肺癌细胞A549接种于6孔板,每孔接种细胞1×104/ml。37 ℃、5% CO2培养24 h后加入不同浓度的DDW (实验分为对照组和实验组,实验组加入不同浓度的DDW 50、75、100 ppm配制的培养基。对照组为正常 RPMI 1640配制的培养基。继续培养72 h后,弃去培养基,用PBS清洗3次,将细胞重悬于1×结合缓冲液中使细胞浓度为1×106/ml。吸取100 μl细胞悬液于5 ml培养管中,加入5 μl PE+5 μl 7-AAD 后涡旋细胞,在室温黑暗处孵育15 min。每孔加入400 μl 1×结合缓冲液吹打收集的细胞后过200目尼龙筛,1 h内测定荧光强度。实验重复3次。
1.5 RT-PCR检测Caspase-3基因表达
1.5.1总RNA提取 将肺癌细胞接种于6孔板,每孔接种细胞1×104/ml。37 ℃、5% CO2培养24 h后加入不同浓度的DDW (实验分为对照组和实验组,实验组加入不同浓度的DDW 50、75、100 ppm配制的培养基。对照组为正常 RPMI 1640培养液培养的细胞。继续培养72 h后,弃去培养基,加PBS清洗3次。每个孔各加入1 ml TRIzol静置30 min后用枪头混匀吹打,吸至无RNase酶的EP管中,加入氯仿0.2 ml轻微震荡15 s后,静置5 min,4 ℃、12 000 r/min离心5 min后,取上清液。加入0.5 ml异丙醇,轻轻混匀后静置10 min,4 ℃、 12 000 r/min离心10 min,弃去上清液,加入1 ml 75%乙醇(应现配现用)洗涤沉淀,4 ℃、7 500 r/min离心5 min,弃上清液。室温干燥15 min后,加入20 μl无RNase酶的无菌水,立即测定RNA浓度。
1.5.2逆转录 用Thermo逆转录试剂盒将总RNA逆转录为cDNA,严格按照说明书进行操作,整个过程均在冰上进行。配制逆转录反应液,立即放入PCR仪中进行逆转录,反应结束得到总cDNA后,立即进行实时定量荧光PCR(RT-PCR)或-20 ℃保存。
1.5.3RT-PCR 严格按说明书配制RT-PCR反应液,反应体系为20 μl,操作过程均在冰上进行。用荧光定量试剂盒进行RT-PCR检测。PCR条件:95 ℃、10 min,40个循环:95 ℃、15 s,60 ℃、60 s,4 ℃ ∞。β-actin作为内参, Capsase-3上游序列:5′-TTGAGACAGACAGTGGTGTTGATGATG-3′,下游序列:5′-ATAATAACCAGGTGCTGTGGAGTATGC-3′,样品目的基因的相对表达率(relative quantitation,RQ)采用ΔΔCt方法计算,RQ=2-ΔΔCt(表示实验组目的基因的表达相对于对照组的变化倍数),ΔΔA Ct=-(Ct目的基因-Ct内参)实验组-(Ct目的基因-Ct内参)对照组。
1.6 Western blot检测Caspase-3蛋白的水平收集不同浓度DDW处理72 h后的细胞,提取细胞总蛋白,经BCA法定量蛋白,按抗体分子质量要求配置分离胶和浓缩胶,每孔10 μl蛋白样品上样,电泳电压80 V,电泳20 min后改为100 V,电泳2 h,转膜电压为100 V,电泳2 h,5%脱脂奶粉封闭2 h,TBST洗膜10 min×3 次,孵Caspase-3一抗(1 ∶1 000)4 ℃过夜,TBST洗膜10 min×3 次,辣根过氧化酶标记的二抗(1 ∶5 000)室温避光孵育2 h,ECL显色拍照,以 β-actin 为内参蛋白,目的蛋白相对含量用目的蛋白/内参的灰度值表示。
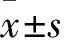
2 结果
2.1 DDW对肺癌细胞增殖活性的影响用不同浓度的DDW培养肺癌细胞A549,含50、 75、100 ppm DDW的培养基培养12 h对肺癌细胞的抑制率为10.59%、9.03%、3.97%;24 h的抑制率为13.62%、8.9%、7.8%;48 h的抑制率为15.74%、9.19%、9.31%;72 h的抑制率为19.42%、11.71%、7.05%。各实验组与对照组相比差异均有统计学意义(P<0.05,P<0.01),见表1。
2.2 DDW对肺癌细胞凋亡作用的影响不同浓度的DDW培养肺癌细胞A549后,晚期凋亡和总凋亡显著增加。含50、75、100 ppm DDW的培养基培养72 h对肺癌细胞的总凋亡率分别为( 22.8±0.95)%、(16.9±0.49)%、(11.3±0.32)%,显著高于对照组(1.1±0.2)%(P<0.05)。见图1。
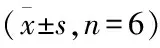
表1 不同浓度DDW对肺癌细胞A549增殖抑制的影响
与对照组比较:*P<0.05,**P<0.01
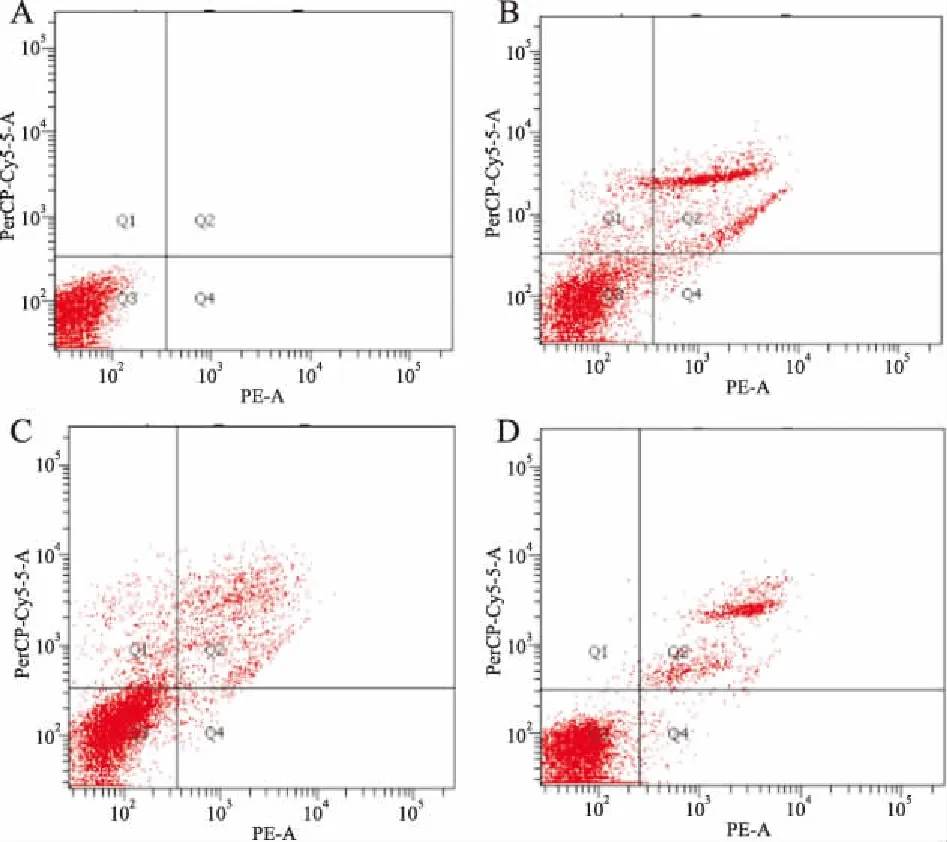
图1 流式细胞术检测DDW对肺癌细胞A549凋亡的影响
2.3 DDW对肺癌细胞中Caspase-3基因表达的影响用50、75、100 ppm DDW的培养基培养肺癌细胞(A549)72 h后 Caspase-3 mRNA的相对表达量分别为(1.256±0.067)、(1.114±0.037)、(1.058±0.022)。与正常培养基相比,Caspase-3 mRNA的相对表达量明显升高(P<0.01),见图2。
2.4 DDW对肺癌细胞中Caspase-3蛋白表达的影响用50、75、100 ppm DDW的培养基培养肺癌细胞(A549)72 h后,Western blot法检测发现DDW能够明显上调A549细胞中Caspase-3蛋白的表达。与对照组比较,差异有统计学意义(P<0.01)。见图3。
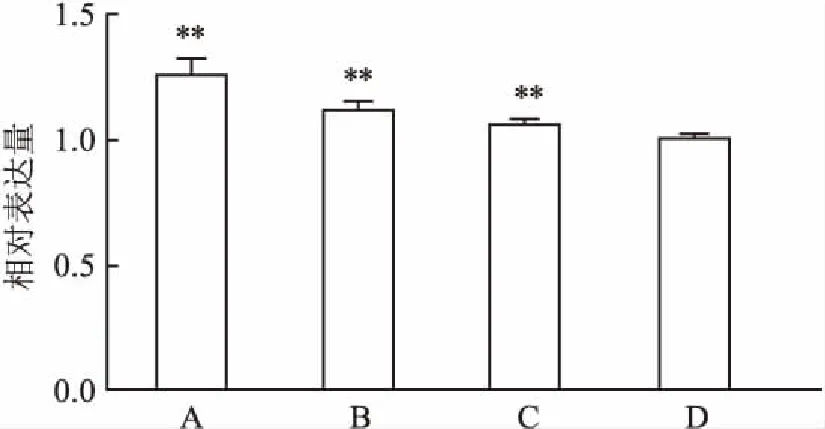
图2 DDW对Caspase-3 mRNA表达的影响
A:50 ppm;B:75 ppm;C:100 ppm;D:对照组;与对照组比较:*P<0.05,**P<0.01

图3 Western blot法检测Caspase-3蛋白表达水平
A:50 ppm; B:75 ppm; C:100 ppm; D:对照组;与对照组比较:**P<0.01
3 讨论
凋亡是细胞生命体自行结束的方式,凋亡细胞最后可被吞噬细胞或邻近细胞吞噬,不会引起炎性反应。因此,诱导肿瘤细胞凋亡对抗肿瘤有着重要的意义,细胞凋亡的发生是细胞色素C从线粒体释放,继而激活Caspase,最终导致凋亡[7]。其中Caspase-3被认为是凋亡反应的执行者,在细胞凋亡过程中起一个中心作用,它能通过降解细胞内相应位置使细胞凋亡。在分子水平上Caspase-3的表达和活性的增加将导致细胞凋亡[8-10]。本实验通过流式细胞术检测DDW主要影响早期凋亡、RT-PCR和Western blot验证Caspase-3在DDW处理后的肺癌细胞有强的表达,对照组细胞呈弱或阴性的表达。结果显示DDW能显著抑制肺癌的增殖,上调Caspase-3活性,其中50 ppm DDW作用较显著,提示DDW促凋亡作用与激活Caspase依赖的凋亡途径有关,揭示DDW辅助抗癌作用机制与凋亡蛋白Casapse-3有关。

