样品预处理方法对小麦和玉米叶子中内源激素质量分数的影响
罗梦娜,杨 雪,彭 静,刘西平
(西北农林科技大学 生命科学学院,陕西杨凌 712100)
内源激素调控着植物生长发育的各个过程以及植物对环境变化的响应,因此,对植物源激素水平的监测已成为衡量和评价植物生长发育状况的重要指标。目前,除了气态的激素——乙烯是利用气相色谱法检测外,其余植物内源激素的质量分数大多采用酶联免疫法和高效液相色谱法检测。酶联免疫法是利用免疫反应的高度专一性和敏感性以及酶促反应高效催化性相结合的原理进行植物激素检测,具有测定快速、灵敏度高、设备要求低等优点,但因抗体制备较复杂及测定成本较高等因素限制了该方法的广泛应用。高效液相色谱法是利用流动相推动待检测试样与固定相之间的作用进行不同组分的分离后进行检测,并以其较高的重复性、专一性和灵敏度成为应用较为广泛的一种检测植物内源激素质量分数的方法[1-6]。
植物体内其他内含物的存在也常常会干扰和影响测定结果,而且不同植物内含物种类和质量分数上的差异也会使干扰和影响程度不尽相同,检测结果的准确性和可靠性也会随之降低。在利用高效液相色谱法检测时,植物材料预处理方法的不同也会显著影响检测结果,这种现象在柑橘[7]、葡萄[8]、猕猴桃[9]、梨[10-11]和桃[12]等果实组织以及棉花幼苗叶片[13-14]、小麦[15-16]和玉米[17]的内源激素质量分数测定中也都得到了证实。这种现象也严重影响了已有文献中同类数据的相互比较和参考。因此,针对同一种植物材料,对高效液相色谱法的不同预处理方法进行比较和甄选,将会明显提高该分析方法的可靠性以及试验数据的可比对性。
本试验将目前的预处理方法整理归纳为4种,并分别按照4种方法对小麦和玉米叶子的新鲜样品进行处理,然后利用高效液相色谱法测定样品中的生长素(IAA)、赤霉素(GA)、细胞分裂素(CTK)、玉米素(ZT)和脱落酸(ABA)等5种植物内源激素质量分数,以比较不同预处理方法对检测结果的影响。
1 材料与方法
1.1 材料及预处理
在小麦播种45 d和玉米播种40 d后,分别采集完全展开的、位于中部的叶片,置于液氮中研磨成粉末状。称取1 g研磨后的样品,加入预冷的80%(体积分数)的甲醇20 mL,密封后于4 ℃下冷浸过夜,收集上清液。在残渣中加入10 mL 80%的冷甲醇,于4 ℃下8 000 r/min离心10 min,收集上清液;重复上次步骤1次。合并3次收集的上清液,然后分别按照下面4种方法处理后进行测定(每种处理重复4次)。
处理方法一:参照文献[4],将上清液在40 ℃下减压蒸发至2 mL溶液,过0.22 μm的微孔滤膜后,取10 μL用于高效液相色谱仪检测。
处理方法二:参照文献[18],将上清液在40 ℃下减压蒸发至原体积的1/3,加入 20 mL的石油醚脱色3次,弃醚相。将下层提取液的pH用 1 mol/L的乙酸调至6.4,加入0.5 g的聚乙烯吡咯烷酮(PVP),超声抽滤30 min。将滤液pH调至2.9,然后加入20 mL的乙酸乙酯萃取3次,合并酯相,40 ℃下减压蒸干后,用甲醇溶解并定容至 2 mL,过0.22 μm的微孔滤膜后,取10 μL用于检测。
处理方法三:参照文献[19-20],将处理方法二中的PVP替换成聚乙烯聚吡咯烷酮(PVPP),其余步骤相同。
处理方法四:参照文献[5],将收集到的上清液在40 ℃下减压蒸发和石油醚脱色后,下层溶液加入20 mL的乙酸乙酯萃取3次,40 ℃下减压蒸干,加入pH为3.5的乙酸溶液2 mL,过Sep-Pak C18小柱纯化,用甲醇洗脱,洗脱液在40 ℃下加压蒸干。用甲醇溶解并定容至 2 mL,过 0.22 μm的微孔滤膜后,取10 μL用于检测。
1.2 高效液相色谱测定条件
以甲醇为溶剂,配制质量浓度分别为10 g/L的GA、1.0 g/L的IAA、1.0 g/L的6-BA、0.1 g/L的ABA和0.1 g/L的ZT的混合标准溶液,利用美国Water公司生产的高效液相色谱仪(分析型1525+2489,1525泵,7725i进样器,T2489紫外检测器)进行测定。测定时,色谱柱为Symmery C18色谱柱(25 cm×4.6 cm,5 μm,美国Water公司),流动相A为甲醇,B为0.075%冰乙酸水溶液,梯度条件为0~7 min 35%~45% A,7~12 min 45%~50% A,12~15 min 50% A,15~25 min 50% A,流速为1 mL/min。检测器波长设置为254 nm,柱温30 ℃。
2 结果与分析
2.1 标准样品和植物样品中的5种激素的分离图谱
从标准样品的分离图谱(图1-A)可以看出,在本试验条件下,ZT、GA、IAA、6-BA和ABA的保留时间分别为5.196 min、9.166 min、13.946 min、14.881 min和18.472 min。吸收峰之间分离良好,互不干扰。
小麦和玉米叶片不同预处理方法的比较结果也表明,采用第4种方法可以得到分离效果更为清晰的、与标准品最为相近的分离图谱(图1- B和1-C),表明提取方法和色谱条件较为可靠。
2.2 激素的回归方程和相关系数
以5种激素标准溶液为原液,分别稀释2、3、4、6、8倍,在色谱仪中分析。以标样浓度为纵坐标,峰面积为横坐标,绘制标准曲线,计算出各激素的回归方程和相关系数(表1)。
2.3 不同预处理方法得到的小麦叶片中5种激素的检测结果
在相同的检测条件下,不同预处理方法得到的小麦叶片中5种不同的激素水平存在明显差异(表2),且均表现为:经过C18小柱除杂、纯化和富集后得到的GA、IAA和6-BA 3种激素质量分数最高;只用甲醇提取不进行除杂和纯化,检测出的激素仍然较高,但却低于经C18小柱处理的测定结果,其他化合物的存在对检测结果的影响较为明显(图2);用PVP和PVPP处理后,内源激素的质量分数显著降低。而对于ZT和ABA,4种提取方法得到的激素质量分数的差异性不明显。尽管只用甲醇提取不进行除杂和纯化得到的结果与经C18小柱处理的结果相近,但提取液中杂质对色谱结果(图2)的干扰明显高于后者(图1-B),因此,在小麦叶片激素测定时,利用上述经C18小柱的预处理方法最为理想。

图1 标样(A)、小麦叶片(B)和玉米叶片(C) 中5种激素的高效液相分离图谱Fig.1 High performance liquid chromatogram of five hormones in standard solution(A), wheat leaves(B) and maize leaves(C)

表1 回归方程和相关系数Table 1 Regression equation and correlation coefficient
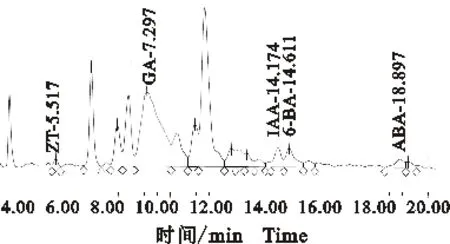
图2 高效液相色谱甲醇提取小麦 叶片中5种激素的色谱图Fig.2 High performance liquid chromatogram of five hormones extracted by methanol in wheat leaves

表2 不同预处理方法下小麦叶片中的5种激素Table 2 Five hormones in wheat leaves of different pre-treatment methods μg/g
注:M1~M4代表4种处理方法,表中数值为“平均值±标准差”,同列不同字母表示处理间在5%水平下有显著差异。下同。
Note: M1-M4 represents four pre-treatment methods. The values of number in the figure are “mean ± standard deviation”. Different letters in the same columns indicate significant difference between different treatments at 0.05 level.The same below.
2.4 不同预处理方法得到的玉米叶片中5种激素的检测结果
与小麦样品的检测结果相一致,不同预处理方法得到的玉米叶片中5种不同的激素水平也存在明显的差异(表3)。而且经C18小柱预处理得到的5种内源激素(尤其是GA和6-BA)的质量分数都高于其他3种预处理方法(表3)。只用甲醇提取不进行除杂和纯化检测得到的IAA和GA质量分数较高,但仍明显低于C18小柱处理的测定结果,其他化合物的存在对检测结果的干扰也较大(图3);用PVP和PVPP除杂的处理方法检测到的激素较少,这与小麦叶片中的结果是一致的。因而,在4种不同的预处理方法中,经C18除杂和纯化的方法最为理想。

表3 不同预处理方法下玉米叶片中的5种激素Table 3 Five hormones in maize leaves of different pre-treatment methods μg/g
2.5 主效应分析
对试验中的2种植物材料、4种处理方法和5种内源激素水平的主效应分析表明,植物材料和提取方法均显著影响不同内源激素的质量分数(P<0.05),且材料的差异大于提取方法的差异(表4)。在小麦和玉米中分别进行检验(表5),处理方法对不同种类激素水平有显著的影响(P<0.05)。以上结果表明,对不同的植物材料,需要不同的提取方法检验其内源激素,适宜的预处理方法才能更准确地检测出植物中各种内源激素的质量分数。

图3 甲醇提取玉米叶片中5种激素的色谱图Fig.3 High performance liquid chromatogram of five hormones extracted by methanol in maize leaves
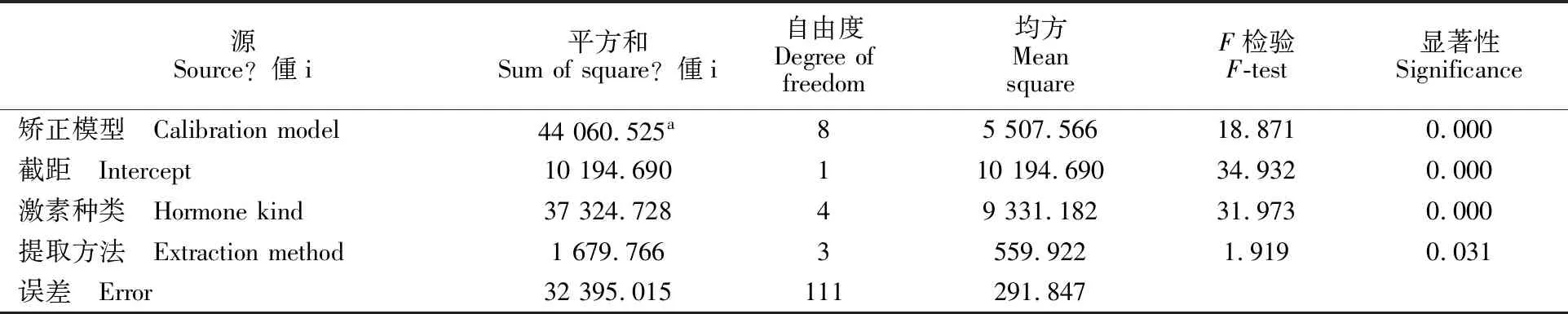
表4 主效应检验Table 4 Main effect test
注Note:a.R2=0.576(adjustmentR2=0.546).

表5 小麦和玉米中主效应分析Table 5 Main effect test in wheat and maize
3 讨论与结论
近年来,高效液相色谱法已成为应用较为广泛的一种测定植物内源激素的方法。由于植物体内其他内含物的存在,常常干扰和影响着检测结果的准确性和可靠性,这种状况对植物材料预处理方法也提出了更高的要求。
在植物激素的提取过程中,有机溶剂能从植物组织中提取出植物激素,甲醇以其分子量小、渗透性强的特点成为应用最广泛的溶剂[21]。在测定植物激素时,谢君等[1]分析出了石油醚为较合适的萃取剂,经Sep-Pak C18小柱分离能有效去除干扰物质。为了进一步提高检测的精度,试验也采用加入PVP[6,18]或PVPP[19-20]吸附去除杂质的方法,有效消除了色素、酚类物质和其他内含物的影响。前人的研究中采用的几种不同方法均成功分离测定出了不同植物组织中的激素质量分数,然而,因激素的种类不同,植物材料的差异,预处理方法的不同,无法类比出其优略性。本试验以小麦和玉米叶片为材料,对这几种常用的提取方法进行比较,以寻求更有效的适合多种激素进行同时分离和纯化的方法。从高效液相色谱的测定结果来看,不同预处理方法显著影响小麦叶子中IAA、GA和6-BA以及玉米叶子中IAA、GA、ZT、6-BA和ABA的检测质量分数,其中经提取、脱色、萃取和过C18小柱的方法,得到的各种激素质量分数最高,且在色谱检测过程中杂质对结果的干扰最小,结果准确可靠。因此,对于小麦和玉米叶片内源激素质量分数的高效液相色谱法测定而言,将样品用甲醇提取后,经石油醚脱色和乙酸乙酯萃取,再过C18小柱,是一种较为适宜的样品预处理方法,其测定结果也可能会更为准确地反映内源激素的实际质量分数。

