板栗铁型超氧化物歧化酶基因(CmFeSOD)的克隆及原核表达
韩 珊,刘裕峰,朱天辉,刘应高,谯天敏, 李姝江,汪煜伶,徐缨络,莫义英
(四川农业大学 林学院,成都 611130)

板栗(CastaneamollissimaBl),又名栗,属壳斗科栗属坚果类植物,起源于中国,历史悠久,是中国的特产植物,也是世界上重要的干果植物之一。栗疫病(Chestnut blight)的出现,使美洲板栗遭到几乎灭绝的威胁,欧洲板栗也遭受巨大的危害[14]。中国板栗是对栗疫病抗病性最好的种[15],这可能是由于其与栗疫病菌[Cryphonectriaparasitica(Murrill) Barr.]共演化的结果[16]。本试验对板栗CmFeSOD基因的克隆及原核表达进行研究,为揭示CmFeSOD基因与抗栗疫病之间的分子机制,并为利用基因工程技术培育抗病性林木提供理论依据和基因资源。
1 材料与方法
1.1 试验材料
板栗品种‘石丰’由四川农业大学林学院崇州基地提供。
1.2 总RNA的提取及cDNA的合成
取100 mg健康板栗幼叶(生长3个月),利用液氮充分研磨后,使用植物总RNA提取试剂盒(GK型,北京华越洋生物科技有限公司,中国)提取总RNA,提取的RNA通过紫外分光光度计测定质量浓度和纯度;参照公司PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit试剂盒(6210A,TaKaRa,日本)的操作说明书,合成第一链 cDNA。
1.3 CmFeSOD基因的克隆
对板栗转录组数据(http://www.fagaceae.org/)和 GenBank(https://www.ncbi.nlm.nih.gov/)中已报道的其他植物SOD 基因序列进行 Blast 序列比对,根据保守序列设计1对特异性引物CmFeSOD-F1:5′-ATGGCTTTCCGGCCTCTAT-3′和CmFeSOD-R1:5′-TCAAGGGCATTCTTTCTCA-3′。以cDNA(2 μg/μL)为模板进行PCR扩增,反应程序为:94 ℃ 预变性 3 min;94 ℃变性 30 s,55 ℃复性 30 s,72 ℃ 延伸 1 min,35 个循环;72 ℃ 终延伸 7 min,4 ℃保存扩增产物。PCR产物经 10 g/L 琼脂糖凝胶电泳检测后,切取目的片段,使用胶回收试剂盒(DP209,天根生化科技有限公司,中国)进行纯化回收,回收片段与 pMD19-T 载体(TaKaRa,日本)连接,转化到大肠杆菌DH5α感受态细胞,于Amp/X-gal/LB平板上进行蓝白斑筛选,随机挑取经PCR鉴定后的阳性克隆菌液,送上海美吉生物医药科技有限公司测序。
1.4 CmFeSOD基因序列的生物信息学分析
利用软件DNAMAN(Ver.6.0,Lynnon biosoft,美国)查找序列的开放阅读框(Open reading frame,ORF),并将其翻译为氨基酸序列,通过NCBI中的Blast(http://blast.ncbi.nlm.nih.gov/)进行核苷酸序列和氨基酸序列同源性比对。分别运用ProtParam(http://web.expasy.org/protparam/)和ProtScale(http://web.expasy.org/protscale/)对其编码蛋白的理化性质和疏水性进行分析。利用ScanProsite(http://prosite.expasy.org/scanprosite)对其编码蛋白的功能位点及功能域进行分析,通过SPOMA(https://npsa-prabi.ibcp.fr/)对蛋白的二级结构进行预测。分别使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)对其编码蛋白的跨膜区和信号肽进行预测,使用SWISS-MODEL(http://swissmodel.expasy.org/SWISS-MODEL.html)进行蛋白三级结构预测。利用MEGA(Ver.6.0,Research center for genomics and bioinformatics,日本)绘制系统进化树。
1.5 原核表达载体的构建及鉴定
根据板栗CmFeSOD基因序列设计扩增引物CmFeSOD-F2:5′-CGGGATCCATGGCTTT- CCGGCCTCTAT-3′(下划线为BamHⅠ酶切位点)和CmFeSOD-R2:5′-CCCAAGCTTTCA-AGGGCATTCTTTCTCA-3′(下划线为HindⅢ酶切位点)。以 pMD19-T-CmFeSOD质粒为模板(2 μg/μL)进行PCR扩增,反应程序同“1.3”。PCR产物经10 g/L琼脂糖凝胶电泳检测后,进行目的片段纯化回收。以 pET-28a 作为表达载体,对回收片段进行BamHⅠ和HindⅢ双酶切,分别回收酶切产物,使用T4DNA连接酶 16 ℃连接 12 h。将获得的 pET28a-CmFeSOD重组质粒转入EscherichiacoliBL21(DE3)进行卡那霉素(Kanamycin,Kan)(100 μg/mL)抗性筛选,挑取单菌落于LB液体培养基扩增培养后进行PCR鉴定,提取阳性克隆菌液质粒,经BamHⅠ和HindⅢ双酶切鉴定后,送上海美吉生物医药科技有限公司测序。
1.6 CmFeSOD蛋白的诱导表达与检测
挑取含有pET28a-CmFeSOD重组质粒的BL21(DE3)单菌落,接种于含Kan(100 μg/mL)抗生素的LB液体培养基中,恒温 37 ℃、200 r/min振荡培养 12 h。按体积比1∶100进行菌液扩增培养,当菌液光密度OD600约为0.6~0.8时,分别进行不同条件的诱导。首先进行不同浓度(终浓度为 0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L和 1.0 mmol/L)的IPTG诱导 3 h,再进行不同时间长度(1 h、2 h、3 h、 4 h、5 h和6 h)的诱导,最后进行不同温度 (25 ℃、30 ℃和 37 ℃)的诱导,收集1 mL菌液进行SDS-PAGE电泳检测,筛选最优条件,并对不同温度诱导下的目的蛋白进行可溶性分析。所有样品检测均以IPTG诱导的pET28a-BL21(DE3)和未诱导的pET28a-BL21(DE3)、pET28a-CmFeSOD-BL21(DE3)作为对照。
2 结果与分析
2.1 板栗CmFeSOD基因的克隆与序列分析
利用特异性引物CmFeSOD-F1和CmFeSOD-R1对板栗cDNA进行PCR扩增,结果发现与预期片段大小相符的单一条带(图 1),回收该片段与pMD19-T载体连接转化后,经菌落PCR检测发现相同大小的条带(图 2)。测序表明板栗CmFeSOD基因序列长度为 705 bp(图 3)。通过DNAMAN分析发现,克隆获得的cDNA序列无非编码区,为一个完成的ORF,编码 234 个氨基酸。该核苷酸序列与GenBank中已报道的SOD基因序列的Blastn比对结果表明,该片段碱基序列与白桦(KP711291.1)、烟草(X14482.1)等植物SOD基因cDNA序列的一致性为82%~90%。表明该基因属于超氧化物歧化酶基因家族成员之一,将该基因cDNA序列提交GenBank数据库,获得登录号:KY312852,命名为CmFeSOD基因。
2.2 CmFeSOD蛋白的氨基酸序列分析
采用ProtParam软件推算CmFeSOD蛋白质分子质量为26.016 5 ku,理论等电点为6.86,该蛋白由20 种氨基酸组成,其中以亮氨酸(Leu)使用最为频繁,占氨基酸总量的12.0%,以半胱氨酸(Cys)使用最少,仅占氨基酸总量的0.4%。

1.CmFeSO基因PCR产物 PCR products ofCmFeSODgene; M.DNA marker(DL2000,Takara,Japan)
图1 板栗叶组织中CmFeSOD基因的PCR扩增
Fig.1 PCR amplification ofCmFeSODgene from leaf tissue of chestnut
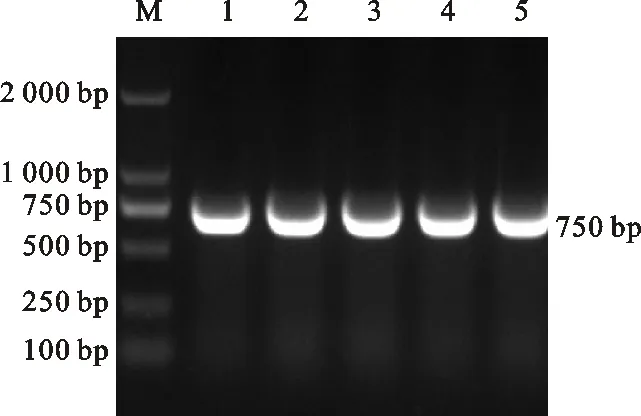
M.DNA marker(DL2000,Takara,Japan); 1~5.pMD19-T-CmFeSOD-DH5α PCR产物 PCR products of pMD19-T-CmFeSOD-DH5α
图2 重组质粒pMD19-T-CmFeSOD-DH5αPCR检测
Fig.2 Detection ofCmFeSODgene in arecombinant plasmid of pMD19-T-CmFeSOD-DH5α based on PCR amplification
CmFeSOD蛋白具有酸性氨基酸21个,碱性氨基酸20个,分别占氨基酸总量的8.97%和8.55%,推算其分子式为C1178H1813N317O342S4。预测该蛋白为稳定蛋白(不稳定系数为34.87),脂肪系数为89.62,平均亲水系数为-0.323,属亲水性蛋白。由图4可见,CmFeSOD蛋白具有Sod_Fe_C、Sod_Fe_N、PLN02471和SodA结构域,这些区域均为SOD蛋白家族特有的保守功能域。利用Prosite工具发现铁锰超氧化物歧化酶信号位点(Manganese and iron superoxide dismutase signal site)-DVWEHAYY,位于蛋白序列的第195~202氨基酸。氨基酸序列同源性及多重序列对比分析发现(图5),CmFeSOD蛋白与其他植物SOD蛋白序列一致性较高,均在80%以上。遗传进化分析表明,板栗与核桃亲缘关系较近,可能由同一个始祖进化而来(图6)。

加粗字体表示起始密码子 Blod fonts indicated start codon; *表示终止密码子 Asterisk indicated stop codon; 下划线表示铁锰超氧化物歧化酶信号位点 Capital letters underlined using single line indicated signal site of iron-manganese superoxide dismutase
图3CmFeSOD基因的cDNA序列及其所推导的氨基酸序列
Fig.3 cDNA sequence and deduced amino acid sequence ofCmFeSODgene
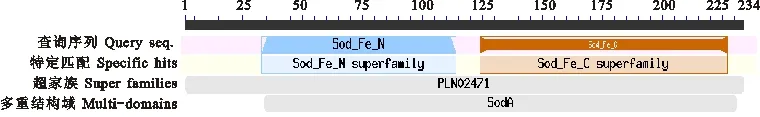
图4 CmFeSOD蛋白保守结构域Fig.4 Conserved domains of CmFeSOD protein
2.3 CmFeSOD蛋白结构预测分析
是否具有蛋白质跨膜区域对于了解蛋白的结构、功能、方位以及在细胞中的作用部位有重要意义,CmFeSOD蛋白的跨膜区域分析显示,该蛋白不存在跨膜区域,推测其存在于细胞质中。信号肽的分析有助于认识和了解该蛋白是否参与跨膜转移,CmFeSOD蛋白信号肽预测结果表明,该蛋白不存在信号肽,属于非分泌型蛋白。蛋白质多肽链本身的折叠和盘绕构成蛋白质的二级结构,主要有α-螺旋、β-转角、无规则卷曲和延伸链,这些部分是蛋白质分子实现其功能和构象的主要区域,CmFeSOD蛋白的二级结构由35.90%的α-螺旋,31.20%的无规则卷曲,20.09%的延伸链和12.81%的β-转角组成(图7-a)。利用HhblitsS工具发现CmFeSOD蛋白三级结构同源模板为拟南芥AtSOD蛋白(4c7u.1),其与CmFeSOD蛋白序列相似性达86%,覆盖率为85%,利用WISS-MODEL在线软件构建CmFeSOD蛋白三级结构(图7-b)。
2.4 pET28a-CmFeSOD重组载体的构建
使用带酶切位点的引物CmFeSOD-F2和CmFeSOD-R2,以pMD19-T-CmFeSOD质粒为模板,扩增CmFeSOD基因片段,琼脂糖凝胶电泳检测到预期大小的片段并纯化回收,将目的片段与pET-28a载体分别进行BamHⅠ/HindⅢ双酶切,分别回收酶切后的目的片段与载体,使用T4DNA连接酶连接并进行转化,挑取单菌落进行PCR鉴定(图8、图9)。
2.5 CmFeSOD蛋白原核表达的SDS-PAGE 分析
在37 ℃下进行不同IPTG浓度(终浓度为0.2、0.4、0.6、0.8和1.0 mmol/L)诱导表达pET28a-CmFeSOD-BL21(DE3) 3 h,以未诱导的pET28a-CmFeSOD-BL21(DE3)、pET28a-BL21(DE3)以及加入至终浓度为0.6 mmol/L IPTG诱导3 h后的pET28a-BL21(DE3)空载体作为对照。经蛋白电泳发现,pET28a-CmFeSOD-BL21(DE3)在不同浓度下均能诱导出大量的目的蛋白(图10),目的蛋白大小约为29 ku。预测CmFeSOD蛋白分子质量为26.016 5 ku,外加3 ku pET28a 6*his标签序列,约为29 ku,与表达的目的蛋白大小相符。同时,随着IPTG浓度增加,目的蛋白的表达量在缓慢增长,当IPTG终浓度达到0.4 mmol/L后,表达量达到最大。因此,以终浓度为0.4 mmol/L IPTG诱导最佳。

黑底白字表示完全一致的氨基酸序列 White lefferings with black background indicated a complete identical amino acid sequences; 白底黑字表示高度保守的氨基酸序列 Black lefferings with white background represented highly conserved amino acid sequences; 白底灰字表示非保守的氨基酸序列 Gray fonts highlighted with white background represented non-conservative amino acid sequences; α-螺旋显示为大波浪曲线 α-helix was displayed as large squiggles; η-螺旋显示为小波浪曲线 η-helix was displayed as small squiggles; 严格的β-转角呈现为TT字母 Strict β-turn was shown as TT letters; β-链呈现为箭头 β-strand was rendered as black solid arrows
图5 CmFeSOD蛋白与其他植物SOD蛋白的多重序列对比
Fig.5 Multiple sequence alignment of deduced protein of CmFeSOD with SOD proteins of other plants

图6 Neighbor-joining(NJ)方法构建CmFeSOD蛋白与其他植物SOD蛋白的系统进化树Fig.6 Phylogenetic tree between CmFeSOD protein and SOD proteins of other plants based on Neighbor-Joining (NJ) method

a.CmFeSOD蛋白的二级结构 Secondary stucture of CmFeSOD protein; 蓝色表示α-螺旋 Blue color indicated alpha helix; 紫色表示无规则卷曲 The purple color indicated random coil; 红色表示延伸链 Red color indicated extended strand; 绿色表示β-转角 Green color indicated beta turn;b.CmFeSOD蛋白的三级结构 Tertiary structure of CmFeSOD protein
图7 CmFeSOD蛋白的二级结构和三级结构预测
Fig.7 Predicted secondary and tertiary structures of CmFeSOD protein
在37 ℃、0.4 mmol/L IPTG条件下,进行不同时间长度(0、1、2、3、4、5、6 h)的诱导。由图11可见,随着诱导时间的增加,目的蛋白的表达量呈上升趋势,诱导时间达到3 h以后趋于平稳,达到饱和状态。因此,pET28a-CmFeSOD-BL21(DE3)在37 ℃、0.4 mmol/L IPTG条件下的最佳诱导时间为3 h。
为确定融合蛋白诱导表达的最适温度,并评估在不同温度条件下诱导的融合蛋白可溶性。pET28a-CmFeSOD-BL21(DE3)以终浓度为0.4 mmol/L IPTG分别在25 ℃、30 ℃和37 ℃下诱导3 h。SDS-PAGE电泳检测发现,在不同温度条件下,除对照外均能诱导出目的蛋白。pET28a-CmFeSOD-BL21(DE3)在不同温度条件下所表达的目的蛋白均以包涵体形式存在,在 30 ℃诱导条件下获得的包涵体最丰富(图12)。因此,30 ℃为最优诱导表达温度。

M.DNA marker(DL2000,Takara,Japan); 1~4.pET28a-CmFeSOD-DH5α PCR产物 PCR products of pET28a-CmFeSOD-DH5α
图8 重组质粒pET28a-CmFeSOD-DH5α的PCR检测
Fig.8 Detection of pET28a-CmFeSOD-DH5αbased on PCR amplification

M.DNA marker(DL2000,Takara,Japan); 1.pET28a-CmFeSOD双酶切产物 Product of pET28a-CmFeSODdigested by double endonucleases,BamHⅠ/HindⅢ; 2.未酶切pET28a-CmFeSODUndigested pET28a-CmFeSOD
图9 pET28a-CmFeSOD双酶切鉴定
Fig.9 Identification of pET28a-CmFeSODdigestedby double endonucleases,BamHⅠ/HindⅢ

M.标准蛋白质分子质量 Protein molecular mass marker; 1.pET28a-BL21(DE3)未诱导 pET28a-BL21 (DE3) without IPTG; 2.pET28a-BL21(DE3)诱导 (IPTG终浓度为0.6 mmol/L) Induction of pET28a-BL21 (DE3) with 0.6 mmol/L IPTG; 3~8.终浓度为0、0.2、0.4、0.6、0.8、1.0 mmol/L IPTG诱导pET28a-CmFeSOD-BL21(DE3) Induction of pET28a-CmFeSOD-BL21(DE3) with 0,0.2 mmol/L ,0.4 mmol/L ,0.6 mmol/L ,0.8 mmol/L ,1.0 mmol/L IPTG,respectively.
图10 融合蛋白pET28a-CmFeSOD-BL21(DE3)诱导浓度优化
Fig.10 Optimal concentration of fusion proteinpET28a-CmFeSOD-BL21(DE3) induced bydifferent concentrations of IPTG
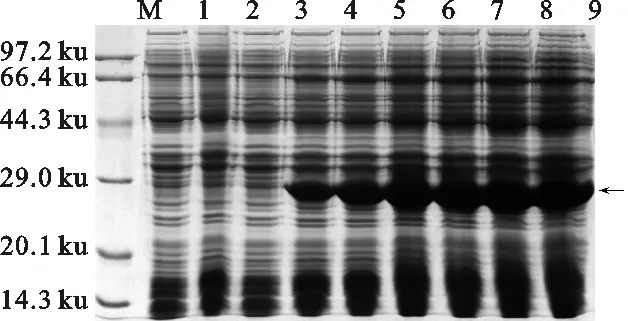
M.标准蛋白质分子质量 Protein molecular mass marker; 1.pET28a-BL21(DE3)未诱导 pET28a-BL21 (DE3) without IPTG; 2.pET28a-BL21(DE3)诱导 (IPTG终浓度为0.4 mmol/L) 3 h pET28a-BL21 (DE3) was induced by IPTG of a concentration of 0.4 mmol/L for 3 h ; 3~9.pET28a-CmFeSOD-BL21(DE3)诱导0 h、1 h、2 h、3 h、4 h、5 h、6 h pET28a-CmFeSOD-BL21(DE3) was induced for 0 h,1 h,2 h,3 h,4 h,5 h,6 h,respectively.
图11 融合蛋白pET28a-CmFeSOD-BL21(DE3)诱导时间优化
Fig.11 Optimal time of fusion protein pET28a-CmFeSOD-BL21(DE3) inducedin different length of time
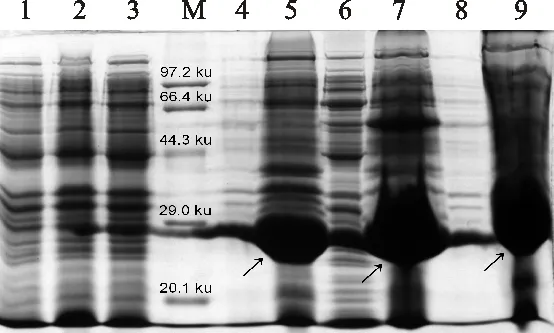
M.标准蛋白质分子质量 Protein molecular mass marker; 1.pET28a-BL21(DE3)未诱导 Induction of pET28a-BL21(DE3) without IPTG; 2.pET28a-BL21(DE3)诱导 (IPTG终浓度为0.4 mmol/L) 3 h pET28a-BL21 (DE3) was induced by IPTG of a concentration of 0.4 mmol/L for 3 h; 3.pET28a-CmFeSOD-BL21(DE3)未诱导 pET28a-CmFeSOD-BL21(DE3) without IPTG; 4.pET28a-CmFeSOD-BL21(DE3)25 ℃诱导上清 Supernatant of pET28a-CmFeSOD-BL21(DE3) was induced at 25 ℃; 5.pET28a-CmFeSOD-BL21(DE3)25 ℃诱导沉淀 Sediment of pET28a-CmFeSOD-BL21(DE3) was induced at 25 ℃; 6.pET28a-CmFeSOD-BL21(DE3)30 ℃诱导上清 Supernatant of pET28a-CmFeSOD-BL21(DE3) was induced at 30 ℃; 7.pET28a-CmFeSOD-BL21(DE3)30 ℃诱导沉淀 Sediment of pET28a-CmFeSOD-BL21(DE3) was induced at 30 ℃; 8.pET28a-CmFeSOD-BL21(DE3)37 ℃诱导上清 Supernatant of pET28a-CmFeSOD-BL21(DE3) was induced at 37 ℃; 9.pET28a-CmFeSOD-BL21(DE3)37 ℃诱导沉淀 Sediment of pET28a-CmFeSOD-BL21(DE3) was induced at 37 ℃
图12 融合蛋白pET28a-CmFeSOD-BL21(DE3)诱导温度优化及可溶性检测
Fig.12 Optimal temperature of fusion proteinpET28a-CmFeSOD-BL21(DE3) induced atcondition of differed temperatures andsolubility detection of protein
3 讨 论
植物遭受病原菌侵染后会诱发活性氧的迸发,被认为是植物抵抗病原菌侵染的特征反应[17],SOD作为植物体内的活性氧清除剂,能催化超氧阴离子自由基的歧化反应,解除其毒害作用,保护植物细胞膜的结构与功能[18],从而使得SOD与植物的抗病性紧密联系在一起。
本研究结果发现,从板栗中克隆CmFeSOD基因的核苷酸序列及其所编码的氨基酸序列与其他植物同源物均具有很高的同源性。生物信息学分析发现,板栗SOD蛋白具有Sod_Fe_C、Sod_Fe_N结构域和铁锰超氧化物歧化酶信号位点,表明板栗SOD属于FeSOD类型。已有报道表明银杏[19]、菘蓝[20]和小麦[21]等多种植物也具有同一类型的FeSOD。CmFeSOD蛋白三级结构以拟南芥AtSOD蛋白(pdb,4c7u.1)[22]为模板构建获得,表明CmFeSOD可能与AtSOD具有相似的功能。进化树分析显示,板栗与乔木树种中的核桃亲缘关系最近,与草本植物中的葡萄亲缘关系最近,与单子叶植物中的小果野芭蕉亲缘关系最近。
本研究在3 种温度(25 ℃、30 ℃和37 ℃)条件下诱导获得的目的蛋白均以包涵体形式存在,该结果与小麦FeSOD基因[21]的重组表达情况相同,但其使用的原核表达载体为pET-DuetI;韦泽秀等[23]使用相同的pET28a载体表达青稞(HordeumvulgareL.var.nudumHK.f.)CML19基因获得的重组蛋白也主要以包涵体形式存在。而高健等[24]使用pQE-30原核表达载体表达特异种质烟草(HZHN)FeSOD基因能获得活性为402 U/g的可溶性蛋白;汪滢等[25]进行发菜SOD基因的原核表达也能获得较多的可溶性目的蛋白,其使用的是pET32a载体。可见,不同的原核表达载体,对目的蛋白可溶性的表达具有一定程度的影响。
4 结 论
本研究首次从板栗中获得1个长度为705 bpCmFeSOD基因的cDNA序列,其编码蛋白具有FeSOD超家族特有的序列特征和保守结构区域,在进化上十分保守。通过原核表达在30 ℃,添加0.4 mmol/L IPTG,诱导3 h获得的CmFeSOD蛋白表达量最高,分子质量约为29 ku,其主要以包涵体的形式存在。

