Ⅰ群禽腺病毒血清4型TaqMan探针实时荧光定量PCR检测方法的建立及应用
张云丹,杨 源,王 军,文 明, 周碧君,岳 筠,李 涛,程振涛
(1.贵州大学 动物科学学院,贵阳 550025;2.贵州省动物疫病与兽医公共卫生重点实验室, 贵阳 550025;3.贵州省动物疫病预防控制中心,贵阳 550008)
Ⅰ群禽腺病毒血清4型(Fowl adenovirus serotype 4 , FAdV-4)是鸡心包积液-肝炎综合症(Hydropericardiumsyndrome-inclusion body hepatitis, HHS)的病原[1]。1987年在巴基斯坦卡拉奇的安卡拉地区首先被发现,故也称为安卡拉病(Angara disease)[2],随后在美洲的墨西哥、秘鲁、智利,亚洲的印度、韩国、日本等地都发现该病。自2015年6月起,中国很多城市都有HHS相关病例的报道,病鸡临床症状主要表现为心包积液、肝脏肿大发炎。病毒主要感染3~6周龄的肉鸡,也有蛋鸡感染的报道[1-4]。该病发病急,扩散能力强,可水平传播和垂直传播,病程 8~ 15 d,死亡率 30%~80% 不等[4]。目前,FAdV-4在鸡上的感染机制尚不清楚。研究报道,禽腺病毒病的种类多、血清型复杂,FAdV-4感染容易与其他血清型感染相混淆,且FAdV-4与传染性贫血病毒(CIAV)和传染性法氏囊病病毒(IBDV)有协同作用[4-5],给该病的诊断和防控增加了难度[3]。因此,建立一种快速、特异、敏感的方法尤为重要。
目前对FAdV-4检测的方法仍较为传统,主要局限于病毒的分离培养、血清学检测、中和试验等,这些方法存在特异性不高,易出现假阳性等缺点[4]。TaqMan探针实时荧光定量PCR因其敏感性好和特异性高等优点被广泛用于病原核酸检测,而且TaqMan探针实时荧光定量PCR方法比普通PCR和染料法荧光定量PCR更特异、敏感。针对FAdV-4临床流行趋势日益严重现状,本研究针对FAdV-4Hexon基因保守区域设计特异性引物和探针,建立快速检测FAdV-4的TaqMan 探针实时荧光定量PCR方法,旨在为FAdV-4的检测、HHS 的诊断和流行病学调查提供有效技术手段。
1 材料与方法
1.1 毒 株
新城疫病毒(Newcastle disease virus,NDV)、鸡痘病毒、传染性支气管炎病毒(Infectious bronchitis virus,IBV)和鸡传染性法氏囊病病毒(Infectious bursal disease virus,IBD)购自扬州威克生物科技有限公司;减蛋综合征病毒(Egg drop syndrome virus,EDSV)和H9亚型禽流感病毒(H9 subtype avian influenza virus, AIV)由贵州福斯特生物科技有限公司提供;以上毒株均为疫苗毒株。质粒pMD18-T/FAdV-4Hexon的阳性重组菌由贵州省动物疫病与兽医公共卫生重点实验室提供。
1.2 试 剂
PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)、Premix ExTaqTM(Probe qPCR)购自宝生物工程(大连)有限公司;其他试剂均为国产分析纯。
1.3 方 法
1.3.1 引物、探针的设计与合成 根据GenBank登录的FAdV-4(GenBank登录号:GU188428.1)Hexon基因序列,与禽腺病毒其他血清型序列比对后,根据引物和探针的设计原则,应用软件Primer 5.0设计扩增片段长度为77 bp的特异性引物,FAdV-4-F:5′-TTCGACATCAAGGGAATCCATGA-3′ ,FAdV-4-R:5′-GG- AGCCAGCGGGTTGTAA-3′和1条TaqMan探针FAdV-4-T :5′-CCGTCCTTCAAGCCCTA- CTGCGG-3′ ,探针5′端标记荧光报告基团FAM, 3′端标记非荧光淬灭基团和BHQ,上述引物和探针由生工生物工程(上海)有限公司合成。
1.3.2 标准质粒制备 将含阳性重组质粒pMD18-T/FAdV-4Hexon的阳性重组菌接种于含Amp(终质量浓度5 mg/mL)的LB液体培养基中,37 ℃振摇培养过夜。按质粒提取试剂盒说明书提取质粒,测定阳性质粒质量浓度,样品-20 ℃保存,备用。
1.3.3 反应体系的建立与反应条件优化 以提取的质粒DNA为模板,建立20 μL TaqMan探针实时荧光定量PCR体系,分别对退火温度、探针和引物浓度进行优化,方案如下:根据引物和探针设计退火温度梯度为:55 、57、59和61 ℃。引物浓度为7.5、10和12.5 pmol/L。探针浓度为8、10和12 pmol/L。20 μL反应体系:Premix ExTaq(Probe qPCR) (2×) 10 μL,DNA模板2 μL, 引物和探针按照设计方案配比加入,ddH2O补足至20 μL。反应条件:95 ℃预变性30 s;95 ℃变性10 s,退火20 s,40个循环。根据CT值筛选最优反应条件。
1.3.4 标准曲线的建立 重组质粒原液拷贝数为2.03×1010copies/μL,按10倍梯度稀释,取2.03×108~2.03×104copies/μL浓度梯度质粒作为模板,按照上述PCR反应体系和扩增程序进行TaqMan实时荧光定量PCR扩增。 以质粒拷贝数的对数值lg(x)为x轴,以CT值为y轴,建立标准曲线。
1.4 TaqMan探针实时荧光定量PCR检测方法性能评价
1.4.1 敏感性检测 以2.03×108~2.03×100copies/μL浓度梯度质粒作为模板,检测TaqMan探针实时荧光定量PCR方法的敏感性。根据CT值与模板浓度线性相关关系判定结果,当模板浓度低于荧光定量的检出下限时判定为阴性样本。此时CT值大于35[5-6]。
采用本研究设计的引物(表1)和建立的反应条件对系列浓度梯度进行常规PCR扩增,以呈阳性反应的最高稀释度作为检测灵敏度。PCR反应体系:模板2 μL,PCR Mix 12.5 μL,引物FAdV-4-F/R各1 μL,ddH2O补足25 μL。PCR反应程序:94 ℃ 5 min;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。取8 μL PCR产物于12 g/L琼脂糖凝胶电泳检测。

表1 引物信息Table 1 Information of primers
1.4.2 重复性分析 组间重复:以5份不同稀释梯度的质粒标准品(2.03×108~2.03×104copies/μL)为模板,用所建立的方法进行3次重复检测。组内重复:取同一稀释梯度的质粒标准品为模板,在上述建立好的反应体系和反应条件下,进行实时荧光定量PCR反应,每个稀释梯度做3个重复。根据变异系数(CV)=标准差(SD)/平均数(X)分别计算变异系数,分析组间和组内的稳定性。
1.4.3 特异性检测 分别提取鸡痘病毒和减蛋综合征病毒DNA为模板,同时参照病毒基因组RNA提取方法提取新城疫病毒、传染性支气管炎病毒、鸡传染性法氏囊病病毒和H9亚型禽流感病毒的RNA并反转录为cDNA。以标准质粒pMD18-T/FAdV-4Hexon为阳性对照,去离子水为阴性对照,进行TaqMan探针实时荧光定量PCR扩增,检测方法的特异性。
1.4.4 临床应用性评价 为评估所建立方法的临床应用性,对采自贵州省3个地区的10份疑似病料按上述建立的反应体系和反应程序进行检测,并与普通PCR方法和病毒分离培养结果进行比较,评估建立方法的临床可应用性。
2 结果与分析
2.1 实时荧光定量PCR反应体系建立
由图1可知,基于设计的引物和TaqMan探针所建立的实时荧光定量PCR反应体系,能有效扩增目的基因并形成规则的扩增曲线。
2.2 反应条件优化
对初步建立的 TaqMan探针实时荧光定量PCR检测的退火温度、引物和探针浓度进行优化,最佳退火温度为59 ℃(图2和表2),最优引物浓度为10 pmol/L,探针浓度为8 pmol/L(表3和图3)。

图1 TaqMan探针实时荧光定量PCR扩增曲线Fig.1 Fluorescence amplification curves of real time fluorescent quantitative PCR reaction

图2 不同退火温度扩增曲线Fig.2 Fluorescence amplification curves of different annealing temperatures

表2 退火温度优化Table 2 Optimization of annealing temperature
2.3 标准曲线的建立
以2.03×108~2.03×104copies/μL浓度梯度的标准质粒pMD18-T/FAdV-4Hexon为模板进行PCR扩增,得到不同浓度标准质粒扩增曲线(图4-A)、CT值与拷贝数对数所构建的标准曲线(图4-B)。结果显示,标准质粒浓度与CT值呈线性关系,相关系数R2为1.000,回归曲线斜率为-3.36,截距为46.28,扩增效率为98.44% 。 标准曲线的线性回归方程为y=-3.36× logx+46.28,其中y为CT值,x为标准质粒的拷贝数。

表3 引物浓度和探针浓度优化Table 3 Calibrated concentration of primer and probe
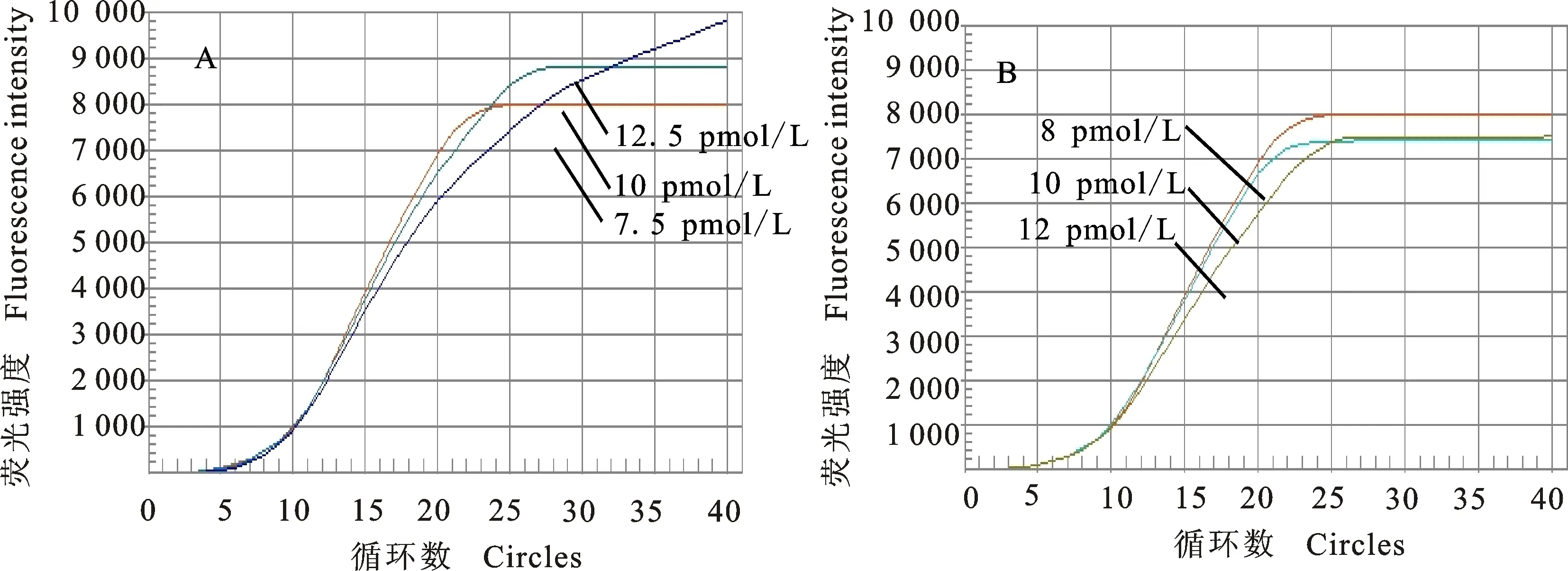
A.不同引物浓度扩增曲线 Fluorescence amplification curves of different prime concentrations;B.不同探针浓度扩增曲线 Fluorescence amplification curves of different probe concentrations
图3 不同引物和探针浓度扩增曲线
Fig.3 Fluorescence amplification curves of different primer and probe concentrations

图4 FAdV-4 TaqMan探针实时荧光定量PCR动力学曲线学曲线(A)和标准曲线(B)Fig.4 Dynamic curve(A) and standard curve(B) of FAdV-4 using TaqMan real-time fluorescence quantitative PCR assay
2.4 FAdV-4 TaqMan探针实时荧光定量检测方法性能评价
2.4.1 特异性检测 普通PCR结果显示,仅阳性对照样本出现约77 bp的扩增条带,其他6种供试毒株均未出现扩增条带(图5),说明所设计的引物特异性良好。TaqMan探针实时荧光定量PCR结果显示,仅 pMD18-T/FAdV-4Hexon阳性样本有明显的荧光扩增信号(CT值为13.63),检测结果为阳性;其他供试毒株基因组DNA有微弱的扩增信号(CT值均大于 35),检测结果为阴性,说明引物(FAdV-4-F/R)有良好的特异性(图6)。

M.DNA分子质量标准 DL50 DNA marker; 1.FAdV-4;2~7.NDV,APV,IBV,IBDV,EDVS,AIVH9
图5 Ⅰ群禽腺病毒血清4型普通PCR特异性检测
Fig.5 Specific detection ofFAdV-4 using traditional PCR assay

1.FAdV-4 2~7.NDV,APV,IBV,IBDV,EDVS,AIVH9;8.阴性对照 Negative control
2.4.2 敏感性检测 以10倍梯度稀释的标准质粒pMD18-T/FAdV-4Hexon(2.03×108~2.03×100copies/μL)为模板进行PCR扩增,检测方法的敏感性。结果显示,当阳性质粒模板拷贝数为2.03×100copies/μL时仍能出现扩增曲线,CT=33.6,重复检测结果一致。说明最低检出浓度为2.03×100copies/μL(图7)。
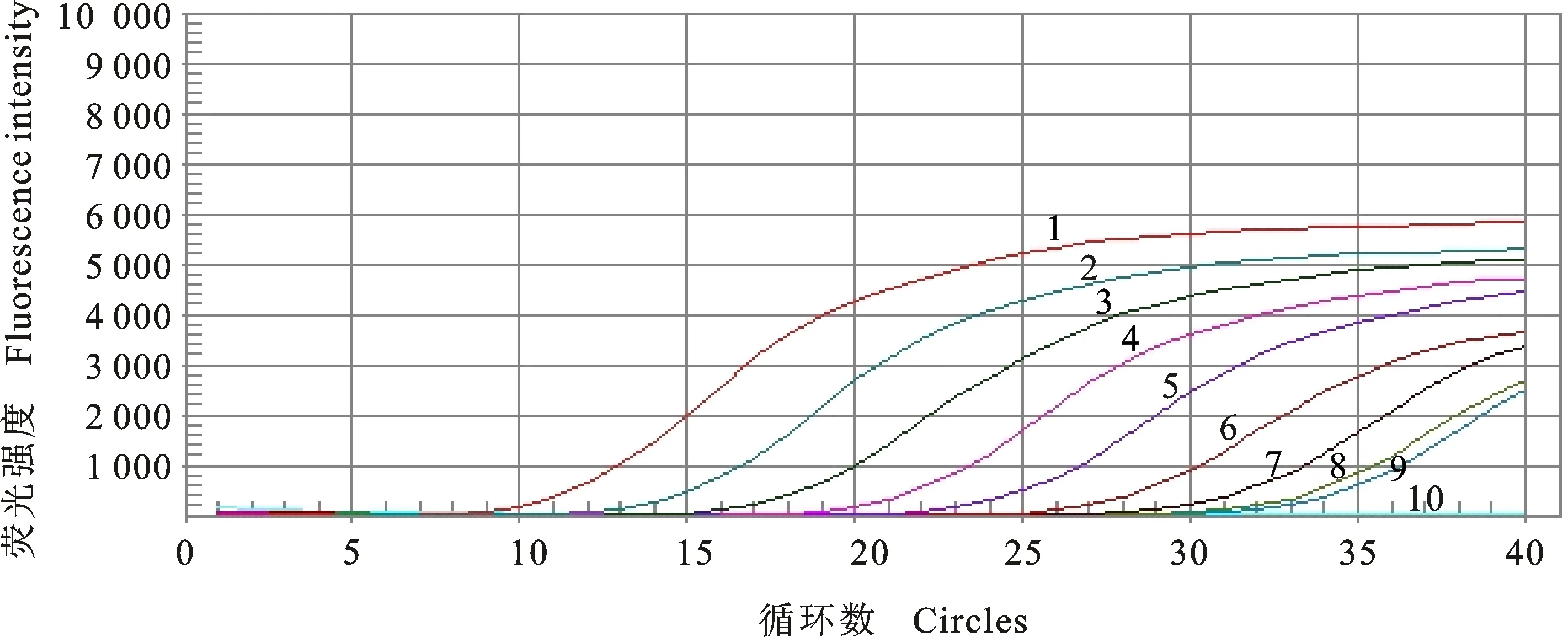
1~9.10倍稀释的标准质粒(2.03×108~2.03×100copies/μL) Refer to 2.03×108-2.03×100copies/μL from ten-fold dilutions of standard plasmid;10.阴性对照 Negative control
图7 FAdV-4 TaqMan探针实时荧光定量PCR敏感性检测结果
Fig.7 Sensitive detection of FAdV-4 using TaqMan real-time fluorescence quantitative PCR assay
应用FAdV-4-F 和FAdV-4-R 引物经常规PCR检测,质粒浓度小于2.03× 105copies/μL以后无扩增条带(图8 ),表明常规PCR方法的灵敏度为2.03× 105copies/μL。
2.4.3 重复性检测分析 以不同稀释梯度的质粒标准品(2.03×108~2.03×100copies/μL)进行重复检测,结果显示,组内CT值的变异系数为0.06%~0.78%,组间CT值的变异系数为0.02%~0.86%,均小于1% (表4)。
2.4.4 临床样本的检测 应用建立的FAdV-4 TaqMan探针实时荧光定量PCR方法对临床样本进行检测,结果显示,除阳性对照外,有8份临床样本为阳性,阳性检出率为80%(8/10)(图9),

M.DNA分子质量标准 DL50 DNA marker;1~9.10倍稀释的标准质粒2.03×108~2.03×100copies/μL Refer to 2.03×108-2.03×100copies/μL from ten-feod dilutions of standard plasmid
图8 群禽腺病毒血清4型普通PCR灵敏性检测结果
Fig.8 Sensitive detection of FAdV-4using traditional PCR assay
而普通PCR方法检测阳性率为30%(3/10)(图10),其中样本1、2、5、6、7在普通PCR中未出现扩增条带。说明,建立的TaqMan实时荧光定量PCR方法更加灵敏、高效,可更好地应用于FAdV-4 的检测,为其防控提供更准确的检测方法。
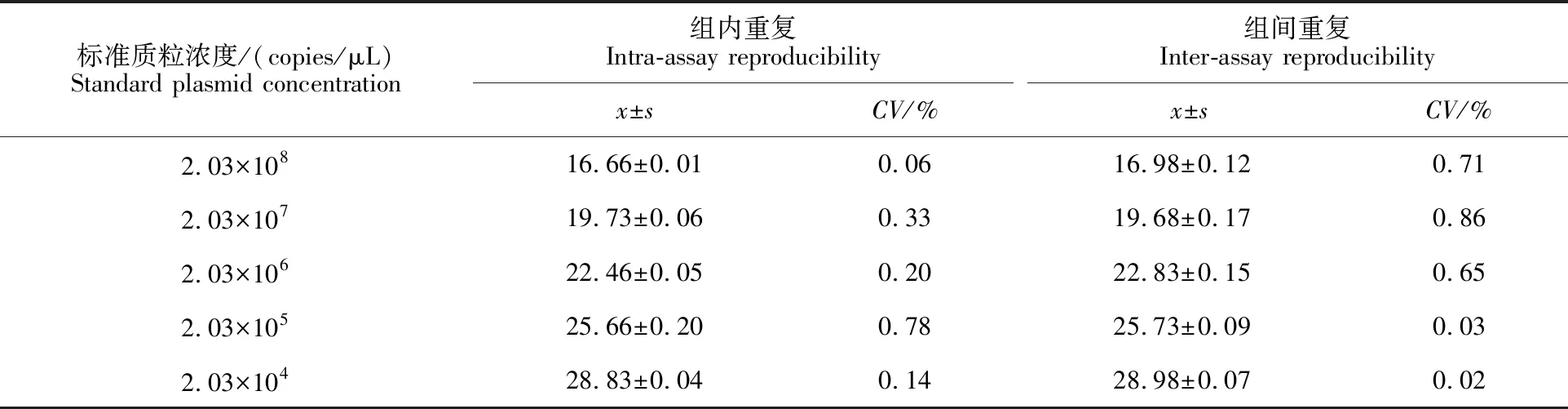
表4 Ⅰ群禽腺病毒血清4型TaqMan探针实时荧光定量PCR方法重复性检测结果Table 4 Repeatability results of TaqMan real-time PCR assay for detection of FAdV-4
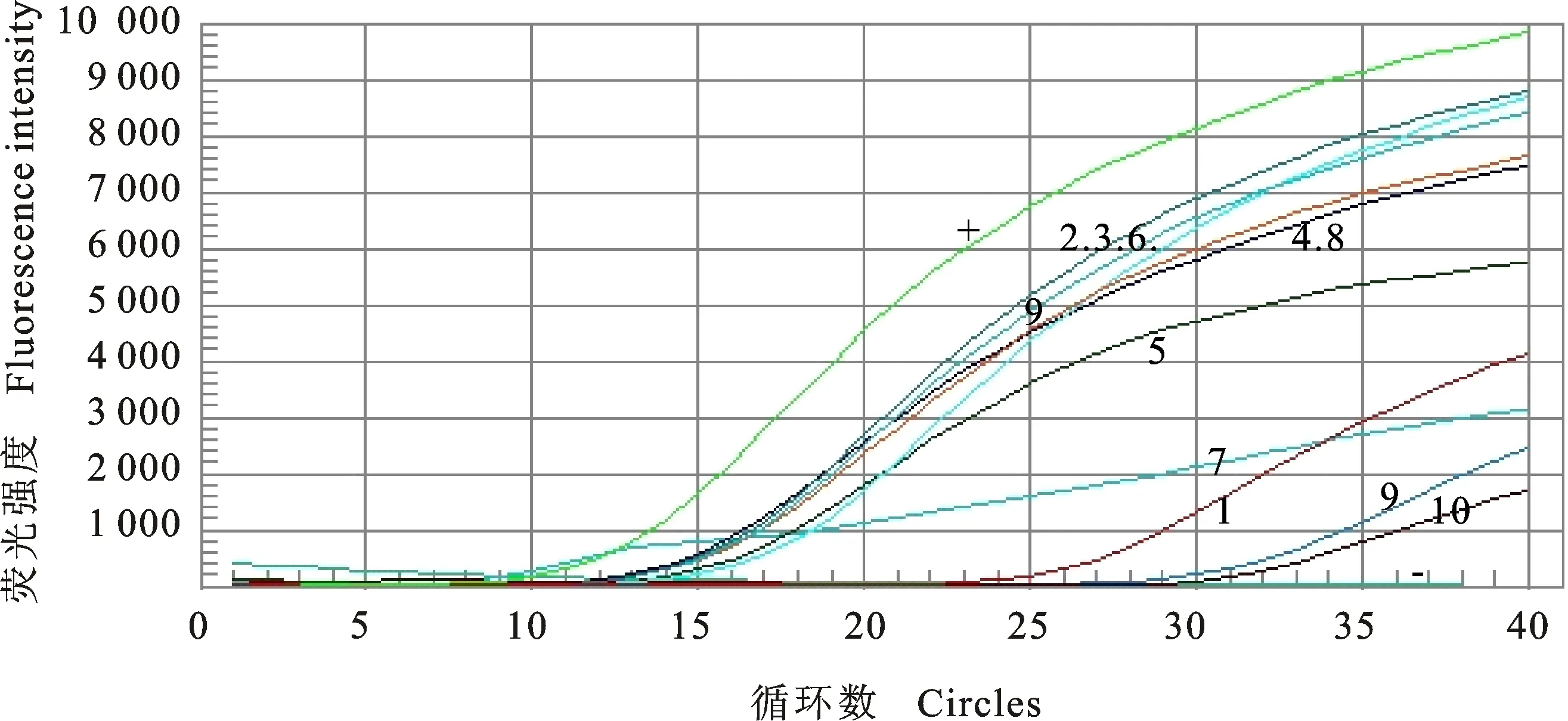
+.阳性对照 Positive control;1~10.样本 Specimens ;-.阴性对照 Negative control

M.DNA分子质量标准 DL50 DNA Marker ;+.阳性对照 Positive control;1~10.样本 Specimens ;-.阴性对照 Negative control
图10 临床样本的FAdV-4 PCR检测结果
Fig.10 Detecting results of clinical specimensusing FAdV-4 PCR assay
3 讨 论
鸡心包积液-肝炎综合征最早于1987年在巴基斯坦卡拉奇的安卡拉地区暴发流行,因此也叫“安卡拉”病,世界上已有40多个国家报道有鸡心包积液-肝炎综合征流行,但分离或检测到FAdV-4的只有19个国家[7],2015年6月以来,中国很多省份报道有该病的爆发流行,主要集中在河南、山东、黑龙江、河北、安微和辽宁等地区的鸡群。在这之前,中国尚未出现该病的大面积暴发,近年来,该病的发病范围还在不断扩大,给中国养禽业带来严重的经济损失[8]。目前针对该病的确诊方法有限,临床上易与鸡包涵体肝炎病混淆,感染后同时引起如禽流感、禽白血病、传染性法氏囊、大肠杆菌病等继发感染[9-10],这些因素给该病的临床诊断带来一定困难,单凭简单的病变观察和临床剖检手段无法确诊。实验室主要采用中和试验、琼脂扩散试验、免疫组织化学法及免疫荧光技术等方法对FAdV-4进行检测,这些检测方法具有较好的特异性,但存在敏感性和检测效率低等缺点[11]。PCR方法广泛应用于动物疫病病原的临床快速检测,大大提高对疫病病原的检测效率。六邻体(Hexon)基因编码的蛋白是FAdV-4的主要表面抗原蛋白,含有型与型之间的特异性抗原表位和中和性抗原表位,其中型间特异性表位作为禽腺病毒特征性标志和抗原靶位用于腺病毒感染的快速诊断具有重要意义[12]。对Ⅰ群禽腺病毒六邻体氨基酸序列进行序列分析发现,Hexon基因保守区的GC含量较高,致使设计的引物易出现引物二聚体,影响普通PCR或SYBR GreenⅠ荧光PCR检测效果。文艳玲等[13]建立Ⅰ群禽腺病毒SYBR GreenⅠ荧光PCR检测方法,表明该方法中荧光染料能与任一双链DNA结合,也能与非特异的双链DNA(如引物二聚体)结合,容易产生假阳性信号,给检测带来困难。TaqMan实时荧光定量PCR技术以标记特异性荧光探针为特点,兼备核酸高效扩增、光谱技术的高敏感性和高精确定量等优点,具有极高的特异性,并且不易造成交叉污染[14]。 唐熠等[15]认为传统PCR技术的灵敏度变幅一般为103~104copies/μL,而本研究中普通PCR检测灵敏度只有2.03×105copies/μL,这与TaqMan探针实时荧光定量PCR方法的检测灵敏度2.03×101copies/μL存在较大差距。TaqMan探针法和荧光染料法定量PCR存在明显差异,不同的目的基因扩增区域拥有特定的探针,TaqMan探针不会与体系中的所有DNA双链结合,因此大大减少引物二聚体和非特异性扩增等荧光信号出现[16-17],且反应过程中通过实时扩增曲线计算出准确的CT值,可根据建立的标准曲线确定样本中病原种类和含量,是真正意义上的DNA定量[18]。本研究根据Hexon基因保守区GC含量较高的特征,设计TaqMan探针,建立探针法实时荧光定量PCR方法,大大提高FAdV-4病原核酸的检测准确度和效率。
TaqMan探针技术对引物和探针的设计要求极其严格,设计合成的探针中即使只有一个碱基发生突变也有可能阻断荧光信号激发[19],同时,建立此方法时需要进行特异性、敏感性和临床应用性检测。 本研究在建立检测FAdV-4病原的方法时,选取易被Ⅰ群禽腺病毒血清4型混合感染的新城疫病毒(NDV)、鸡痘病毒、传染性支气管炎病毒(IBV)、鸡传染性法氏囊病病毒(IBD)、减蛋综合征病毒(EDSV)和H9亚型禽流感病毒(AIV)及空白对照进行特异性试验,评估针对其他病毒是否产生非特异性扩增[20-21]。结果证明TaqMan探针法有很高的特异性,与其他检测对象均无交叉反应。本研究对敏感性评价时,在进行引物序列和探针序列分析的基础上,有效评估所建立方法的敏感性,且敏感性达到2.03×100copies/μL,比文艳玲等[13]建立的SYBR GreenⅠ荧光素法1×102copies/μL高 100倍。TaqMan探针法实时荧光定量PCR另一大特点是对样本中目的基因检测的绝对定量,这广泛应用于病原组织嗜性、基因转录水平表达等分析[22]。近年来,TaqMan探针法在医药卫生、农业科学和生物学等领域得到广泛应用,由于其特异、灵敏性高等特点,在核酸分子检测技术中占有重要地位和强大的发展潜力[23-25]。本研究基于FAdV-4Hexon基因所建立的TaqMan探针法实时荧光定量PCR具有良好的特异性、敏感性、可重复性和临床应用性,可用于临床病例的快速诊断、病原组织嗜性等研究工作,为贵州省日益严重的鸡心包积液-肝炎综合征疫情防控提供关键技术,为FAdV-4贵州流行株的致病机制研究奠定基础。
——一道江苏高考题的奥秘解读和拓展

