LPA2在PC12细胞缺血再灌注损伤致细胞凋亡中的作用*
陈志洪,蔡雪平,周小梅
(广东省人民医院南海医院检验中心,广东佛山 528200)
近年来,脑血管疾病成为威胁人类健康的主要疾病,其中较为常见的脑血管疾病为脑卒中,是致患者死亡和残疾的主要因素,给社会和家庭带来极大压力和负担[1]。缺血性脑卒中主要是由于患者出现血栓或栓塞致大脑相关动脉闭塞,已知的原因有兴奋性毒性、细胞稳态丧失及血脑屏障破坏等,可能导致患者神经元死亡[2]。利用细胞分子学对缺血性脑卒中患者发病过程进行研究可较直观地反映患处缺血、缺氧环境下各种因素对患者神经元的影响。溶血磷脂酸(LPA)是一种结构最为简单的甘油磷脂酸酯,主要来源于被激活的血小板,神经系统是LAP受体表达的主要部位,且人体大脑中LAP处较高浓度状态[3]。相关研究发现,人类发生脑卒中后,其脑组织中LAP等浓度将显著升高,且升高LAP可致患者脑组织损伤加重[4]。PI3K/Akt途径可通过阻断人体细胞凋亡来有效保护人体细胞受损。PC12细胞主要来源于人体神经嵴,可分泌儿茶酚胺类递质[5]。本研究主要探讨LPA2在PC12细胞缺血再灌注损伤致细胞凋亡中的作用,现报道如下。
1 资料与方法
1.1一般资料 PC12细胞购自武汉大学基础医学院。所需仪器:低温离心机(美国Thermo公司,FRESCO17)、干湿恒温器(杭州奥盛仪器有限公司,MK2000-1)、电子天平(上海越平科学仪器有限公司)、-80 ℃及-20 ℃低温冰箱(青岛海尔股份有限公司)、三气及普通培养箱(长沙华曦电子科技有限公司)、酶标仪(Pemn Elmer)、磁力搅拌器(常州国华电气有限公司)、成像系统(日本Nikon DS-U3)等。
1.2方法 配置剥脱液,6.25 mL 1.0 mol/L Tris-氯化氢(pH=6.8)+73 mL蒸馏水+20 mL 10% 十二烷基硫酸钠(SDS)+10%β-疏基乙醇,1.0 mol/L的浓缩胶缓冲液(pH=6.8)。称取12.11 g Tris碱溶于80 mL蒸馏水中,然后采用10.0 mol/L HCL溶液将pH调至6.8,然后再定容至100 mL、1.5 mol/L分离胶缓冲液(pH=8.8),称取18.17 g Tris碱溶于80 mL蒸馏水中,然后采用10.0 mol/L HCL溶液将pH调至8.8,然后再定容至100 mL、10×电转缓冲液、10%四甲基乙二胺,30.30 g Tris-base+144 g甘氨酸加蒸馏水定容至1 000 mL,电转时现配成1×电转液中200 mL甲醇。10×电泳缓冲液,30.20 g Tris碱+144 g甘氨酸+10 g SDS,然后加蒸馏水,于60 ℃水浴锅中加热溶解,定容至1 000 mL,电泳时再现配。10%AP,1 g+蒸馏水溶解后定容至10 mL、10×TBST,24.20 Tris碱+80 g 氯化钠,然后加蒸馏水定容至1 000 mL,最后再稀释配制成1×TBST,最后再加入总体积0.1%的Tween-20、H2L5186303,5 mg H2L5196303粉末+20 μL二甲基亚砜(美国Amresco公司)配制成25 mg/mL H2L5186303,然后再从混合液中取出10 mL,并加入990 μL生理盐水及氢氧化钠、10×PBS缓冲液,1.20 g磷酸二氢钠+14.40 g磷酸氢二钠+40 g氯化钠+1 g氯化钾,加400 mL蒸馏水,搅拌后溶解,再调至pH=7.4,定容至500 mL等。向高糖培养基中加入10%胎牛血清(杭州四季青公司)和1%双抗以制作DMEM高糖培养基;其中DMEM无糖培养基则不做处理。
首先,从液氮容器中将冻存时间<3个月的冻存管取出,然后立即将其放置于37 ℃温水中,并摇动以使其融化;待其融化后将其取出并放置于超净工作台上将盖子打开,吸出PC12细胞悬液并放置于离心管中,然后,再加入适量高糖培养基,封口。以转速500 r/min进行离心处理,时间为10 min。之后采用吸管将上清液吸取弃掉,并再次加入高糖培养基,并轻轻吹打成悬液,再利用计数板进行计数,将其接种于培养皿,然后放置于37 ℃、5% CO2的培养箱中进行培养。待24 h后对细胞形态进行观察,如细胞贴壁且呈长梭状、突起明显则说明细胞复苏良好,并再次更换培养液以继续培养。
PC12细胞传代:工作前30 min将紫外灯打开消毒,培养基和PBS缓冲液等放置于温度为37 ℃的水浴中预热30 min;当PC12细胞密度在70%~80%时可进行传代,并采用PBS缓冲液清洗1次细胞,然后再次加入适量消化液,待肉眼可见白雾状且显微镜下可见细胞间隙变大则可吸出消化液。加入适量高糖培养基,轻轻吹打以使其脱壁,并将其制作成细胞悬液,然后将其沿着盖玻片边缘滴于细胞计数板内。显微镜下观察提示PC12细胞状态较好,且密度为70%~80%时可开始细胞冻存。
通过建立PC12细胞缺血再灌注受损细胞模型,分别于缺氧环境中培养0、3、6、9、12、15 h以进行糖氧剥夺,之后再将其放入至高糖培养基中再次复氧培养24 h,然后利用MTT来检测细胞存活率,并对其进行分组,分为正常组、缺血再灌注组(A组)、缺血再灌注+溶剂对照组(B组)、缺血再灌注+LPA2激动剂组(C组)、缺血再灌注+LPA2抑制剂组(D组)。先进行缺氧培养一定时间后再复氧培养24 h,并采用MTT(美国Amresco公司)检测细胞存活率,同时采用BCA法检测LPA2受体与P-akt蛋白的表达情况。

2 结 果
2.1PC12细胞缺氧存活率 缺氧0、3、6、9、12、15 h时的细胞存活率分布为100.0%、94.1%、81.2%、55.2%、49.2%、42.1%。随着缺氧时间的增加,PC12细胞存活率呈下降趋势,且缺氧后再复氧进行培养,结果显示细胞存活率显著下降(P<0.05)。
2.2各组细胞P-akt与LPA2受体表达情况 A组LPA2表达水平明显低于B组;C组与B组相比较,LPA2表达水平显著增高,且P-akt表达水平显著增高,差异有统计学意义(P<0.05)。见图1、2。
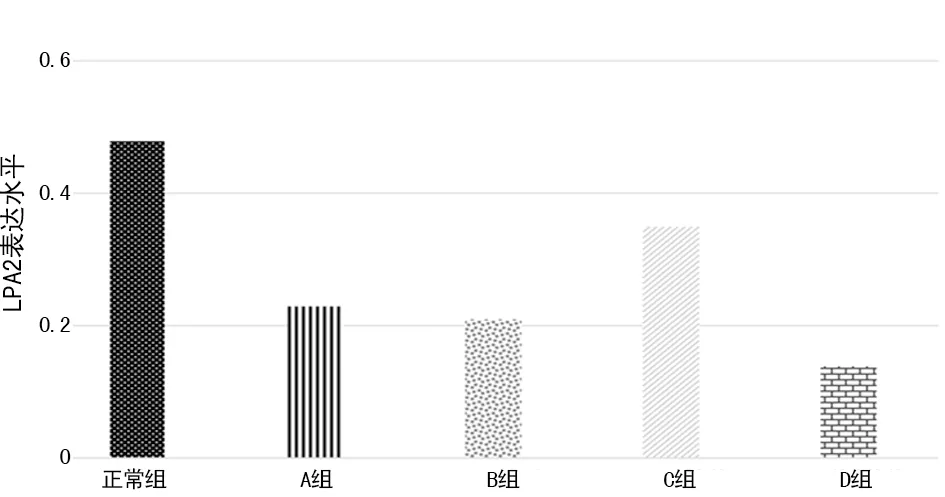
图1 各组LPA2表达水平比较

图2 各组P-akt表达水平比较
2.3各组细胞存活率比较 正常组、A组、B组、C组、D组细胞存活率依次为100.0%、48.6%、44.1%、69.8%、43.1%。经糖氧剥夺后,细胞存活率明显下降,然加入激动剂后,细胞存活率明显提高(P<0.05)。
3 讨 论
缺血性脑卒中是一种发病率较高的脑血管疾病,具有较高病死率和致残率,给人类生存质量造成极大影响[6-7]。在缺血性脑卒中患者发病早期阶段,患者局部脑缺血将形成中心坏死区和周围缺血半暗带区,其中坏死区域中神经元将会逐渐死亡,而半暗带区因存在侧支循环而有大量神经元存活[8]。因此,如可在短时间内恢复患者半暗带区血流供应,此时患者神经元仍可恢复功能;然而对于中心区域坏死区,即便恢复血供也会发生再灌注损伤,从而导致患者脑损伤,所以针对坏死区域已无法再挽救,只能进行有效保护,加强神经营养等。所以,缺血性脑卒中患者早期治疗的目的是促进患者缺血半暗带区域神经元功能的恢复。
LPA是一种类似生长因子的磷脂,广泛存在于中枢神经系统中,如脑膜、胚胎大脑及血管等,其以极低水平出现于人体脑脊液中,且在人体血液成分中表达显著,以血清清蛋白结合形式存在。LPA主要来源于被激活的血小板,但某些内皮细胞和炎症细胞也可产生LPA。神经系统是LPA受体表达的主要部位,且人体大脑中LPA以较高水平存在,LPA与LPA2信号传递也会参与神经损伤反应。在脑梗死发病早期阶段,缺血脑组织部位LPA水平相对较高,LPA参与到神经损伤过程中[9]。有研究发现,LPA2具有抗凋亡的作用[10-11]。本研究通过对PC12细胞实施糖氧剥脱后再继续培养以模拟人体内糖氧剥夺现象,结果显示,当缺氧6 h后,细胞存活率明显下降,12 h时的存活率为49.2%,且此时细胞形态结构开始出现破坏,随着缺氧时间的延长,细胞形态结构破坏程度明显增加,甚至开始出现破裂等现象。通过研究发现,采用缺氧12 h时的细胞来模拟缺血半暗带区具有一定价值,也是拯救细胞存活的关键[12-13]。本文对缺氧12 h的PC12细胞再次进行分组研究,结果显示经糖氧剥夺后,LPA2受体表达与B组无明显差异,由此可排除溶剂的影响。经使用激动剂后,LPA2受体表达明显增加,但D组较B组LPA2受体表达明显下降,说明经实施糖氧剥夺后,LPA2受体表达出现下降,且细胞存活率下降,但采用激动剂则可提高LPA2受体表达,同时增加细胞存活率[13-14]。
4 结 论
提高LPA2受体表达水平有利于避免细胞凋亡,对细胞起到一定保护作用,所以,利用溶栓早期治疗缺血性脑卒中具有较好的效果。随着LPA2受体的深入研究和应用,有望缺血性脑卒中患者神经功能恢复得到新的突破。

