超声造影引导下射频消融治疗不同病灶大小复发性肝细胞癌的疗效
孙建设 王汝梅 高国强
肝细胞肝癌的发病率、复发率、死亡率均较高,既往常用治疗方法为手术切除,目前,局部介入治疗在肝癌治疗中被广泛应用,总体疗效欠佳[1]。研究表明,射频消融(RFA)具有安全性高、重复性好等优势,尤其针对肝癌小病灶的治疗价值较高,有效率为88%~99%[2]。然而,在RFA干预时,部分病灶因处于膈肌、大血管等特殊部位,定位困难,这就需要提高病灶定位技术,为RFA治疗提供有利条件。近年来研究发现,超声造影能连续监测肝脏病变情况,了解局部病灶的微循环灌注状态,对肝癌诊断、治疗有重要作用[3]。本研究分析超声造影引导下RFA治疗不同病灶大小复发性肝细胞癌的价值,现报道如下。
资料与方法
一、一般资料
选取我院2014年1月至2018年1月收治的不同病灶大小复发性肝细胞癌患者120例。根据是否进行超声造影分别对照组(59例)和观察组(61例)。对照组男31例,女28例,年龄30~74岁,平均(57.78±9.64)岁;体质指数18~24 kg/m2,平均(20.53±1.16)kg/m2;直径1.32~7.56 cm,平均(4.63±2.16)cm;Child-Pugh分级:A级25例、B级34例;病灶数目:小病灶(最大直径<3 cm)40个、中等病灶(3~5 cm)29个、大病灶(>5 cm)15个;观察组男34例,女27例,年龄32~76岁,平均(59.87±10.15)岁;体质指数18~24 kg/m?,平均(20.49±1.13)kg/m2;肿瘤直径(1.30~7.51)cm,平均(4.59±2.12)cm;Child-Pugh分级:A级23例、B级38例;病灶数目:小病灶43个、中等病灶30个、大病灶17个。研究方案获本院伦理委员会批准,两组基线资料比较差异无统计学意义(P>0.05)。
二、纳入与排除标准
(一)纳入标准 (1)复发性肝细胞癌;(2)肿瘤最大直径不超过8 cm;(3)未见邻近组织侵犯;(4)无脉管癌栓;(5)病灶数目≤3个;(6)未见肝外转移;(7)Child-Pugh分级为A、B级;(8)知情同意。
(二)排除标准 (1)术前30d内有食管静脉曲张破裂出血史;(2)术前凝血功能障碍;(3)术前伴恶性腹水;(4)术前有胆道炎症;(5)术前活动性感染;(6)术前心、脑等器官功能衰竭;(7)伴其他恶性肿瘤。
三、治疗方法
两组均进行术前常规准备,包括凝血功能、肝功能、肾功能、血常规等检查,并完善肝脏MRI、CT等检查,明确肿瘤部位。取5~10 mL利多卡因(浓度为2%,西安迪赛生物药业,国药准字H61020713)注射于穿刺点,全麻者术前6~8 h禁食、禁水,局麻者无需禁食、禁水。于术前15 min取50~75 mg哌替啶(东北制药集团,国药准字H21022413)肌内注射,达到强化镇痛的目的。RFA治疗设备为冷循环射频消融系统(美国威力Cool-tip),术前经彩超观察病灶数目、部位,分析其与周围组织的关系,明确穿刺部位、进针路径、进针方向。两组均在超声引导下进行治疗,其中对照组仅进行常规超声检查,观察组行超声造影,仪器为彩色多普勒超声仪(美国GE 730),探头频率2.5~5.0 MHz,取2.4 mL造影剂(Sono Vue)于肘部浅静脉注入。
射频消融过程:根据病灶部位选择体位,如病灶处于右叶,则选取左侧卧位,若处于膈顶部,则选半卧位。将RFA系统连接,于患者大腿内侧贴上负极板,消毒、铺巾。在超声引导下刺入消融电极针,使其达肿瘤内部,确定操作过程中未造成组织损伤后,便可进行消融治疗。以30 W作为初始功率,选择自动消融模式,经电脑系统对消融功率进行控制,每次消融时间为12 min,完成消融后,将冷循环水泵关闭,针尖温度约90 ℃,在该状态下维持10 s,预防针道出血。利用超声对消融过程进行监控,当高回声团将病灶完全覆盖,或≥肿瘤边缘0.5 mm,则提示消融完毕。观察组利用超声造影观察是否存在病灶残留,若提示有残留,则进行补充消融,对照组则根据常规超声进行探查。两组治疗完毕后,患者于术后3个月入院复查,分析短期疗效。
四、观察指标
(1)疗效评估[4]:患者于术后3个月复查,评价短期疗效。完全灭活,常规超声提示局部未见彩色血流信号,超声造影提示未见增强回声结节,未见时相变化。局部残留,常规彩超提示病灶部位可见彩色血流,呈短线状,超声造影提示治疗区可见不规则增强回声结节,呈环状、灶状增强。(2)血清指标:分别在术前、术后3个月采集3 mL静脉血,离心20 min(1 500 r/min),分离血清,检测血清白蛋白(Alb)、ALT、碱性磷酸酶(ALP)、谷草转氨酶(AST)水平。(3)上门随访12个月,每3个月随访1次,分析两组再次复发率、死亡率。
五、统计学方法
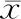
结 果
一、两组短期疗效比较
两组小病灶、中等病灶灭活率比较差异无统计学意义(P>0.05),观察组大病灶灭活率为64.71%,高于对照组的26.67%(P<0.05),见表1。观察组总灭活率为83.33%(75/90),高于对照组的70.24%(59/84,P<0.05)。
二、两组术前及术后3个月的肝功能比较
术前两组各肝功能指标比较差异无统计学意义(P>0.05),术后3个月,两组血清Alb、ALT、AST均高于术前,但观察组血清Alb、ALT、AST低于对照组(P<0.05)。见表2。
三、两组术后12个月内的死亡率、再次复发率比较
两组死亡率比较差异无统计学意义(P>0.05),观察组再次复发率为11.48%,低于对照组的25.43%(P<0.05)。见表3。
讨 论
本研究发现两组术后3个月的小病灶、中等病灶灭活率比较差异无统计学意义,提示RFA对中、小病灶的治疗效果良好。此外,观察组术后的大病灶完全灭活率高于对照组,表明在超声造影下行RFA治疗,能提高大病灶的消融质量。RFA的目的在于将肿瘤彻底清除,改善预后。然而,既往有学者发现在治疗过程中采用常规超声进行引导,容易因病灶边界、大小形态、部位等因素影响手术操作人员的判断,导致病灶无法完全消融[5]。近年来研究表明与常规超声相比,超声造影对病灶的显示效果更好,可及时发现卫星灶,从而更有效地指导RFA治疗[6]。在RFA干预过程中,超声造影能对操作过程进行全面观察,准确区分肿瘤组织、坏死组织,一旦发现病灶残留,能立即予以补充治疗,保证肿瘤能被完全消融[7]。因此,在超声造影引导下行RFA治疗,能提高病灶完全灭活率。
通过观察两组术后3个月的肝功能情况,发现两组均出现肝功能损害。研究表明RFA可导致部分肝功能区受损,尤其对老年患者而言,肝功能普遍欠佳,这是引起肝功能损害的重要原因[8]。本研究结果提示,观察组的肝功能损害较对照组相对较轻,表明超声造影引导下行RFA治疗,能减轻肝损害。分析原因可能在于对照组在常规超声引导下进行操作,对局部显示效果欠佳,在操作时易增加肝功能区受损面积,从而加重肝损伤,而超声造影对消融区域的显示更好,可减少组织损伤。本研究发现两组术后3个月的血清ALP比较差异无统计学意义,这可能是由于观察时间较短,或纳入病例数较少所致。
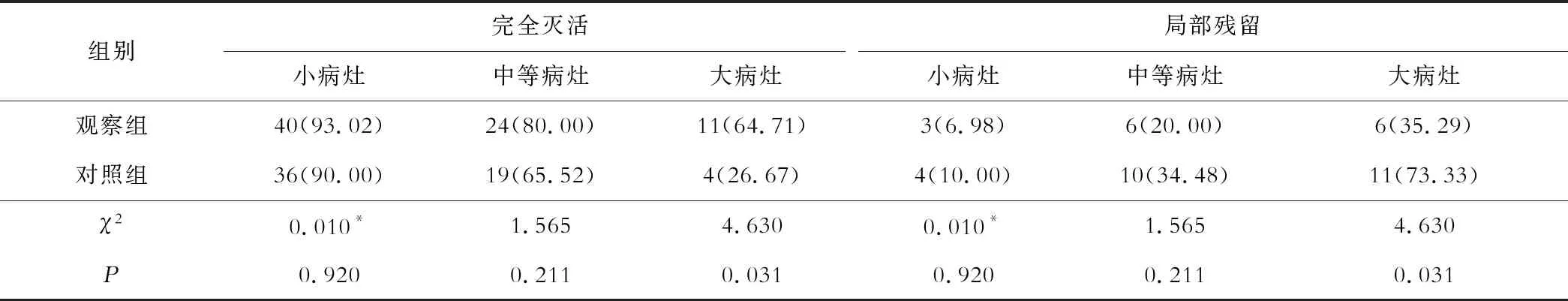
表1 两组短期疗效比较[例数(%)]
注:*采用连续性校正卡方检验
表2 两组术前及术后3个月的肝功能比较(±s)
注:与术前比较,△P<0.05
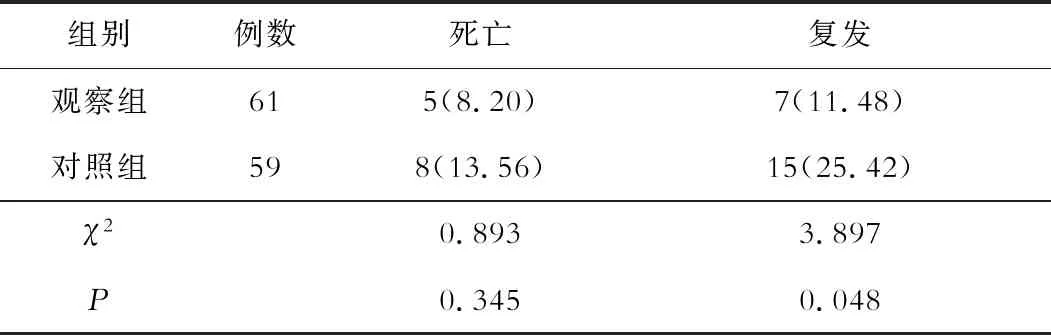
表3 两组术后12个月内的死亡率、再次复发率比较[n(%)]
本研究通过12个月的随访发现,观察组的再次复发率低于对照组,提示超声造影下行RFA治疗能降低复发率。超声造影能明确局部微血流灌注状态,尤其对小病灶残留敏感度高,并且能够连续、动态性对消融病灶进行监测,通过同步描记技术对消融边缘进行标记,可明确安全范围,减少损伤[9-10]。此外,超声造影的应用还可及时了解病灶灭活程度,便于最大限度将肿瘤消融,提高疗效,从而改善中期治疗效果,降低复发率。

