烧伤大鼠血清对血管内皮细胞通透性的影响
段声梁,胡子健,孟承颖,黄海良,蒋智永,蒋 薇,王 欢,余又新,孙业祥,方林森,胡德林
血管通透性增加是导致体液渗出、组织水肿、机体酸碱失衡和休克发生的重要因素,如何降低烧伤早期血管通透性、减少体液丢失对于预防烧伤早期组织器官损害均有重要意义。然而,烧伤后血管内皮细胞(endothelial cells,EC)通透性变化的机制及调控途径目前尚不明了。该实验通过烧伤大鼠血清干预血管EC,分别检测EC通透性变化及细胞通透性相关基因内皮素-1(endothelin-1,ET-1)、内皮因子受体A(endothelin receptor A,ETA)、ETB和带状闭合蛋白1(zona occluden-1,ZO-1)的mRNA和蛋白表达变化,探讨烧伤大鼠血清对血管EC通透性的影响,为深入研究烧伤早期血管通透性改变的机制及为烧伤的临床治疗提供帮助。
1 材料与方法
1.1 材料清洁级雄性SD大鼠,体质量150~180 g,共20只,每组10只,正常饮食水,饲养1周,环境温度在22~25 ℃,相对湿度60%~70%,购自安徽医科大学实验动物中心;RNA提取试剂盒购自美国Invitrogen公司;反转录试剂盒购自美国Thermo Fisher公司;实时荧光定量PCR (Real-time PCR,RT-PCR)反应试剂盒购自大连宝生物公司;ET-1、ETA、ETB和ZO-1抗体购自美国Santa Cruz公司。
1.2 方法
1.2.1大鼠烧伤模型复制及血清留取 雄性SD大鼠,体质量150~180 g,适应性喂养7 d。参照人与动物烧伤面积换算公式,以人体烧伤面积30% Ⅲ度烧伤为标准,应用沸水烫伤法复制大鼠烧伤12 h模型。腹主动脉取血后留取血清,以备后续实验所需。
1.2.2实验分组 将原代培养的大鼠主动脉EC根据是否应用烧伤血清干预分为正常组和血清干预组,正常组仅为原代培养的大鼠主动脉EC,血清干预组为应用烧伤12 h大鼠血清干预大鼠原代主动脉内皮细胞24 h。
1.2.3细胞培养 应用含10%胎牛血清的培养基于37 ℃、5% CO2培养箱中培养原代大鼠主动脉EC,隔天换液、观察细胞生长状况,当细胞汇合度约为90%时,进行消化、传代、种板,按1×105/孔接种于6孔细胞培养板。继续培养细胞至汇合度为80%时,将培养基更换为无血清RPMI1640培养基,进行后续实验。
1.2.4单层细胞通透性系数检测 将大鼠主动脉EC按1×105/孔接种于24孔Transwell小室,37 ℃、5% CO2培养8 h待其形成细胞单层。正常组按常规进行换液,血清干预组加入烧伤12 h大鼠血清,继续培养24 h。双层小室的顶室加入 FITC- albumin,底室加入D-Hank′s液,37 ℃、5% CO2孵育 45 min,吸取双层小室的顶室和底室液体,在荧光分光光度计测定各样品荧光强度,计算单层细胞通透性系数。
1.2.5RT-PCR 应用预冷的PBS洗涤细胞2~3次,参照细胞总RNA提取试剂盒说明书提取细胞总RNA。以总RNA为模板,参照逆转录试剂盒说明书合成cDNA第一链。以cDNA为模板,使用ABI7500 RT-PCR 仪检测相关基因的表达。RT-PCR反应程序为:95 ℃、5 s;60 ℃、34 s,设置循环数为40。以β-actin作为内参,采用2-△△Ct法比较分析各基因表达,PCR引物序列见表1。

表1 RT-PCR引物序列
1.2.6Western blot 应用RIPA细胞裂解液(强)提取细胞总蛋白,按30 μg/孔的标准加样、电泳。转膜结束后,封闭液封闭1.5 h,TBST洗膜3 min。参考抗体说明书进行操作,4 ℃孵育过夜,TBST洗膜3次,每次10 min。相应二抗室温孵育2 h,TBST洗膜3次,每次10 min;ECL发光、显影。Quantity One灰度分析软件检测各目的蛋白灰度值,以β-actin为内参计算其相对表达量。
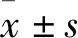
2 结果
2.1 烧伤大鼠血清干预对单层EC通透性的影响以正常组为对照,并将细胞通透系数均一化为100%,应用烧伤12 h大鼠血清干预大鼠原代主动脉内皮细胞24 h,荧光分光光度计比色法(检测波长为488 nm)检测正常组和血清干预组样品的荧光强度值(OD488 nm),计算单层EC膜通透性系数。结果显示,与正常组比较,血清干预组荧光强度明显增强,单层细胞通透性系数为(1.933±0.261),单层细胞通透性系数为正常组的1.933倍,明显升高(t=10.030,P<0.001),差异有统计学意义(P<0.01),见图1。
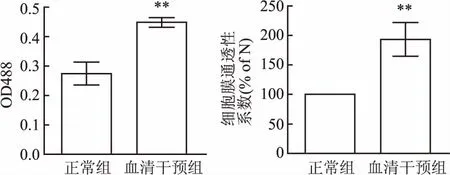
图1 烧伤大鼠血清干预对单层EC通透性的影响
2.2 烧伤大鼠血清干预对EC相关的mRNA表达影响应用烧伤12 h大鼠血清干预大鼠原代主动脉内皮细胞24 h,RT-PCR分别检测血管通透性相关的ET-1、ETA、ETB和ZO-1的 mRNA表达变化,结果显示:与正常组比较,血清干预组ET-1、ETA和ETB 的mRNA表达显著升高(t=37.190,P<0.001;t=78.580,P<0.001;t=28.750,P<0.001),而ZO-1的mRNA表达则明显降低(t=13.400,P<0.001),差异均有统计学意义(P<0.01),见图2。
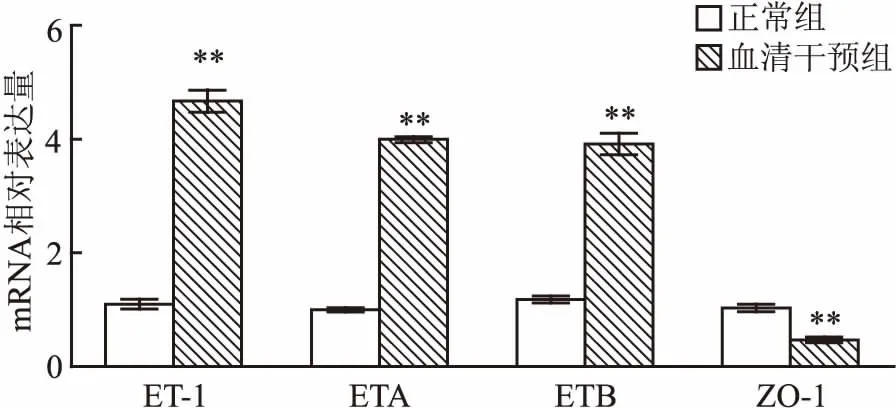
图2 烧伤大鼠血清干预对ET-1、ETA、ETB和ZO-1 mRNA表达的影响
2.3 烧伤大鼠血清干预对EC相关蛋白表达影响应用烧伤12 h大鼠血清干预大鼠原代主动脉内皮细胞24 h,Western blot分别检测血管通透性相关的ET-1、ETA、ETB和ZO-1蛋白表达变化,结果显示:与正常组相比,血清干预组ET-1(t=7.139,P=0.002)、ETA(t=6.343,P=0.003)和ETB (t=7.648,P=0.002)的蛋白表达显著升高,而ZO-1(t=8.743,P=0.001)的蛋白表达显著降低,差异均有统计学意义(P<0.01),见图3。
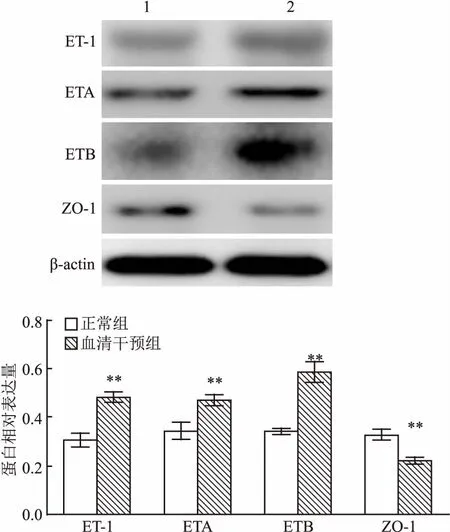
图3 烧伤大鼠血清干预对ET-1、ETA、ETB和ZO-1 蛋白表达的影响
1:正常组;2:血清干预组;与正常组比较:**P<0.01
3 讨论
烧伤后出现组织水肿、体液外渗的重要病理生理基础是血管通透性的改变,而血管通透性的改变是EC损害的主要表现之一[1-2],促炎性细胞因子、氧自由基等炎症介质的释放及相关转导通路的活化是EC损伤的主要病理机制[3]。
目前针对减轻血管通透性的治疗,尚无有效措施。血管通透性增高主要发生在微静脉,而微静脉的血管壁主要由EC、周细胞、基底膜和少量平滑肌细胞构成,其中血管EC在微静脉通透性改变中起主要作用[3]。本研究显示,将烫伤大鼠12 h血清干预大鼠的内皮细胞24 h,与正常组相比,血清干预组的EC细胞通透性系数明显升高,表明烧伤血清干预后的血管EC的通透性明显增加。
ET-1是由血管的EC合成和分泌,是一种缩血管的多肽类物质[4],烧伤后引起EC的缺血缺氧,是ET-1分泌的强烈刺激因素,并加重局部和全身循环的损害,ET-1在生物体内主要存在两种受体:ETA 和ETB[5]。近几年来针对血管通透性方面的研究,主要有EC间裂隙、穿细胞通道途径、与紧密连接相关蛋白的发现、细胞骨架的重构和应力纤维的形成、骨架蛋白的磷酸化等[6]。其中EC的收缩性改变是各种因素引起血管通透性增加的共同通路,而EC的裂隙是血管通透性增高和大分子物质透出的重要途径,内皮间的连接及相关蛋白是当前研究热点之一,紧密连接是由特异蛋白使相邻的两个EC之间的间隙完全闭锁,而ZO-1是参与紧密连接的重要蛋白之一[7-8]。本研究显示,血清干预组的血管通透性相关因子ET-1、ETA、ETB表达升高,ZO-1表达降低,Chu et al[9]研究发现使用浓度为20%的烧伤血清培养的人脐静脉EC间隙增加,即脐静脉的EC通透性增强,表明烫伤大鼠血清能够增加血管EC的通透性,烫伤大鼠血清中可能存在某种因子调控ET-1、ETA、ETB和ZO-1的表达,使血管EC的结构发生改变,导致了血管EC通透性的增加。
综上所述,本实验通过烫伤大鼠血清干预血管EC,结果显示血管EC的通透性显著增加,血管通透性相关因子ET-1、ETA、ETB和ZO-1表达发生改变,具体作用机制需要进一步深入研究。

