化浊解毒方对溃疡性结肠炎大鼠血清IL-1β、IL-8含量及结肠黏膜NF-κB mRNA表达的影响
李博林, 赵丹阳, 杜朋丽, 才艳茹, 何芳, 景璇, 杨倩, 胡婧楠, 李刚
(河北省中医院,河北石家庄 050011)
溃疡性结肠炎(ulcerative colitis,UC)是一种病因尚不明确的慢性炎症性疾病,病变主要累及结、直肠部位,临床表现以黏液脓血便、腹痛、腹泻、里急后重为主。近年来,随着生活方式、饮食结构的不断改变,我国UC发病率呈逐年上升的趋势[1]。本病病程长、易反复,严重影响患者生活质量。目前多认为该病与遗传因素、环境因素、免疫因素等有关[2]。在UC的致病因素中,免疫功能异常成为近年来研究的热点之一,尤其是核因子κB(NF-κB),其参与介导了一系列免疫炎症反应,在UC的发生发展中起重要作用[3]。本课题组前期临床观察发现UC的主要病机为浊毒内蕴[4],以此立论的化浊解毒方治疗UC疗效确切[5-8],但其具体作用机制尚不明确。基于此,本研究观察化浊解毒方对UC模型大鼠血清IL-1β、IL-8及黏膜组织NF-κB mRNA表达的影响,以探讨其作用机制,现将研究结果报道如下。
1 材料与方法
1.1 动物 8周龄清洁级雄性Wistar大鼠60只,体质量(120±20)g,购自河北医科大学实验动物中心,生产许可证号:SCXK(冀)2015-1-003,动物合格证号:1710300。于室温20~25℃饲养,湿度50%~70%,予普通饲料适应性喂养7 d后分组造模。
1.2 药物 化浊解毒方(组成:佩兰15 g,藿香12 g,茵陈蒿15 g,凤尾草15 g,飞扬草15 g,泽泻6 g,苍术12 g,厚朴6 g,胡黄连12 g,石榴皮12 g,地榆15 g,儿茶6 g,乌梅9 g,仙鹤草15 g,白芍15 g,佛手12 g),是由广州一方制药有限公司提供的免煎颗粒制剂。将药物溶于80℃的蒸馏水中,配成质量浓度为5 g/mL的混悬液备用。美沙拉嗪肠溶片,规格为0.25 g/片,国药准字H19980148,由葵花药业集团佳木斯鹿灵制药有限公司提供,研钵研成细粉,溶于蒸馏水配成0.3 g/kg溶液。
1.3 试剂与仪器 2,4,6-三硝基苯磺酸(TNBS;美国Sigma公司);无水乙醇(天津永大化学试剂有限公司);白细胞介素(IL)-1β、IL-8酶联免疫吸附分析(ELISA)试剂盒(深圳晶美生物工程有限公司);逆转录—聚合酶链式反应(RT-PCR)试剂盒(日本TaKaRa公司)。酶联免疫检测仪(芬兰雷伯公司);实时荧光PCR定量仪(美国Thermo Fisher仪器有限公司);低温离心机(美国Sigma公司);光学显微镜(日本Olympus公司);HMIAS-2000显微图像分析系统(武汉同济医科大学)。
1.4 模型制备 将60只雄性Wistar大鼠按照随机数字表分为正常组15只和造模组45只。采用TNBS/乙醇复合法建立UC大鼠模型[9]。具体操作方法:将5%TNBS与50%乙醇等体积混合为造模剂,造模组大鼠禁食不禁水24 h后称质量,乙醚麻醉;将造模剂按照4 mL/kg的剂量用直径约2 mm橡胶管推入距离肛门约6~8 cm的肠腔内,提起大鼠尾部倒置30 s,再捏紧大鼠肛门平放8~10 min。正常组予相同体积9 g/L NaCl溶液。造模结束后,将大鼠放回笼内,常规饲养。造模期间,造模组大鼠死亡1只。造模3 d后,于造模组随机抽取大鼠2只,断头处死,取结肠组织镜下观察,若见水肿、充血、糜烂、溃疡形成等病理改变,即可判断造模成功。
1.5 分组及给药 将造模成功的42只大鼠按照随机数字表随机分为3组,即UC模型组、美沙拉嗪组及化浊解毒方组,每组14只。根据“动物与人体的每公斤体质量剂量折算系数表”计算大鼠灌胃中药剂量,成人与大鼠的折算系数为6.25,大鼠每日用药剂量=成人每日用药总量/一般成人体质量(60 kg)×6.25。化浊解毒方组:给予化浊解毒方混悬液(剂量为20.0 g·kg-1·d-1)灌胃;美沙拉嗪组:给予美沙拉嗪混悬液(剂量为0.3 g·kg-1·d-1)灌胃;正常组:常规饲养;UC模型组:给予9 g/L NaCl溶液(剂量为4.0 mL·kg-1·d-1)灌胃。连续给药14 d。
1.6 标本采集及处理 连续给药14 d后,各组大鼠禁食不禁水24 h,称质量后予水合氯醛麻醉,开腹,股动脉取血2 mL置于试管中,血液凝固后分离血清,保存于-20℃冰箱备用。同时迅速在距离肛门8 cm处剪取病变结肠组织1 cm×1 cm,生理盐水冲洗,固定于体积分数为10%的中性缓冲福尔马林液24 h,常规脱水,石蜡包埋、切片,苏木素—伊红(HE)染色备用。
1.7 指标检测
1.7.1 疾病活动指数(disease activity index,DAI)评分 参照Murano等[10]制定的方法,DAI=(体质量下降分数+便血分数+大便性状分数)/3。
1.7.2 结肠黏膜组织大体观及病理学观察 大鼠处死后,取全结肠,生理盐水冲洗干净,肉眼下观察结肠黏膜的充血、水肿、糜烂、坏死、出血等情况。显微镜下观察结肠组织病理学变化情况,包括有无炎性细胞浸润、腺体结构是否完整、有无溃疡等情况。
1.7.3 采用ELISA法测定血清中IL-1β、IL-8含量具体操作按试剂盒说明进行。操作如下:采用抗人IL-1β/IL-8单抗包被于酶标板上,标准品和样品中的IL-1β/IL-8与单抗结合,加入生物素化的抗人IL-1β/IL-8,形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin与生物素结合,加入酶底物OPD,出现黄色。加终止液硫酸,颜色变深,在492 nm处测光密度(D)值。IL-1β/IL-8浓度与D(492 nm)值成正比,可通过绘制标准曲线求出标本中IL-1β、IL-8浓度。
1.7.4 采用RT-PCR法检测结肠黏膜组织中NF-κB mRNA表达情况 具体操作:采用Trizol法提取结肠黏膜组织总RNA,使用分光光度计检测260/280 nm处总RNA浓度后,开始反转录。反转录反应体系为20 μL,具体操作参照RT试剂盒说明进行。PCR扩增反应体系20 μL,NF-κB上游引物为5’-CTACCCCGAAATCAA AGACAAG-3’,下游引物为5’-ACTCTTGGCACAATCTCTAGGC-3’。以β-actin为内参。PCR反应程序如下:95℃30 s预变性,40个循环,95℃5 s变性,59.7℃30 s退火,72℃30 s采集荧光。使用Sequence Delection Soft Wareversion 1.2.3软件分析PCR过程中样本的CT值。通过2-△△CT计算NF-κB mRNA相对表达水平(p)。
1.8 统计方法 采用SPSS 20.0软件进行数据分析,计量资料以均数±标准差(-x±s)表示,以均进行正态性和方差齐性检验。多组比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠DAI评分比较 表1结果显示:与正常组比较,UC模型组大鼠DAI评分升高,差异有统计学意义(P<0.05);与UC模型组比较,2个治疗组DAI评分显著降低,差异有统计学意义(P<0.05);与美沙拉嗪组比较,化浊解毒方组DAI评分明显降低,差异有统计学意义(P<0.05)。
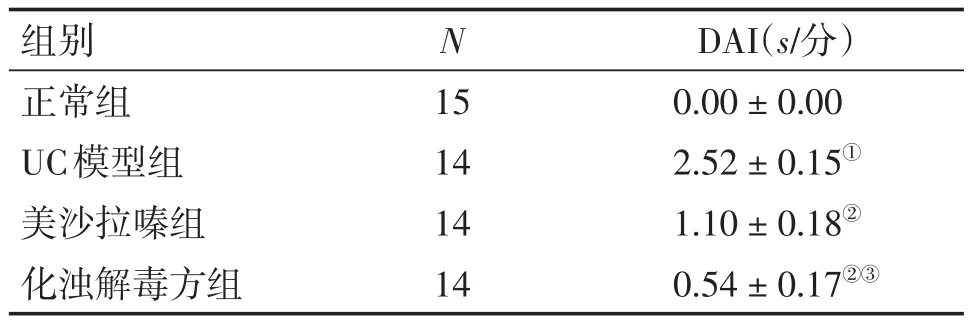
表1 各组大鼠DAI评分比较Table 1 Comparison of DAI score in various groups (-x±s)
2.2 各组大鼠结肠黏膜组织大体观及病理学比较 图1结果显示:与正常组比较,各造模组大鼠结肠黏膜表面均有不同程度的充血、水肿、糜烂等表现。其中,UC模型组最为严重,黏膜可见糜烂、水肿,部分出现溃疡及坏死,镜下腺体排列紊乱,大量炎性细胞浸润。与UC模型组比较,2个治疗组大鼠结肠黏膜均有不同程度缓解,化浊解毒方组黏膜表现接近正常组,其表面较光滑,水肿、充血不明显,可见愈合的溃疡面,黏膜腺体结构完整,偶有少量炎性渗出。美沙拉嗪组大鼠结肠黏膜表面欠光滑,可见少量水肿、糜烂及表浅溃疡形成,黏膜腺体结构基本完整,可见部分炎性细胞浸润。
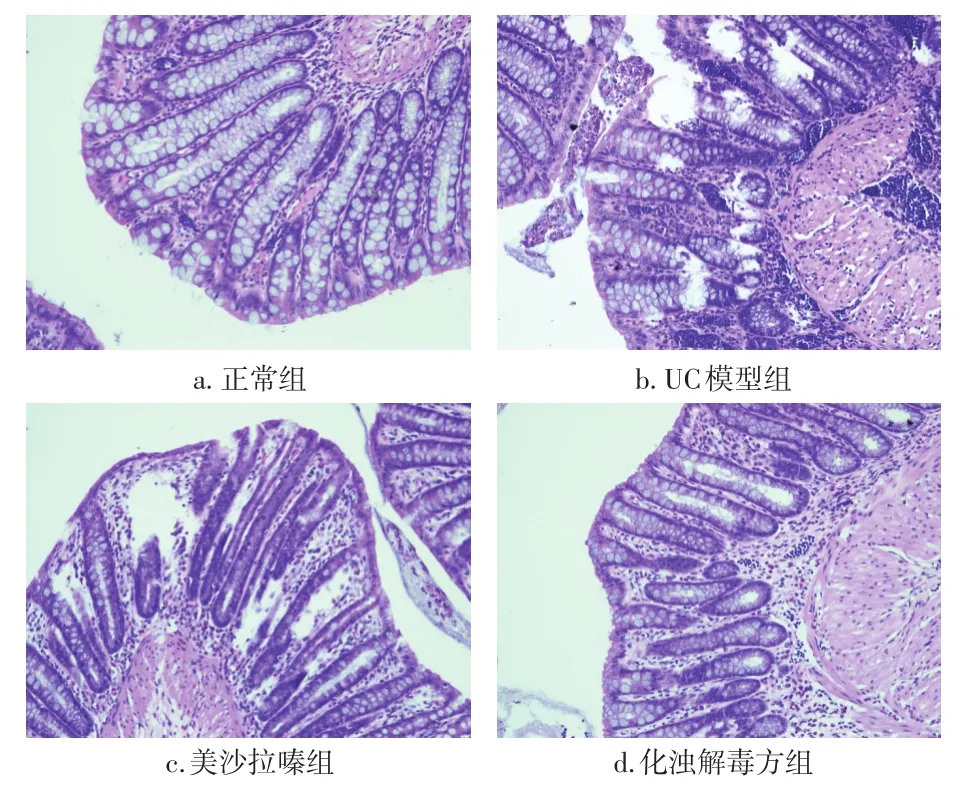
图1 各组大鼠结肠黏膜组织病理学观察(HE染色,×40)Figure 1 Comparison of pathological features of colonic mucosal tissues in various groups(by HE staining,×40)
2.3 各组大鼠血清中IL-1β、IL-8含量比较 表2结果显示:与正常组比较,UC模型组大鼠血清中IL-1β、IL-8含量显著升高,差异有统计学意义(P<0.05);与UC模型组比较,2个治疗组大鼠血清中IL-1β、IL-8含量均显著降低,差异有统计学意义(P<0.05);与美沙拉嗪组比较,化浊解毒方组血清中IL-1β、IL-8含量均明显降低,差异有统计学意义(P<0.05)。
2.4 各组大鼠结肠黏膜组织中NF-κB mRNA表达比较 表2结果显示:与正常组比较,UC模型组结肠黏膜组织NF-κB mRNA表达水平显著升高,差异有统计学意义(P<0.05);与UC模型组比较,2个治疗组大鼠结肠黏膜组织中NF-κB mRNA表达水平均显著降低,差异有统计学意义(P<0.05);与美沙拉嗪组比较,化浊解毒方组结肠黏膜组织中NF-κB mRNA表达水平明显降低,差异有统计学意义(P<0.05)。
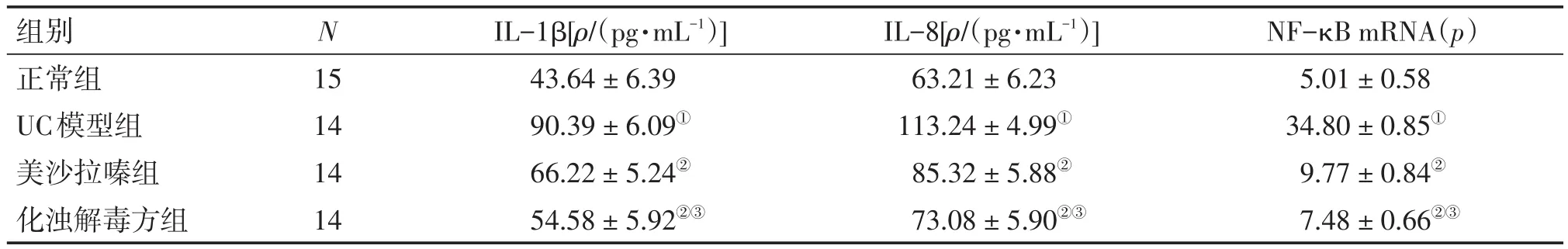
表2 各组大鼠血清IL-1β、IL-8含量及结肠黏膜组织NF-κB mRNA表达水平比较Table 2 Comparison of the serum contents of IL-1β and IL-8,and colonic mucosal expression level of NF-κB mRNA in various groups (-x±s)
3 讨论
UC是一种病因及发病机制尚不完全明确的慢性非特异性炎症性肠病。现代研究多认为,免疫异常是UC发生发展中的关键环节,而细胞因子在介导异常免疫反应中起重要作用。IL-1β是一种由单核巨噬细胞产生的致炎因子,可以激活树突样细胞吞噬抗原,释放抗原片段,参与免疫反应的持续与放大[11]。同时IL-1β也可诱导单核细胞及中性粒细胞趋化,分泌白三烯等大量炎症物质,使肠道黏膜丧失上皮屏障功能,从而加重炎症反应[12]。IL-8是在内源性及外源性因子刺激下产生的一种多肽因子。IL-8具有趋化和激活中性粒细胞等炎性细胞的作用,增加过氧化物及溶酶体酶数量,增强自然杀伤细胞的细胞毒性,参与UC发病过程[13]。NF-κB作为一种具有多向转录调节作用的转录因子,广泛存在于各类组织中,主要参与免疫应答、炎症反应、组织修复等基因信息的表达[14]。研究发现,活化后的NF-κB能够结合细胞核基因的增强子或启动子,调节基因转录,激活相关细胞应激基因,产生如IL-1、IL-6、IL-8等细胞因子[15]。NF-κB在UC的发生发展中起到了枢纽作用[3]。
在我国传统医学中并没有UC病名记载,根据其临床表现,可以将本病归属为“久痢”、“痢疾”等范畴[16]。古代医家多认为素体脾虚为UC发病基础,饮食不节(洁)、情志失调皆为常见病因,病理性质属本虚标实。本课题组经过大量临床实践发现,“浊毒内蕴”是本病的主要病机。现代饮食偏于肥甘厚味,日久则脾胃不和,运化失司,水湿内停,气机阻滞,湿热蕴结,湿久则化浊,热久而蕴毒,浊毒内蕴,与气血搏结,损伤肠络,血肉腐败化脓。针对此病机,本课题组自拟化浊解毒方治疗UC。方中佩兰“辛平能散结滞,芬芳能除秽恶”(《本草经疏》),乃祛浊要药,与藿香合用共奏化浊辟秽之功。凤尾草、飞扬草清热利湿解毒,亦有收敛止痢之效。四药合用化浊解毒,直击病源。茵陈蒿、泽泻利湿清热,化浊解毒。现代药理研究表明,茵陈可参与机体免疫调节,同时对金黄色葡萄球菌、大肠杆菌等有不同程度的抑制作用。佛手、厚朴理气宽中,“调气则后重自除”。地榆苦寒,凉血止血、疗疮解毒,儿茶活血化瘀、收敛生肌,胡黄连清热凉血燥湿,仙鹤草收敛止血解毒,四药合用“行血则便脓自愈”。石榴皮、乌梅涩肠止泻,苍术健脾止痢,白芍行气和血,缓急止痛。诸药合用,化浊解毒,调气和血,诸症向愈。
本研究结果显示:经化浊解毒方治疗后,UC大鼠体质量、便血、粪便性状等一般情况均得到显著改善,镜下结肠黏膜恢复良好,血清中IL-1β、IL-8含量及结肠黏膜NF-κB mRNA表达水平显著降低。提示化浊解毒方可能是通过改善NF-κBmRNA表达,抑制相关炎症因子的表达,达到修复受损肠黏膜、治疗UC的目的。

