p53和Bcl- 2阳性表达与乳腺癌患者临床特征的关系
焦丹,刘越
酒泉市人民医院1病理科,2肿瘤科,甘肃 酒泉7350000
乳腺癌是起源于乳腺上皮组织的恶性肿瘤,其发病率居欧美发达国家女性恶性肿瘤第1位,近年来,随着中国生活水平的不断提高、生活方式及环境的改变,其发病率不断升高,严重威胁中国女性健康[1-2]。乳腺癌的发生、发展是一个复杂的演变过程,促癌基因的激活、抑癌基因的失活及细胞凋亡的抑制在该过程中发挥重要的作用[3],其中参与细胞凋亡调节的p53和B淋巴细胞瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)基因的激活与乳腺癌有密切的关系。由p53基因编码的蛋白是一种转录因子,p53基因突变后可诱发多种肿瘤[4],Bcl-2是重要的凋亡因子,其表达的蛋白可与该家族其他蛋白通过复杂的机制调节细胞凋亡。本研究分析了122例乳腺癌患者的临床资料,旨在探究p53和Bcl-2的表达情况与乳腺癌患者临床特征的关系,为乳腺癌的辅助治疗、预后评估和生物学行为提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年6月至2018年6月于酒泉市人民医院诊治的乳腺癌患者。纳入标准:①接受乳腺癌手术治疗且术后病理检查确诊为乳腺癌;②肿瘤无远处转移,无锁骨上淋巴结转移;③病历资料完整。排除标准:①合并其他部位的恶性肿瘤;②术前接受了新辅助化疗。根据纳入、排除标准,共纳入122例乳腺癌患者。所有患者均为女性,年龄23~79岁,平均年龄为(45.7±9.2)岁;肿瘤最大径为(3.30±0.94)cm;病理类型:浸润型导管癌87例,浸润性小叶癌26例,其他9例;临床分期:Ⅰ期36例,Ⅱ期46例,Ⅲ期40例;组织分化程度:高分化60例,中分化42例,低分化20例;雌激素受体(estrogen receptor,ER)状态:阳性63例,阴性59例;孕激素受体(progestogen receptor,PR)状态:阳性54例,阴性68例;人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)状态:阳性 31例,阴性91例;Ki-67表达:阳性84例,阴性38例。
1.2 治疗方法
122例患者中88例行乳腺癌改良根治术治疗,19例行乳腺癌常规根治术治疗,15例行乳腺癌保乳术治疗,术后根据患者病理及免疫组织化学结果进行后续放化疗和(或)内分泌治疗和(或)靶向治疗。
1.3 检测方法及判断标准
患者病理资料由病历中病理报告获得,术后肿瘤组织标本采用免疫组织化学法进行检测,检测所用的抗体及试剂盒均购自北京中杉金桥生物科技有限公司,检测步骤严格按照说明书操作。Bcl-2蛋白染色阳性细胞表现为细胞膜、细胞质和细胞核呈棕黄色颗粒,以细胞质为主。p53、ER、PR及Ki-67染色阳性细胞表现为细胞核内呈棕黄色颗粒或团块。上述指标阴性为其阳性细胞比例<10%,阳性为其阳性细胞比例≥10%。HER2检测结果判断:HER2阳性为阳性细胞比例≥75%;或25%≤阳性细胞比例<75%,进一步荧光原位杂交(fluorescence in situ hybridization,FISH)检测到HER2基因扩增;HER2阴性为阳性细胞比例<25%;或25%≤阳性细胞比例<75%,进一步FISH未检测到HER2基因扩增。
1.4 观察指标
统计所有患者的p53、Bcl-2表达情况,统计年龄、肿瘤最大径、病理类型、临床分期、组织分化程度、腋窝淋巴结转移情况、ER表达情况、PR表达情况、HER2表达情况及Ki-67的表达情况等临床特征,并分析p53、Bcl-2表达与乳腺癌患者临床特征的关系。
1.5 统计学方法
采用SPSS 22.0统计软件分析数据。计量资料以均数±标准差(±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验;多因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌患者 p53及Bcl- 2阳性表达影响因素的单因素分析
不同临床分期、组织分化程度的乳腺癌患者的p53及Bcl-2阳性表达率比较,差异均有统计学意义(χ2=14.529、15.201,P<0.01;χ2=16.279、10.959,P<0.01);不同肿瘤最大径的乳腺癌患者的Bcl-2阳性表达率比较,差异有统计学意义(χ2=7.178,P<0.05);有腋窝淋巴结转移、ER阴性、PR阴性的乳腺癌患者的p53阳性表达率均明显高于无腋窝淋巴结转移、ER阳性、PR阳性的患者,差异均有统计学意义(χ2=11.586、10.328、6.897,P<0.01);无腋窝淋巴结转移的乳腺癌患者的Bcl-2阳性表达率明显高于有腋窝淋巴结转移的患者,差异有统计学意义(χ2=14.992,P<0.01);不同年龄、病理类型、HER2状态、Ki-67表达情况的乳腺癌患者的p53及Bcl-2阳性表达率比较,不同肿瘤最大径的乳腺癌患者的p53阳性表达率比较,不同ER、PR阳性表达率的乳腺癌患者的Bcl-2阳性表达率比较,差异均无统计学意义(P>0.05)。(表1)
2.2 乳腺癌患者 p53及Bcl- 2阳性表达影响因素的多因素Logistic回归分析
将上述单因素分析中有统计学意义的临床特征作为自变量,将乳腺癌患者p53及Bcl-2阳性表达作为因变量进行多因素Logistic回归分析,结果显示,有腋窝淋巴结转移、临床分期为Ⅲ期及低分化均是p53阳性表达的独立危险因素(P<0.01),ER阳性表达为p53阳性表达的保护因素(P<0.01)(表2);临床分期为Ⅲ期、低分化、有腋窝淋巴结转移均是Bcl-2阳性表达的保护因素(P<0.01)(表3)。而单因素分析中与p53表达相关的PR表达情况及与Bcl-2表达相关的肿瘤最大径,多因素分析差异均无统计学意义(P>0.05),因此,未在Logistic回归分析结果中显示。

表1 不同临床特征的乳腺癌患者的 p53及Bcl- 2阳性表达情况
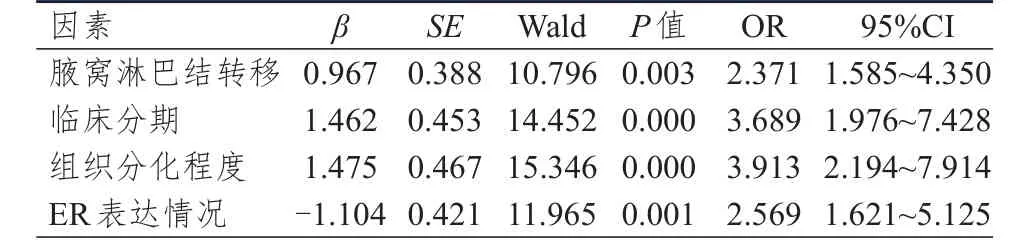
表2 122例乳腺癌患者 p53阳性表达的Logistic回归分析
3 讨论
细胞凋亡是由一系列基因调控的程序化细胞主动自杀的过程,是通过外源性或内源性的凋亡信号激活细胞内编码的自杀程序而触发,是维持自身稳定及清除异常细胞的重要机制[5-6]。对细胞凋亡相关基因如p53及Bcl-2的研究一直是生命科学的热点,其在乳腺癌的发生及发展中起着重要的作用。研究乳腺癌p53及Bcl-2的表达及其与乳腺癌患者临床特征的关系,可为乳腺癌的辅助治疗、预后评估提供参考。
p53是20世纪80年代发现并确定的一种抑癌基因,其定位于染色体17p13.1,由11个外显子和10个内含子构成,其产物可启动DNA损伤的细胞凋亡程序使其凋亡,一旦其发生缺失等突变,则会丧失抑制肿瘤的功能,导致细胞癌变[7]。但p53蛋白的半衰期较短,难以检出,仅半衰期长的突变型p53蛋白可应用免疫组织化学法检出[8]。多项研究提示,p53蛋白检测在评价乳腺癌的发生、发展及预后方面有重要的意义,其可作为预测乳腺癌的标志物[9-11]。本研究结果显示,有腋窝淋巴结转移的乳腺癌患者的p53阳性表达率明显高于无腋窝淋巴结转移的患者(P<0.01),表明p53表达情况与淋巴结转移情况密切相关,同时不同临床分期、组织分化程度的乳腺癌患者的p53表达情况比较,差异均有统计学意义(P<0.01),且临床分期为Ⅲ期及低分化的患者的p53阳性表达率高;多因素Logistic回归分析其差异仍有统计学意义(P<0.01),这与部分研究者的结论相符[12-13]。乳腺癌淋巴结转移是评估患者临床分期及预后的重要指标,也是术后复发转移的因素之一[14],ER及PR阳性表达提示患者术后预后相对较好,HER2及Ki-67阳性表达提示肿瘤增殖快,易侵袭,预后较差。本研究结果显示,ER阴性、PR阴性的乳腺癌患者的p53阳性表达率均明显高于ER阳性、PR阳性的患者(P<0.01),多因素Logistic回归分析亦显示ER阳性表达是p53阳性表达的保护因素。综上,不利于预后的因素(有腋窝淋巴结转移、临床分期高及组织分化程度低)是p53阳性表达的独立危险因素,即临床分期高、组织分化程度低、有腋窝淋巴结转移的患者,p53阳性表达率升高;有利于预后的因素(ER阳性表达)是p53阳性表达的保护因素,即ER阳性表达的患者,p53表达表达率降低,这提示p53基因阳性表达预示预后不良。
Bcl-2基因是最受关注及研究最多的凋亡基因,其产物通过抑制细胞凋亡参与肿瘤的发生发展,其调控细胞凋亡主要通过线粒体途径实现[15]。Bcl-2蛋白作用于线粒体并抑制线粒体通透性转换孔的开放,同时阻断细胞色素C从线粒体释放,进而抑制细胞凋亡[16]。值得注意的是,虽然Bcl-2表达抑制了细胞凋亡,但同时也使肿瘤细胞周期延长,从而抑制了肿瘤细胞的快速增殖[17]。研究显示,Bcl-2阳性表达与肿瘤恶性程度呈负相关,可作为乳腺癌的预后因素[18]。亦有研究发现,Bcl-2在高分化的肿瘤组织中的阳性表达率低于低分化组织,Bcl-2阳性表达与组织分化程度呈负相关[19];Bcl-2阴性表达、有腋窝淋巴结转移的乳腺癌患者的生存期缩短[20]。上述结论与本研究结果相似。本研究结果显示:有腋窝淋巴结转移、临床分期为Ⅲ期、低分化是Bcl-2阳性表达的保护因素,即临床分期高、低分化、无腋窝淋巴结转移的患者,Bcl-2的阳性表达率升高。因此,Bcl-2阳性表达预示患者预后相对较好。
综上所述,临床分期为Ⅲ期、低分化、有腋窝淋巴结转移、ER阴性的乳腺癌患者的p53阳性表达率升高,p53阳性表达预示预后不良;临床分期为Ⅲ期、低分化、有腋窝淋巴结转移的乳腺癌患者的Bcl-2阳性表达率降低,Bcl-2阳性表达预示患者预后相对较好;p53及Bcl-2阳性表达情况与乳腺癌患者的临床特征密切相关。检测p53及Bcl-2的阳性表达情况对评估患者的病情及预后有参考价值。

