一株自然发酵甘薯酸浆的促淀粉絮凝酵母菌的分离鉴定及其共凝集特性
季子非,王筱瑜,田 原,许云贺,郭浩男,邢 铖,王淋枫,张莉力
(锦州医科大学食品科学与工程学院,辽宁锦州 121000)
酸浆法沉降淀粉在我国已有很长的历史,酸浆是用加水磨浆的绿豆或甘薯制成后经产酸类微生物自然发酵而形成的淡黄色有酸味液体[1]。在传统淀粉的生产过程中,加入酸浆会使淀粉乳中的淀粉颗粒立即凝聚,重力变大,淀粉迅速沉降,此时使用的酸浆就是一种絮凝淀粉的微生物絮凝剂。虽然传统酸浆法制淀粉不如现代工业化生产效率高,但此法所得的粉条等制品口感更佳,故酸浆法在实际生产中依然有着广泛应用[2-4]。张莉力等[5-6]研究发现,在乳酸菌的表层存在一类特殊功能性蛋白,可以特定识别和结合淀粉颗粒,并且可以把大分子量蛋白质分解为短链的肽类,使得蛋白质和淀粉的比重差增大,从而使淀粉加速下沉,蛋白类物质在上层清液中被分离。吴衍庸等[7]的研究中发现,酸浆中酸含量、pH及金属离子等因素也会影响淀粉沉降效率。有些酵母菌能和乳酸菌共生,Freitas等[8]研究表明,当具有发酵乳糖性质的酵母菌与乳酸菌共生培养时,乳酸菌产酸性能会大幅增加,这可能是因为多种微生物在生长过程中的代谢产物可以被相互利用,其机制有待进一步研究。
微生物的共凝集现象在自然界中普遍存在,但目前这方面的研究主要集中在细菌与细菌间的共凝集,关于乳酸菌与酵母菌共凝集的研究较少。实验前期已从自然发酵酸浆中分离出两株对淀粉具有高絮凝活性的乳酸菌[9-10],乳酸菌的纯培养液对淀粉具有较高的絮凝活性,但与自然发酵酸浆的絮凝活力相比仍有差距。在后期的研究中发现,酸浆中的一些酵母菌虽然不具有絮凝淀粉的活性,但将这些酵母菌接入乳酸菌发酵液后,可以明显提高乳酸菌发酵液对淀粉的絮凝活性,并发现在淀粉沉降颗粒中乳酸菌和酵母菌存在普遍的共凝集现象。所以,本实验从自然发酵的甘薯酸浆中分离了与副干酪乳杆菌共凝集作用较强的酵母菌,并探究了几种影响二者共凝集的理化因素。
1 材料与方法
1.1 材料与仪器
食品级甘薯、马铃薯 锦州新玛特超市;副干酪乳杆菌L1 锦州医科大学食品科学与工程学院食品微生物实验室保存;MRS肉汤培养基、葡萄糖、酵母粉、牛肉膏、无水乙酸钠、磷酸氢二钾 北京奥博星生物技术有限公司;氯霉素 合肥博美生物科技有限责任公司;DNA提取试剂盒(D2300) 北京索莱宝科技有限公司;PCR回收试剂盒(AP-GX-250) 爱思进生物技术(杭州)有限公司。
FA2104N型分析天平 兰州中西仪器;BOXUN立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;JB-VS-1300超净工作台 金坛市鑫鑫实验仪器厂;DHP-9082电热恒温培养箱 苏州佳宝净化工程设备有限公司;PHS-3B精密pH计 上海雷磁仪器厂;数码生物显微镜 OLYMPUS CX-21;PCR仪 Applied Biosystems公司;T20MM立式高速冷冻离心机 湖南赫西仪器装备有限公司。
1.2 实验方法
1.2.1 培养基配制 甘薯汁葡萄糖培养基:甘薯200 g洗净切丝,加入蒸馏水1000 mL煮沸20 min过滤得甘薯汁,加入葡萄糖20 g氯霉素 0.2 g。甘薯汁肉汤培养基:甘薯200 g洗净切丝,加入1000 mL蒸馏水煮沸20 min过滤得甘薯汁,加入酵母粉5 g,牛肉膏10 g,葡萄糖22 g,无水乙酸钠5 g,K2HPO42 g。
1.2.2 自然发酵甘薯酸浆的制备 称取500 g甘薯洗净切丝,加入1500 mL凉开水,打浆机调至3档运行45 s,间隔30 s,再用3档打浆30 s,将打出浆过八层纱布后再用120目筛子过滤,得甘薯浆后将其转入灭菌冷却后的烧杯中,静置30 min后去除约三分之二上清液,剩余薯浆搅匀,加水至原体积,20~30 ℃发酵12~24 h,每隔3~4 h搅拌1次[1]。
1.2.3 自然发酵甘薯酸浆的活化 甘薯榨汁制得甘薯浆,将其加入到1.2.2发酵的老浆中搅匀,再重复1.2.1去上清步骤以去除杂质,每隔24 h活化一次,直至上清液颜色由褐色变成青白色,有少量水沫,味变酸,pH3.5~4.0,且上清液加入甘薯淀粉乳中可快速沉降分层。
1.2.4 酸浆中酵母菌的筛选
1.2.4.1 初筛 采用稀释平板涂布法,分离纯化样品中的酵母菌。用无菌蒸馏水将活化好的酸浆梯度稀释为10-5、10-6、10-7三组浓度,各取0.1 mL涂布到氯霉素抗性的(0.2 g/L)PDA平板上,30 ℃培养48 h。挑取典型的酵母菌菌落并镜检,将初步判定为酵母菌的菌落接种到PDA平板上划线分离,30 ℃下培养48 h。如此反复划线纯化2~3次,根据各菌落形态,直到确定为单菌落后编号。
1.2.4.2 复筛 将编好号的菌株接种到甘薯汁葡萄糖培养基中,30 ℃恒温培养48 h,活化3代,8000 r/min离心10 min并重悬于无菌蒸馏水洗涤两次,调整OD600至0.7备用。
副干酪乳杆菌L1接入甘薯汁肉汤培养基活化3代,30 ℃培养24 h,8000 r/min离心10 min并重悬于无菌蒸馏水洗涤两次,调整OD600至0.7。将初筛得到的各株酵母菌分别与副干酪乳杆菌L1两两配对。将两株配对菌的菌悬液各5 mL加入15 mL离心管中,旋涡30 s混匀,于30 ℃孵育24 h后取上清液,在600 nm处测定吸光值并计算共凝集率,公式如下。再从中选出共凝集率最高的菌株,鉴定菌种。
共凝集率(%)=[(OD600A+OD600B)-OD600(A+B)]×100/(OD600A+OD600B)
式中:OD600(A+B)为两种菌液混合孵育后的吸光值,OD600A和OD600B分别为副干酪乳杆菌L1和酵母菌两种菌悬液单独孵育后的吸光值[11]。
1.2.5 酵母菌菌种鉴定
1.2.5.1 形态学鉴定 将上述筛选得到的酵母菌划线接种于PDA平板上,30 ℃培养48 h,观察其菌落颜色及形态,对该酵母镜检,在油镜下观察酵母菌的细胞形态。
1.2.5.2 生理生化实验 糖发酵实验:按培养液体积的2%分别加入葡萄糖、果糖、蔗糖、麦芽糖、乳糖、木糖、海藻糖于培养液中,分装试管后再倒置各加入杜氏管一支,置于30 ℃下培养48 h,不加任何糖源做空白对照;氮源同化实验:将脲、蛋白胨、硫酸铵、氯化铵分别加入培养液分装,不加任何氮源做空白对照,30 ℃培养48 h,观察试管中是否浑浊;碳源同化实验:加入碳源分别为葡萄糖、麦芽糖、乳糖、果糖、木糖、蔗糖,方法同氮源同化实验[12]。
1.2.5.3 分子生物学鉴定 提取分离筛选所得的酵母菌DNA,进行PCR扩增26S rDNA,采用引物为26sF:5′-GCATATCGGTAAGCGGAGGAAAAG-3′和26sR:5′-GGTCCGTGTTTCAAGACGG-3′。PCR反应体系为50 μL,其中基因组DNA 1.0 μL,10×Buffer(Mg2+Plus)5.0 μL,Taq聚合酶(5 U/L)1.0 μL,dNTP(10 mmol/L)1.0 μL,正向和反向引物共3.0 μL,加去离子水(ddH2O)39.0 μL至50.0 μL。扩增程序为95 ℃预热300 s,98 ℃解链30 s,58 ℃退火30 s,72 ℃延伸90 s,共35个循环。反应完成后,取3 μL PCR产物进行1%琼脂糖凝胶电泳检测。确认PCR扩增片段后将PCR产物送至上海派森诺生物科技公司测序。将测得的基因序列提交到Genebank进行同源性比较,最后用MEGA5.0软件构建系统发育树。
1.2.6 理化因素对酵母菌与副干酪乳杆菌L1共凝集特性的影响
1.2.6.1 菌悬液的制备 酵母菌活化后接入PDA液体培养基,30 ℃培养48 h,8000 r/min离心10 min收集菌体,无菌蒸馏水洗涤两次后重悬,调菌悬液OD600至0.7左右备用。副干酪乳杆菌L1活化后接入甘薯肉汤汁培养基,30 ℃培养24 h,8000 r/min离心10 min收集菌体,无菌蒸馏水洗涤两次后重悬,调菌液OD600至0.7左右备用。
1.2.6.2 缓冲液 制备菌悬液时,分别采用无菌蒸馏水和PBS(pH=7)重悬并调菌液OD600值至0.7,酵母菌和乳酸菌分别设置单菌对照,30 ℃静止孵育,分别在4、24 h取上清液测OD600,根据1.2.4.2的测定方法计算共凝集率,处理数据。
1.2.6.3 温度 将菌悬液调OD600值至0.7,单菌对照,分别置于20、35、50、65 ℃下孵育,在4、24 h取上清液测OD600,根据1.2.4.2的测定方法计算共凝集率,处理数据。
1.2.6.4 pH 将离心收集的菌体用pH分别为3、5、7、9的无菌蒸馏水重悬沉淀,制备成不同pH环境下的菌悬液。调菌液OD值至0.7,单菌对照,30 ℃静止孵育,分别在4、24 h取上清液测OD600,根据1.2.4.2的测定方法计算共凝集率,处理数据。
1.2.6.5 超声处理 将菌悬液调OD600至0.7,置于100 W超声振荡器中振荡30 s,与静置组互为对照,30 ℃静置孵育,分别在4、24 h取上清液测OD600,根据1.2.4.2的测定方法计算共凝集率,处理数据。
1.2.6.6 生长期 酵母菌培养时间分别取12、24、36、48 h共4组,副干酪乳杆菌L1均培养24 h,其余条件不变,根据1.2.4.2的测定方法计算共凝集率,处理数据。
1.3 数据处理
使用SPSS 19.0软件中的ANOVA单因素方差分析及LSD多重检验,对数据进行统计处理和差异显著性分析(p<0.05),数据的表示方式为:平均值±标准差(n=3)。
2 结果与分析
2.1 酵母菌的分离纯化、筛选及形态学鉴定
从活力良好的自然发酵甘薯酸浆中,采用PDA培养基从样品中共分离出88株酵母菌,通过菌落和形态观察及参考《酵母菌的特征与鉴定手册》[13]对酵母菌进行初步鉴定,再通过测定共凝集率筛出与副干酪乳杆菌L1共凝集率最高的一株菌9#,其共凝集率为67.2%±0.12%。如图1a,该菌菌落呈乳白色,菌落表面光滑湿润,边缘整齐,椭圆微凸。图1b菌个体呈长圆形,镜检时有明显芽殖现象,图1c、图1d可见该菌与副干酪乳杆菌L1明显的黏附现象。
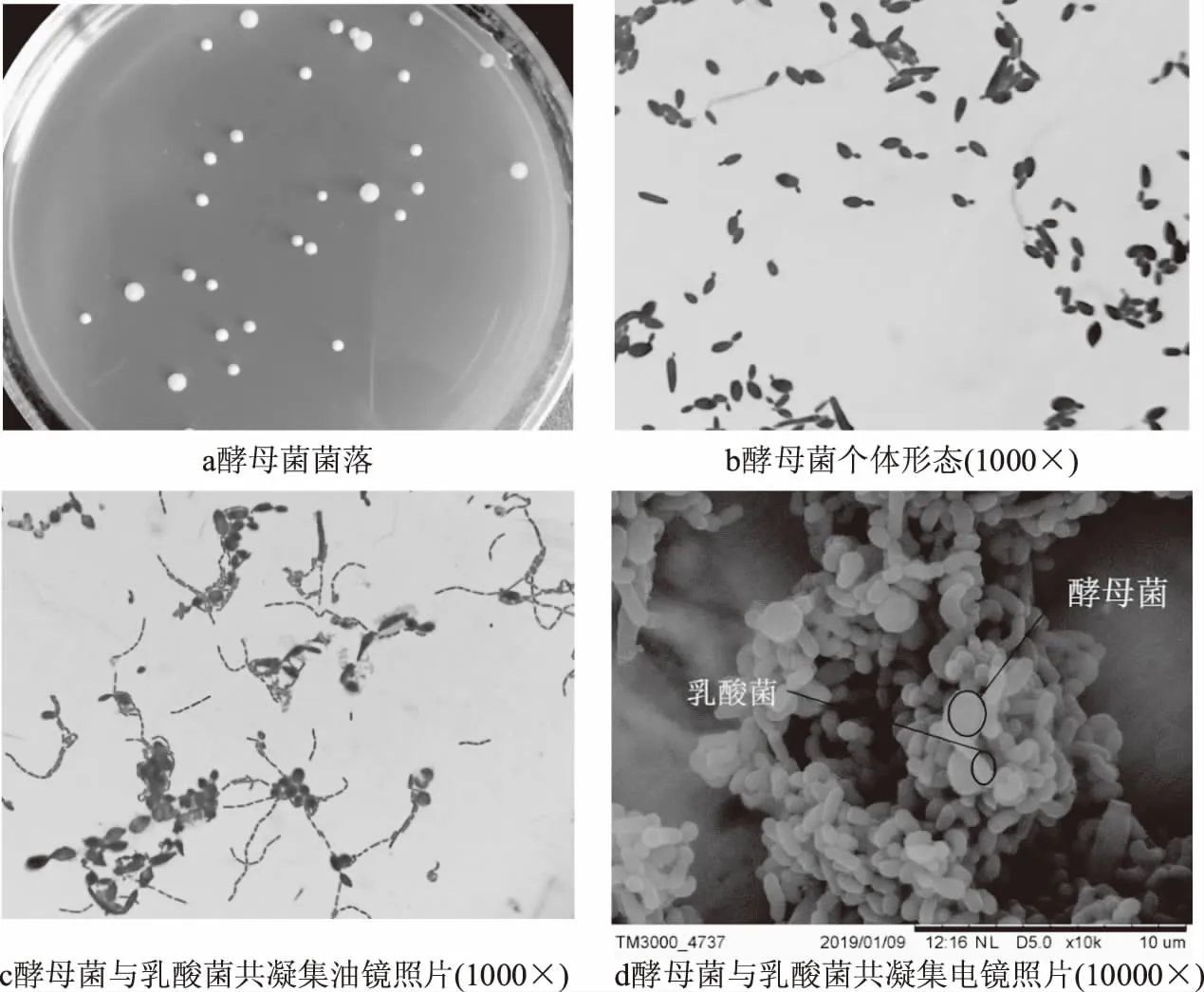
图1 9#酵母菌形态及共凝集状态
2.2 生理生化实验
同化实验反映酵母菌菌种对不同碳源和氮源的利用能力,糖发酵实验反映了酵母菌对糖的利用能力。表1可以看出,9#菌可以发酵乳糖、蔗糖、葡萄糖、果糖、麦芽糖和海藻糖,不能发酵木糖;该菌可以同化葡萄糖、果糖和蔗糖,但不能同化木糖、麦芽糖和乳糖;该菌可以同化硫酸铵、氯化铵、蛋白胨和脲。通过以上实验结果,结合《酵母菌的特征和鉴定手册》[13]可初步判断9#菌为毕赤酵母属。
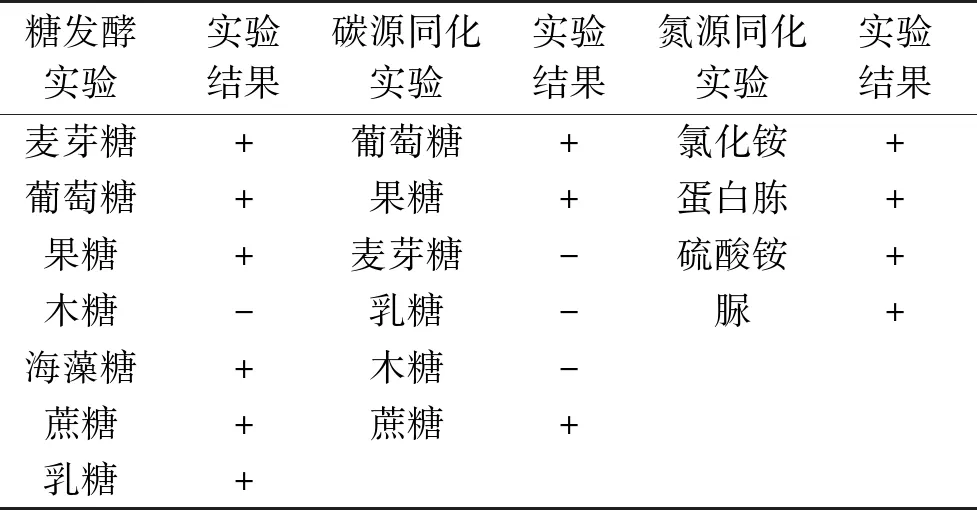
表1 9#菌与乳酸菌的糖发酵与同化能力
2.3 分子生物学鉴定
26S rDNA的PCR产物琼脂糖凝胶电泳结果如图2所示。26S rDNA的D1/D2区域位于大亚基的5′端,序列长度在600 bp左右。目前大多数酵母菌模式菌株的26S rDNA已被测定并公布,所以26S rDNA 的D1/D2区域可作为酵母菌种级水平的鉴定依据[14]。
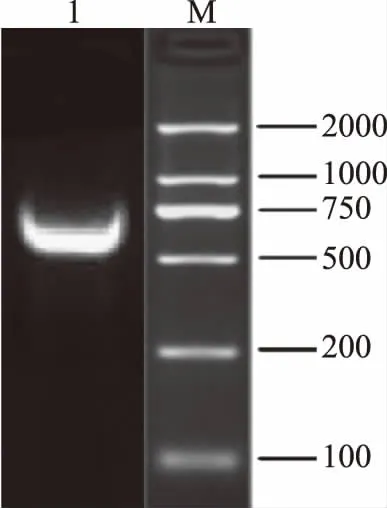
图2 PCR产物电泳图
在NCBI经Blast比对,9#菌与Meyerozymaguilliermondii相似性达到100%。利用MEGA5.0软件构建系统发育树,如图3所示。

图3 利用26S rDNA序列构建系统发育树
结合其菌体的个体、群体形态特征,生理生化实验结果及菌株的26S rDNA 分子测序结果,确定9#菌为季也蒙氏毕赤酵母(M.guilliermondii),命名为M.guilliermondiiJ616。
2.4 酵母菌与副干酪乳杆菌L1的共凝集特性
2.4.1 缓冲液对两株菌共凝集能力的影响 由图4可以看出,采用不同的缓冲液制成菌悬液后,在4 h时,蒸馏水组的共凝集率为42.5%,PBS组为41.3%,差异不显著(p>0.05),24 h后,蒸馏水组达到68.8%,而PBS组为60.2%,共凝集率显著升高(p<0.05),故无菌蒸馏水更适合做共凝集时的分散剂。造成这种结果的原因可能是PBS中的离子干扰了两株菌表面共凝集因子互相结合。与PBS相比,蒸馏水对这种作用影响不大。

图4 缓冲液对共凝集率的影响
2.4.2 孵育温度对两株菌共凝集能力的影响 由图5可知,4 h时各实验组共凝集率差异显著(p<0.05),其中35 ℃组共凝集率最高,达到52.6%,20 ℃组共凝集率最低为43.1%;24 h时不同温度条件下两株菌的共凝集率差异显著(p<0.05),35 ℃组共凝集率最高,达到72.7%,65 ℃组最低,共凝集率为58.4%。可以看出,与35 ℃组相比,高温和低温环境对共凝集均有抑制作用,这表明共凝集因子可能包含某种蛋白,环境温度对其发挥作用有重要影响。

图5 温度对共凝集率的影响
2.4.3 pH对两株菌共凝集能力的影响 由图6可以看出,在不同pH下,共凝集率变化较差异显著(p<0.05)。当pH为5.0时,无论是4 h组还是24 h组,其共凝集率都是最高的,分别为52.8%和70.4%,当pH为酸性(pH<7)时,其共凝集率高于碱性(pH>7)环境,这表明酸性环境可促进共凝集率升高。在张明[1]的研究中,副干酪乳杆菌L1在pH为5.0左右时对甘薯淀粉有较好的沉降效果,这进一步表明副干酪乳杆菌L1与淀粉絮凝的结合位点可能与酵母菌的共凝集因子有某种联系,但其详细的作用机理仍需深入研究。
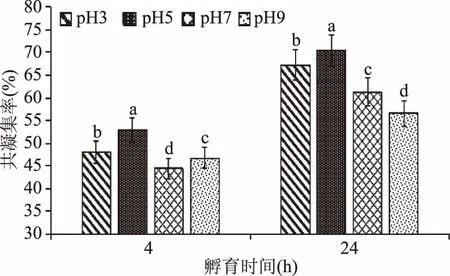
图6 pH对共凝集率的影响
2.4.4 超声处理对两株菌共凝集能力的影响 超声处理的目的是将两株菌的细胞在悬浮液打散,使其分布得更加均匀。由图7可以看出,超声处理后两株菌共凝集率普遍提高,且4 h组和24 h组都差异显著(p<0.05),超声处理条件下孵育时间24 h时,两株菌共凝聚率为74.8%。这说明超声处理后,两种共凝集菌细胞可以充分接触,使得共凝集更为强烈。
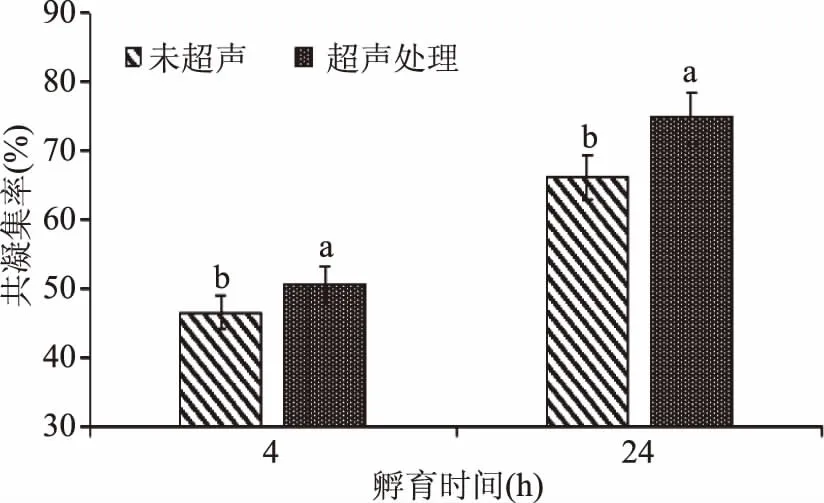
图7 超声处理对共凝集率的影响
2.4.5 生长期对两株菌共凝集能力的影响 由图8可以看出,不同生长期的酵母菌对共凝集率的影响4 h组和24 h组差异都不显著(p<0.05)。不同生长期的酵母菌与副干酪乳杆菌L1共同孵育后,4 h后共凝集率稳定在47%左右,24 h后共凝集率稳定在70%左右。这说明不同时期的酵母菌并没有影响共凝集的强度,这与王海超[15]的研究结果一致,表明了酵母菌在不同时期的代谢产物没有参与到共凝集反应中,其参与共凝集反应的物质结构基础不是随菌体生长时期的变化而产生的,而是和菌体生长呈平行关系,遗传稳定性大。
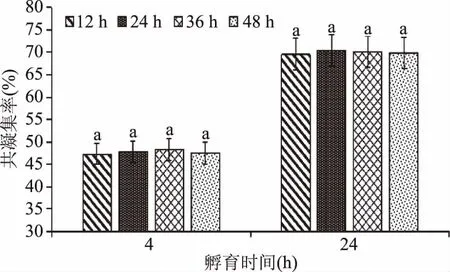
图8 生长期对共凝集率的影响
3 结论
本研究在自然发酵的甘薯酸浆中,采用PDA固体培养基平板涂布法分离、纯化,筛选出一株促进副干酪乳杆菌L1絮凝淀粉的酵母菌。经生理生化实验和26S rDNA分子测序鉴定,确定该酵母菌为季也蒙氏毕赤酵母(Meyerozymaguilliermondii),并命名为M.guilliermondiiJ616。以副干酪乳杆菌L1与M.guilliermondiiJ616共凝集率为指标,确定了孵育前用无菌蒸馏水作缓冲液、超声分散处理,孵育pH为5、温度为35 ℃,这四种因素均可促进M.guilliermondiiJ616与副干酪乳杆菌L1共凝集。但不同生长期的酵母菌对共凝集没有显著影响。这为研究乳酸菌与酵母菌之间的相互作用关系提供理论依据,并为微生物絮凝剂的开发提供技术参考。

