Lager啤酒酵母RLM1基因调控对其抗自溶性能的影响
王金晶,李梦琦,侯丹,许维娜,郑飞云,刘春凤,钮成拓,李崎
Lager啤酒酵母基因调控对其抗自溶性能的影响
王金晶1,2,李梦琦1,2,侯丹1,2,许维娜1,2,郑飞云1,2,刘春凤1,2,钮成拓1,2,李崎1,2
1 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122 2 江南大学 酿酒科学与工程研究室,江苏 无锡 214122
啤酒酵母的自溶会严重影响啤酒的品质,而酵母的质量也被认为是啤酒酿造的关键因素之一。前期在啤酒酵母自溶的研究中发现细胞完整性途径中重要的转录因子基因与酵母自溶有密切关系。本研究在啤酒酵母单倍体菌株中对进行敲除与过表达,发现敲除后,酵母菌抗自溶性能差,而过表达则有助于酵母的抗自溶。另外,发现基因的敲除影响了酵母的抗渗透压性能、细胞壁损伤的耐受性、抗氮饥饿性能和温度耐受性。研究发现细胞壁组装及DNA损伤应答相关基因的表达随的过表达与敲除而调整,而CWI途径中其他相关基因的调控方式并没有明显的规律,推测可能主要影响了CWI途径中基因的表达,进而提高啤酒酵母在恶劣环境中的抗逆性。此研究结果对于进一步选育抗自溶啤酒酵母以及了解啤酒酵母的自溶机制提供了基础。
lager啤酒酵母,抗自溶性能,,细胞壁完整性
环境胁迫一直是发酵工业中最普遍且不容忽视的问题之一。酵母是饮料工业中常用的菌种之一,也被认为是啤酒酿造的关键因素之一。啤酒发酵过程中,酵母细胞在多次胁迫下会发生自降解,这种自降解过程通常发生在啤酒的后酵期,对啤酒的品质有显著影响[1]。啤酒酿造过程中如有超过5%的酵母细胞自溶就会对啤酒风味、泡沫稳定性、胶体稳定性造成影响并可能带来微生物污染的危害[2]。
啤酒发酵后期发生的酵母自溶主要是由营养缺乏、应激反应以及酒精压力引起的。细胞壁是细胞的第一道防线,对环境中的不利因素作出反应。细胞壁完整性 (Cell wall integrity,CWI)、细胞壁的组织和生物合成主要由该通路负责[2-3]。以CWI通路激活为主导的细胞转录重编程将细胞从各种应激条件下解救出来。酵母细胞壁上存在压力传感因子,包括Mtl1、Mid2、Wsc1、Wsc2以及Wsc3,当这些因子感受到压力时,触发了丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK) 级联反应,在细胞内进行全局转录调控进而形成不同的应激反应来维持酵母细胞的生存[3-4]。在CWI通路下游,Slt2磷酸化后激活包括Swi4/Swi6和Rlm1[5]在内的转录因子。据报道,Slt2和Rlm1是密切相关的,在细胞壁受到损伤时,Rlm1传导了大多数依赖于Slt2的转录激活作用,同时,CWI途径与其他信号通路的转录因子之间存在的连接也必须通过Rlm1依赖的通路进行调控[6]。此外,最近的研究显示,基因参与了乙酰转移酶 (Spt-Ada-Gcn5-acetyltransferase,SAGA) 复合物对细胞壁应激反应的转录调控,敲除将导致CWI通路失活[4]。
自溶过程中,啤酒酵母细胞逐渐丧失生存能力,许多与应激反应相关的基因受到调控,以适应环境的变化。酵母细胞壁结构和形态将逐渐改变以应对环境中的胁迫压力[1,7]。前期研究发现在酵母自溶过程中,CWI途径中的压力传感因子编码基因包括和表达水平下调,而CWI途径中和表达水平发生上调[8]。同时,具有较强抗自溶能力的酵母细胞表现出刚性的细胞壁结构和较强的抗应激能力[9]。虽然转录因子Rlm1在CWI通路中的作用在酿酒酵母中已有相关的报道,但是其在啤酒酵母抗自溶方面的研究尚少,同时,啤酒酵母由于其遗传背景的复杂性表现出与酿酒酵母不同的发酵及生理特性[10-11]。因此,本研究对lager型啤酒酵母菌中的进行调控,研究其对啤酒酵母抗自溶能力的影响及作用机制。
1 材料与方法
1.1 材料
1.1.1 菌种和培养基
菌株H5为本研究室保藏的啤酒酵母单倍体菌株;克隆扩增质粒pMD19-T simple及大肠杆菌宿主菌JM109均购于TaKaRa公司;质粒pUG6为本研究室保藏[12]。
LB培养基 (1 L):10 g蛋白胨,5 g酵母抽提物,10 g NaCl,pH 7.4,固体培养基添加20 g琼脂粉,121 ℃灭菌20 min[12]。含有氨苄青霉素的抗性培养基终浓度为100 μg/mL。
YPD培养基 (1 L):10 g酵母抽提物,20 g蛋白胨,20 g葡萄糖,pH 6.0,115 ℃灭菌15 min。含有G418的抗性培养基终浓度分别为200 μg/mL、300 μg/mL和400 μg/mL。含有NaCl的抗性培养基的浓度为1 mol/L。米卡芬净抗性培养基终浓度为30 ng/mL。Calcofluor white抗性培养基终浓度为10 μg/mL。
YNB-N培养基 (1 L):1.7 g无氨基酸无硫酸铵酵母氮源,20 g葡萄糖,固体培养基添加20 g琼脂粉,115 ℃灭菌15 min[12]。
1.1.2 试剂
质粒抽提试剂盒、大肠杆菌感受态制备试剂盒、限制性内切酶及连接酶购自TaKaRa公司;YNB合成培养基、蛋白抽提试剂盒、溶菌酶购自生工生物工程 (上海) 股份有限公司;Fluorescentbrightener 28 (Calcofluor white) 购自Sigma-Aldrich公司;米卡芬净购自上海灏云药业。
1.2 主要方法
1.2.1基因的敲除与过表达
根据酿酒酵母的序列设计引物RLM1-F/RLM1-R扩增啤酒酵母基因,测序后以所测的序列设计中断引物RLM1-LF/RLM1-LR。各引物如表1所示。以pUG6质粒为模板,RLM1-LF/RLM1-LR为引物用短侧翼序列PCR介导的一步法 (SFH-PCR)扩增带有上下游同源臂的基因,DNA片段经纯化后进行测序,构建成功后被用于转化啤酒酵母单倍体菌株H5,转化子涂布于新鲜的YPD平板,24 h后影印至含有200 μg/mL的G418抗性平板上,28 ℃培养48 h,挑取阳性转化子进行菌落PCR验证,获得敲除菌株。

表1 构建菌株所用引物
以基因组DNA为模板,以通用引物EF3、EF4扩增啤酒酵母18S rDNA序列,测序后设计引物扩增其上下游各200 bp左右的片段作为同源臂。通过PCR获得启动子与目的基因,同时以pUG6为模板,PCR获得抗性基因,表1为基因扩增所用引物及相应的酶切位点。将上述片段以TA克隆的方式连接至pMD19-T simple质粒上,经Ⅰ和Ⅰ双酶切后线性转化至H5。在G418抗性平板上挑选阳性菌落并进行菌落PCR验证,获得过表达菌株。根据G418抗性的强弱筛选高拷贝数的过表达菌株[12]。挑取阳性转化子接种至10 mL YPD培养基中,28 ℃、200 r/min振荡培养12 h,3 000 ×离心5 min,收集菌体并在无菌生理盐水中重悬,调节菌体浓度至600=1.0,梯度稀释后点滴至G418浓度为200 μg/mL、300 μg/mL及400 μg/mL的抗性平板上[12]。28 ℃培养48 h,观察菌株的生长状况,最终筛选获得含有高拷贝数的过表达菌株。
1.2.2 Rlm1蛋白的SDS-PAGE分离及质谱鉴定
将出发菌株H5和过表达菌株在5 mL YPD培养基中28 ℃、200 r/min振荡培养12 h,后将菌液全部转接至50 mL YPD培养基,28 ℃振荡培养3–5 h,至菌液浓度为600=1.0–1.5,3 000×离心5 min,弃上清收集菌体,用PBS缓冲液清洗 3次,再用Tris-HCl缓冲液重悬菌体,加入蛋白酶抑制剂复合物,超声破碎提取蛋白质[12-13]。Rlm1是核蛋白,因此本研究采用细胞核蛋白/浆蛋白抽提试剂盒同时抽提细胞质蛋白和核蛋白。将蛋白样品与上样缓冲液混合,沸水浴5 min后上样,进行SDS-PAGE检测。将目的条带切下并进行MALDI-TOF-TOF/MS分析,鉴定其是否为目的蛋白Rlm1[12]。
1.2.3 抗自溶指数测定
参考前期研究的酵母抗自溶指数检测方法,抗自溶指数为 (260/280)/死亡率,跟踪测定出发菌H5、基因敲除菌株及过表达菌株的260、280和死亡率,计算获得抗自溶指数来表征各菌株的抗自溶性能[14]。
1.2.4 胁迫耐受性分析
将H5、基因敲除菌株和过表达菌株培养12 h后离心收集菌体,重悬于无菌水中,分别取样点滴至NaCl抗性平板、荧光增白剂抗性平板和米卡芬净抗性平板,同时1 000倍稀释后涂布于YNB-N平板,分析其对渗透压、细胞壁损伤和氮饥饿的抗性;再将菌液点样于YPD平板,在22 ℃、28 ℃、37 ℃和42 ℃培养,检测其对温度的耐受性。
1.2.5 啤酒发酵实验
取一环保藏的斜面菌转接至 10 mL 12°P麦汁试管中,于 28 ℃下活化24 h,后以1%的接种量转接至含有70 mL 12°P麦汁的三角瓶中于25 ℃培养48 h,按2×107CFU/mL酵母细胞浓度转接至含2 L 12°P麦汁的3 L带发酵栓的锥形瓶中,11 ℃发酵5 d。主酵结束后收集发酵液及酵母细胞进行理化指标分析。
1.2.6 细胞形态学分析
发酵结束后,收集酵母细胞,使用5%戊二醛 (0.1 mol/L磷酸缓冲液,pH 7.2) 进行前固定,之后使用0.1 mol/L磷酸缓冲液漂洗酵母细胞,用1%锇酸 (0.1 mol/L磷酸缓冲液,pH 7.2) 进行后固定,再用0.1 mol/L磷酸缓冲液漂洗,乙醇梯度脱水,样品进行临界点干燥后转载至样品台上,离子溅射仪镀膜后置于扫描电子显微镜下观察其细胞形态[13],醋酸双氧铀和柠檬酸铅染色后进行超薄切片,置于透射电子显微镜下观察[13-14]。
1.2.7 qRT-PCR分析
收集酵母细胞重悬于无菌水中,用试剂盒提取总RNA并按TaKaRa公司反转录试剂盒PrimeScript RT reagent Kit进行反转录,获得的cDNA保存待用。使用TaKaRa公司的SYBR Premix Ex试剂盒和Roche Light Cycler 480 Ⅱ PCR扩增仪 (Roche Diagnostics) 对CWI途径中关键基因进行qRT-PCR检测[13],条件如下: 95 ℃预变性30 s;变性95 ℃ 5 s,退火/延伸55 ℃ 20 s,循环40次;95 ℃ 10 s,65 ℃ 1 min,95 ℃ 10 s。每个样品3个平行,取平均值作为计算的基础。
2 结果与分析
2.1 RLM1基因的敲除及过表达
用引物RLM1-F/RLM1-R以啤酒酵母单倍体菌株H5的基因组DNA为模板,PCR扩增目的基因。产物纯化后测序,测序结果表明,啤酒酵母H5的序列长度为2 043 bp[14],与NCBI公布的酿酒酵母S288c的相似性达到98%。根据H5的基因序列设计中断引物RLM1-LF/RLM1-LR,同时以pUG6质粒为模板扩增,构建基因中断盒[12],总长度为1 704 bp。片段线性化后转化啤酒酵母单倍体菌株H5,在含有200 μg/mL G418的YPD平板上筛选获得阳性转化子,并进行PCR验证,结果如图1A所示。出发菌H5应获得大小为2 043 bp的片段,阳性转化子应获得1 704 bp的片段,结果与预期相符,最终得到基因敲除菌命名为HΔ。
将18S rDNA上游同源臂、启动子目的基因抗性基因18S rDNA下游同源臂依次连接至pMD19-T simple上,构建过表达载体。获得的质粒经Ⅰ和Ⅰ双酶切后转化至啤酒酵母单倍体菌株H5,与H5基因组中18S rDNA发生同源重组,替换原有片段,采用影印法筛选阳性转化子,目的基因拷贝数的高低以重组菌G418抗性的强弱来表征。即G418抗性强的重组菌,其拷贝数高,对应的拷贝数也高[12,15]。过表达所获得的阳性重组菌影印至浓度为200、300、400 μg/mL的G418抗性平板上。结果发现,重组菌最高能耐受400 μg/mL G418,28 ℃培养48 h后,在含有400 μg/mL G418的抗性平板上挑选生长情况较好的菌株进行PCR验证,分别以Up-1-F和Up-1-R、Up-2-F和Up-2-R、Down-1-F和Down-1-R作为引物,以H5为对照。目标片段大小应为 964 bp、944 bp及856 bp,结果 (图1A) 与预期相符。同时,提取筛选获得的过表达菌株的细胞核蛋白和细胞质蛋白进行SDS-PAGE检验,结果如图1B所示。目的条带被切下后进行MALDI- TOF-TOF/MS分析,其中得分最高的蛋白质为Rlm1 (登录号gi|6325168),说明基因在重组菌中得到了过表达[12],将获得的过表达菌株命名为H/。
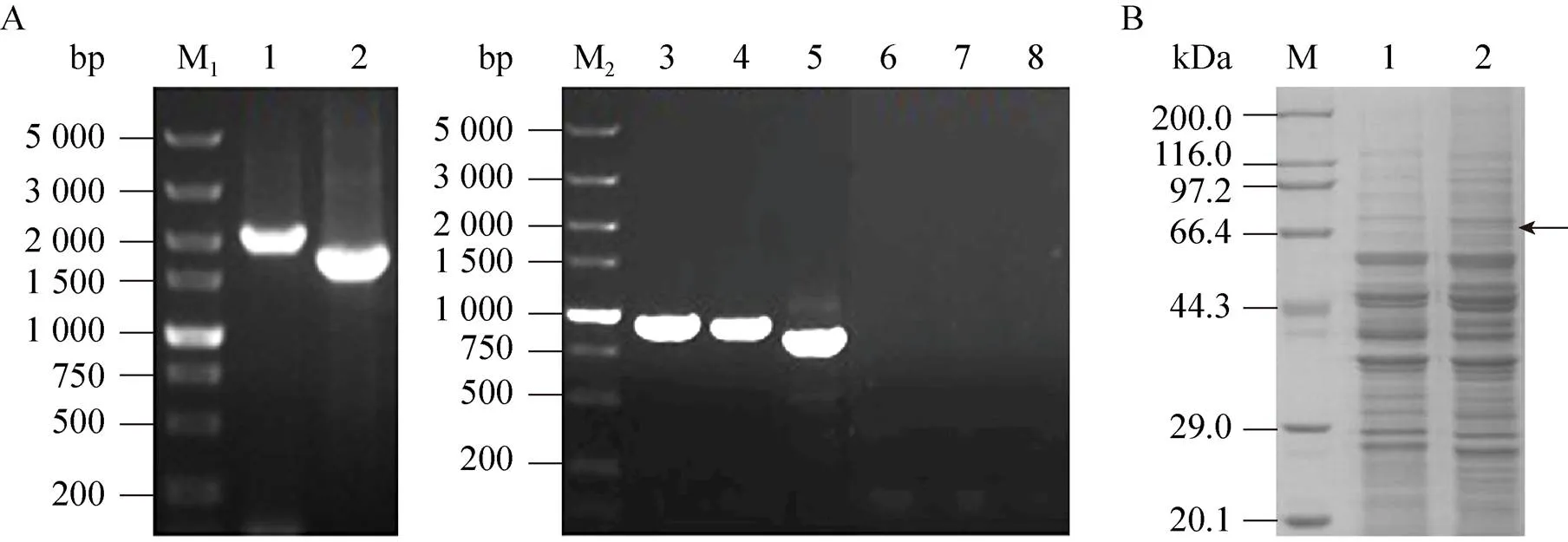
图1 重组菌H-rlm1Δ及H/rlm1的构建及验证
2.2 RLM1基因调控对菌株抗自溶性能的影响
啤酒酵母对于啤酒的酿造至关重要,啤酒优良的风味主要是由其代谢产物产生,而啤酒酵母在发酵后期发生的自溶会导致细胞内容物的渗漏和溶出,这是啤酒中杂异味的主要来源。在有些情况下,例如在贮酒期间环境压力大、代谢产物积累和营养物质枯竭等,啤酒酵母在短时间内发生大量的自溶,对啤酒的质量造成剧烈的影响。具有较好抗自溶能力的啤酒酵母将对啤酒的风味有积极的贡献。
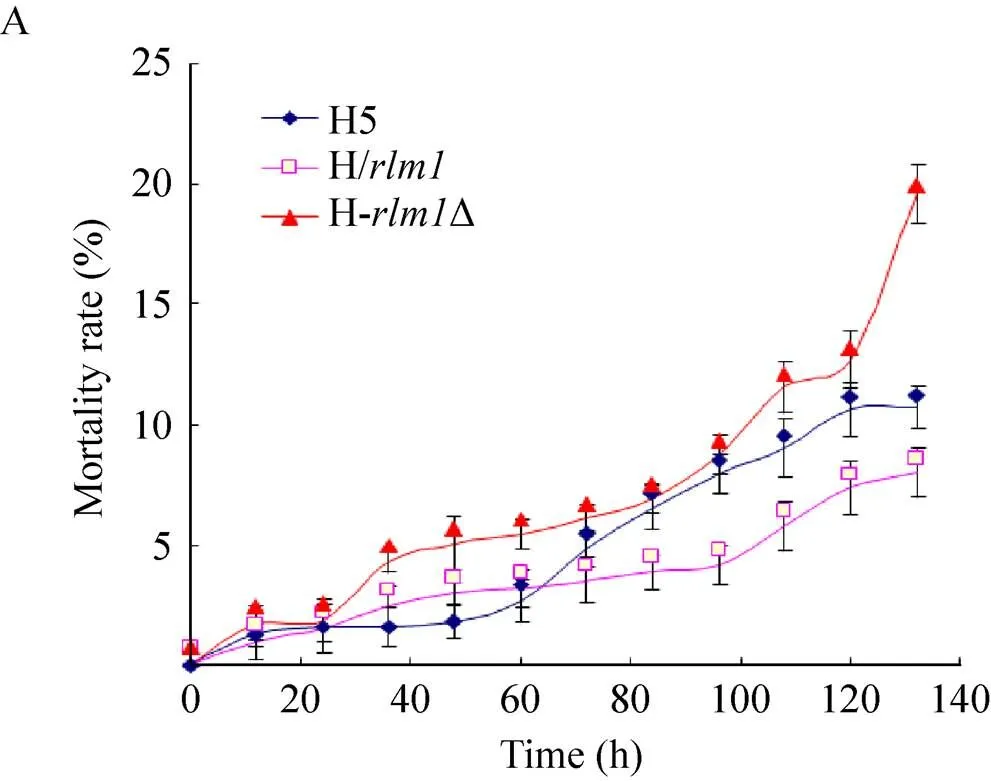
将H-Δ、H/与H5培养至稳定期后期,收集酵母泥,用柠檬酸缓冲液洗涤2–3遍,每100 mL缓冲液中加入1 g酵母泥,30℃下进行模拟自溶,跟踪260、280和死亡率的数值[12],计算抗自溶指数,各酵母的抗自溶能力以抗自溶指数来表征[14]。图2为3株菌的抗自溶指数和死亡率的比较结果。敲除菌H-Δ死亡速度最快,抗自溶指数数值相对最低,表明其自溶程度高,抗自溶性能差。开始时,H/死亡速度快于H5,但随后逐渐减慢,可发现其抗自溶指数高于H5,表明其抗自溶性能较好。
前期研究中发现在不同酵母及不同自溶态下的转录水平各异,抗自溶性能好的酵母中的转录水平较高,而抗自溶性能差的酵母中的转录水平较低[8,12]。本研究结果也进一步印证了前期研究的结果,同时可以推断的敲除影响了啤酒酵母的抗自溶能力,而高表达量的可以减缓自溶的进程。
2.3 RLM1基因调控对菌株胁迫耐受性的影响
2.3.1 渗透压及细胞壁损伤耐受性分析
在含有1 mol/L NaCl的YPD平板上对H5、HΔ和H/进行点样分析,于28 ℃培养48 h后观察其生长情况,检测各菌株对渗透压的耐受性,结果如图3所示。H/对渗透压的抗性稍强于出发菌H5,而HΔ对渗透压的抗性明显弱于出发菌H5[12]。

图3 重组菌与原始菌对渗透压及细胞壁损伤耐受性分析
米卡芬净 (Micafungin) 能够非竞争性抑制酵母细胞壁必需成分β-1,3-葡聚糖的合成,是葡聚糖合成酶的抑制剂[9],可导致细胞壁合成的缺陷。荧光增白剂 (Calcofluor white) 能够与细胞壁组分几丁质结合,细胞壁有破损的细胞会对荧光增白剂敏感[17]。米卡芬净和荧光增白剂均能造成细胞壁压力,进而引起细胞壁的损伤。将H5、HΔ和H/分别点滴至含有30 ng/mL米卡芬净和含有10 μg/mL荧光增白剂的抗性平板上[12],在28 ℃条件下培养48 h,观察其生长情况,评价各菌株对细胞壁损伤的耐受性情况。结果如图3所示,HΔ对米卡芬净和荧光增白剂均比较敏感,特别在荧光增白剂平板上,其生长被强烈抑制。H/对米卡芬净的抗性与H5类似,但H/对荧光增白剂的抗性略强于H5。结果表明的缺失严重影响了细胞对几丁质相关的细胞损伤的抗性。
2.3.2 温度耐受性分析
在YPD平板上进行H5、HΔ和H/进行点样,分别放置于22 ℃、28 ℃、37 ℃和42 ℃环境中培养,检验其对温度的耐受性情况。三株菌在42 ℃均不能生长 (结果未展示),如图4所示HΔ在低温 (22 ℃) 和高温 (37 ℃) 下的生长能力与H5相比略有下降,H/的生长状态与H5相当,说明敲除后菌株对温度的耐受性受到一定的影响。另外,lager型啤酒发酵温度一般在11 ℃左右,因此考察了3株菌在11 ℃条件下的生长能力,在低温胁迫的情况下,H-Δ生长能力稍差一些,但没有明显的区别。
2.3.3 氮饥饿耐受性分析
将H5、HΔ和H/菌液稀释后涂布于YNB-N平板,28 ℃培养48 h,检测各菌株对氮饥饿的耐受性情况。菌落计数结果为H5菌落数为70±5,HΔ菌落数为21±4,H菌落数为92±7。从饥饿抗性来看,H/强于H5,而H-Δ明显弱于H5,结果表明表达对菌株的氮饥饿耐受性起到了增强作用。
2.4 RLM1基因调控对菌株发酵性能及抗自溶性能的影响
将重组菌与原始菌用于啤酒发酵试验,在主发酵结束时,测定了发酵液的几个主要参数,以评价不同菌株的发酵能力。如表2所示,从发酵度和真实浓度来看,不同菌株的发酵能力相当,主要风味化合物包括双乙酰、乙醛、乙酸乙酯、乙酸异戊酯、异戊醇、异丁醇和双硫醚 (DMS) 含量也没有太大的差别,在正常发酵过程中,健康的酵母不会发生自溶,细胞内蛋白酶也不会水解自身物质,主酵结束后对发酵液相关指标的测定结果表明基因调控对啤酒酵母的发酵能力及啤酒的主体风味没有直接的影响。
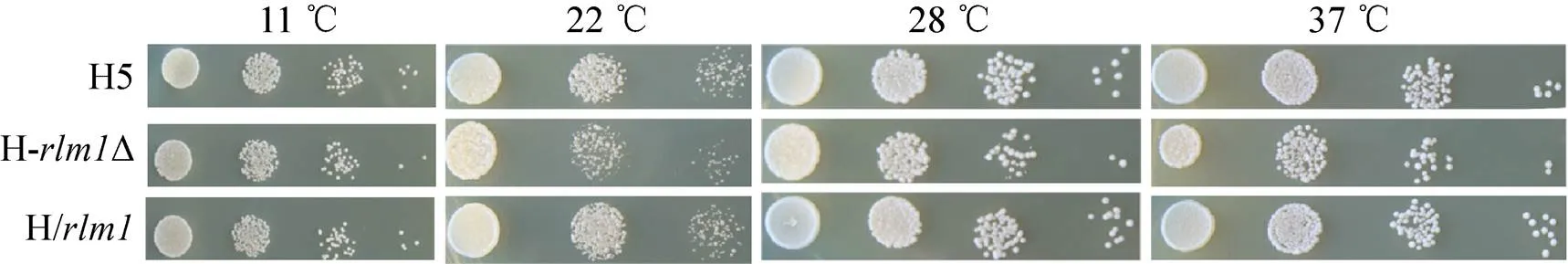
图4 重组菌与原始菌对温度耐受性的比较
表2 啤酒发酵液指标分析
为了解释不同菌株抗自溶能力的差异,收集发酵后细胞进行了扫描电镜 (SEM) 及透射电镜 (TEM) 分析。如图5所示,与H5相比,H/细胞体积略变小,呈椭圆形,H-Δ细胞体积略大,且在发酵后更容易表现出皱缩及内凹的形态。与原始菌株比较,的敲除可能影响酵母细胞的大小及在发酵过程中的耐受性。但是,比较不同菌株的生长曲线,3个菌株之间没有显著的差异。因此,推测基因修饰导致了啤酒酵母的形态改变。同时,啤酒发酵结束后收集3株菌进行透射电镜分析,结果与SEM结果吻合。H5细胞核区完整,胞质液泡大 (图6A)。在H/细胞发现液泡变小且分散 (图6B–C),H-Δ细胞中则发现了逐渐的染色质凝聚和核区的分散 (图6D–E)。基因敲除的菌株中明显出现了细胞损伤和衰老的现象。
Rlm1是CWI途径中重要的转录因子,对其编码基因的调控可能直接影响细胞完整性途径中其他基因的表达。分析了发酵开始与结束时与CWI通路和细胞壁构建相关的基因 (包括、、、、、、、、、、、、、、、、、、、、、)[17-18]的相对mRNA水平,其中许多基因在调节啤酒酵母的自溶过程中起着重要作用。结果发现,H/中与CWI途径相关的基因在啤酒发酵结束时大部分发生上调 (图7),上调最多的基因为,该基因涉及细胞壁组装[19]和DNA损伤应答[20],其表达水平较啤酒发酵开始时上调了12.75倍。而据报道参与细胞壁合成的上调了6.29倍。、、、、、、、、、在H/中表达相对上调,其他基因的调控不明显。在H5菌株中也发现了类似的调控模式,尽管的上调并不充分。然而,与H/相比,H5中基因没有发现明显的调控。另一方面,大部分基因的调控在H-Δ中发生下调,基因表达也发生明显下调,而和基因表达上调。是与细胞核的稳定性及细胞形态相关的基因[21],该基因在H-Δ发生了明显上调 (11.76倍)。细胞在发酵过程中受到损伤时,基因可能发生上调以维持细胞的形态稳定。与发酵开始时相比,转录辅助因子Swi6编码基因的表达水平上调了7.45倍。、等细胞壁应激传感基因[22]在3株菌中均呈现相似的调控水平。

图5 H5 (A)、H/rlm1 (B)及H-rlm1Δ (C)的扫描电镜图(×8 000)
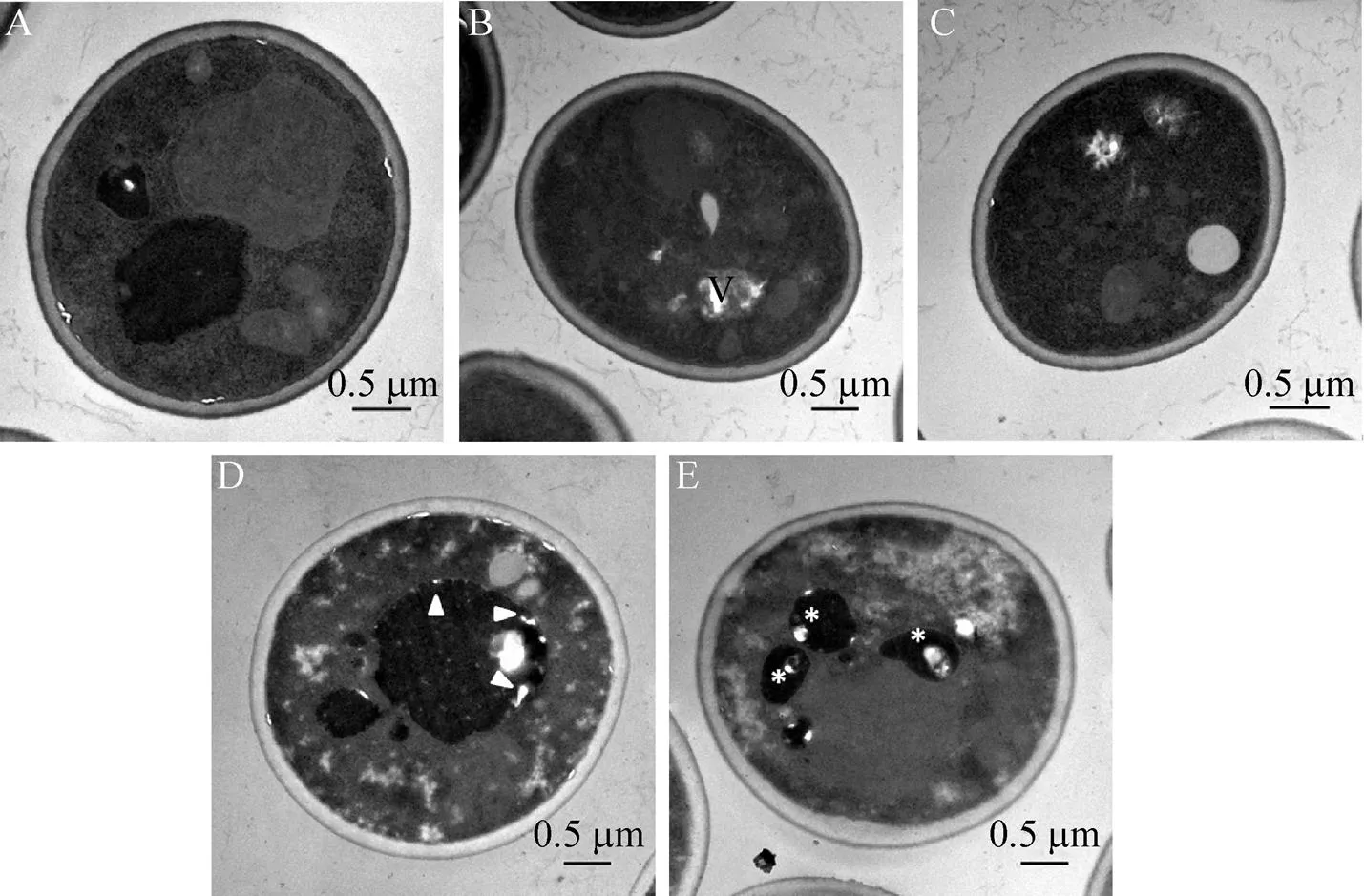
图6 H5(A)、H/rlm1 (B、C)及H-rlm1Δ (D、E)的透射电镜图(×25 000)
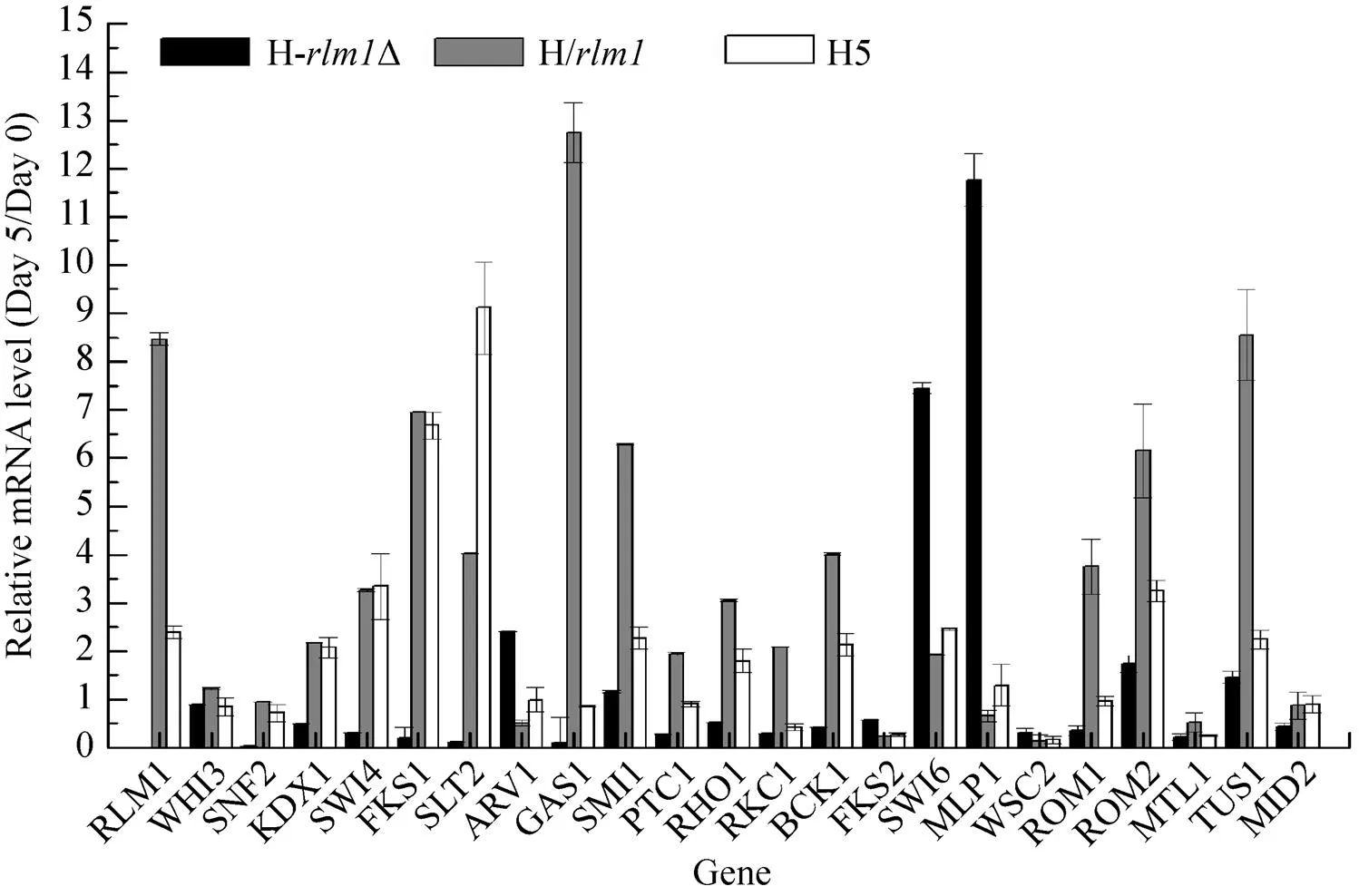
图7 H5、H-rlm1Δ和H/rlm1中细胞壁完整性途径相关基因调控水平分析
3 讨论
在工业生产中,由于受到成本的限制,啤酒酵母需要被重复使用,酵母的自溶一般会发生啤酒发酵的后酵期以及在多次反复回用之后,目前国内大多数啤酒厂的啤酒酵母大多使用代数为 5代,第5代之后的酵母的生理性能发生大幅度下降,自溶率显著增加,造成酿造的啤酒的品质与风味受到极大的影响。而国际上优质的啤酒酵母一般可使用至15代。国内啤酒厂常用的啤酒酵母在传代使用过程中,大部分啤酒酵母在使用至第3代时不会立即出现自溶的现象,而第4代及第5代发酵结束后,抗自溶性能较弱的酵母细胞就会出现明显的自溶现象[16]。啤酒酵母抗自溶性能的提高能够有效地增加酵母的回用次数,进一步提高生产效率,降低成本。酵母细胞的应激反应被认为是一种进化适应,使酵母能够对不利的环境条件作出反应,并保持细胞的繁殖力。研究表明转录因子Rlm1参与了MAPK通路和细胞壁完整性 (CWI) 途径的激活[23],其编码基因是Mpk1在CWI通路下游的功能基因,也参与了细胞壁完整性的维护。如前所述,基因在酵母中表达不同,其在抗自溶能力较强的啤酒酵母菌中表达水平较高,而在抗自溶能力较弱的啤酒酵母菌中表达水平较低[8]。
自溶过程中,细胞逐渐丧失生存能力,电子运输、戊糖-磷酸盐途径、脂肪酸氧化、糖原分解代谢、海藻糖合成代谢、呼吸代谢等大部分能量的产生和利用也都受到干扰[24]。在之前的研究中,我们发现25个基因在酵母自溶过程中对细胞的拯救、防御和毒性起作用,其中12个基因下调,13个基因上调。下调和上调的基因均参与了抗氧化应激、渗透压、化学刺激、热休克、DNA损伤、pH和饥饿等应激反应[8]。在酵母自溶过程中,、、、、等基因被发现可能有重要的作用[2]。CWI通路是负责细胞壁组织和生物合成的主要系统,在细胞壁应激反应时,转录因子Rlm1被招募到和基因的启动子上,激活这两个基因启动细胞的转录重编程[4,25-26]。基因的敲除可能导致产生了细胞壁缺陷从而引起了H-Δ细胞对米卡芬净及荧光增白剂抗性的减弱。该基因作为参与CWI激活自调节反馈环的重要基因[25],其破坏导致反馈环的破坏,进而影响在细胞壁损伤应力下的表达。啤酒酵母在自溶过程中会迅速丧失生存能力,同时激活一系列应激反应对细胞进行改造以适应环境[1]。前期研究中从两个不同自溶阶段的啤酒酵母菌株的蛋白质二维凝胶电泳谱可以清楚地发现,在自溶过程中发现了蛋白质的大规模降解以及蛋白质数量的下降,同时也出现了一些新的蛋白质[2],结合转录组学数据我们推测啤酒酵母细胞对其基因组进行了大量的重编程以响应环境变化[8]。酵母细胞作为一种动态变化的结构,在生长和发酵过程中通过氧化剂应激、渗透应激、乙醇应激、饥饿应激等多种应激反应系统来调节细胞壁的组成和结构[1,7,23]。细胞壁完整性通路调节酵母细胞使其在恶劣的环境中能够遵循严格的规律来维持其细胞结构的完整。
酵母在酿造工业中应用广泛,啤酒酵母更是被认为是啤酒发酵的核心。对啤酒酵母的基因组测序工作证实了其杂交的本质[11,27-28],由于长期的种内及种间的杂交,啤酒酵母的倍性出现了非整倍体等特征,直接对其进行遗传改造很难清楚地了解某个基因的功能。本研究所采用的啤酒酵母单倍体菌株H5是从中国啤酒厂广泛使用的lager型啤酒酵母菌株中选育而来的,具有一定的代表性。在单倍体啤酒酵母菌株中研究基因的功能,能够直观地了解该基因在啤酒酵母菌中的功能及基因调控对啤酒酿造的影响。基因修饰虽然不影响菌株的生长和发酵性能,但仍然影响酵母菌株的应激反应,导致啤酒发酵结束后菌株细胞形态差异较大。啤酒酵母细胞在发酵过程中经历了多种压力胁迫交替出现的历程,如高渗透压胁迫、乙醇胁迫、营养消耗、罐体压力等[1,7],所有这些压力都会导致细胞的损伤和老化。基因的缺失可能加速了衰老过程,发酵过程结束后也发现了胞内细胞器的损伤。研究发现细胞壁组装及DNA损伤应答相关基因的表达随的过表达与敲除而调整,而CWI途径中其他相关基因的调控方式并没有明显的规律,推测可能主要影响了CWI途径中基因的表达,进而提高啤酒酵母在恶劣环境中的抗逆性。
本研究基于同源重组的方法对进行敲除和过表达,获得了重组菌H-Δ和H/。研究了重组菌在啤酒发酵过程中的抗自溶性能,发现敲除影响了酵母的抗自溶能力。敲除了使啤酒酵母对细胞壁损伤、氮饥饿、渗透压的耐受性以及温度的敏感性受到影响[14]。结合qRT-PCR发现CWI途径中与涉及细胞壁组装和DNA损伤应答的在过表达时显著上调。对基因的调控能够影响酵母的抗自溶能力,为选育抗自溶能力高的啤酒酵母菌株提供参考依据。
[1] Gibson BR, Lawrence SJ, Leclaire JP, et al. Yeast responses to stresses associated with industrial brewery handling. Fems Microbiol Rev, 2007, 31(5): 535–569.
[2] Xu WN, Wang JJ, Li Q. Comparative proteome and transcriptome analysis of lager brewer’s yeast in the autolysis process. FEMS Yeast Res, 2014, 14(8): 1273–1285.
[3] Rodicio R, Heinisch JJ. Together we are strong-cell wall integrity sensors in yeasts. Yeast, 2010, 27(8): 531–540.
[4] Sanz AB, Garcia R, Rodriguez-Peña JM, et al. Cooperation between SAGA and SWI/SNF complexes is required for efficient transcriptional responses regulated by the yeast MAPK Slt2. Nucleic Acids Res, 2016, 44(15): 7159–7172.
[5] Watanabe Y, Irie K, Matsumoto K. Yeast rlm1 encodes a serum response factor-like protein that may function downstream of the Mpk1 (slt2) mitogen-activated protein kinase pathway. Mol Cell Biol, 1995, 15(10): 5740–5749.
[6] García R, Bermejo C, Grau C, et al. The global transcriptional response to transient cell wall damage inand its regulation by the cell integrity signaling pathway. J Biol Chem, 2004, 279(15): 15183–15195.
[7] Gibson BR, Lawrence SJ, Boulton CA, et al. The oxidative stress response of a lager brewing yeast strain during industrial propagation and fermentation. FEMS Yeast Res, 2008, 8(4): 574–585.
[8] Xu WN, Wang JJ, Li Q. Microarray studies on lager brewer's yeasts reveal cell status in the process of autolysis. FEMS Yeast Res, 2014, 14(5): 714–728.
[9] Li XE, Wang JJ, Li Q. Screening and RT-PCR analysis of stress resistant brewing yeast. Food Ferment Ind, 2014, 40(8): 18–23 (in Chinese). 李欣儿, 王金晶, 李崎. 压力耐受啤酒酵母的筛选及其RT-PCR研究. 食品与发酵工业, 2014, 40(8): 18–23.
[10] Wendland J. Lager yeast comes of age. Eukaryot Cell, 2014, 13(10): 1256–1265.
[11] Nakao Y, Kanamori T, Itoh T, et al. Genome sequence of the lager brewing yeast, an interspecies hybrid. DNA Res, 2009, 16(2): 115–129.
[12] Xu WN. Study on the evaluation and mechanism of autolysis in lager brewer’s yeast[D]. Wuxi: Jiangnan University, 2014 (in Chinese).许维娜啤酒酵母自溶评价及机理研究[D]. 无锡: 江南大学, 2014.
[13] Ding HJ. Physiological and autolysis properties of brewer's yeast during passage [D]. Wuxi: Jiangnan University, 2018 (in Chinese).丁华建. 啤酒酵母在传代过程中的生理与自溶性能研究[D]. 无锡: 江南大学, 2018.
[14] Ding HJ, Duan HX, Wang JJ, et al. Comparison of physiological performance differences between two lager yeasts during serial re-pitching and autolysis. Food Ferment Ind, 2018, 44(10): 57–64 (in Chinese). 丁华建, 段鸿绪, 王金晶, 等. 两株lager啤酒酵母在传代及自溶过程中生理性能差异的比较. 食品与发酵工业, 2018, 44(10): 57–64.
[15] Martínez-Rodríguez AJ, Polo MC, Carrascosa AV. Structural and ultrastructural changes in yeast cells during autolysis in a model wine system and in sparkling wines. Int J Food Microbiol, 2001, 71(1): 45–51.
[16] Dodou E, Treisman R. Themads-box transcription factor Rlm1 is a target for the Mpk1 mitogen-activated protein kinase pathway. Mol Cell Biol, 1997, 17(4): 1848–1859.
[17] Orlean P. Architecture and biosynthesis of thecell wall. Genetics, 2012, 192(3): 775–818.
[18] Venters BJ, Wachi S, Mavrich TN, et al. A comprehensive genomic binding map of gene and chromatin regulatory proteins in. Mol Cell, 2011, 41(4): 480–492.
[19] Nuoffer C, Jenö P, Conzelmann A, et al. Determinants for glycophospholipid anchoring of theGAS1 protein to the plasma membrane. Mol Cell Biol, 1991, 11(1): 27–37.
[20] Eustice M, Pillus L. Unexpected function of the glucanosyltransferase Gas1 in the DNA damage response linked to histone H3 acetyltransferases in. Genetics, 2014, 196(4): 1029–1039.
[21] Niepel M, Molloy KR, Williams R, et al. The nuclear basket proteins Mlp1p and Mlp2p are part of a dynamic interactome including Esc1p and the proteasome. Mol Biol Cell, 2013, 24(24): 3920–3938.
[22] Kim KY, Truman AW, Caesar S, et al. Yeast Mpk1 cell wall integrity mitogen-activated protein kinase regulates nucleocytoplasmic shuttling of the Swi6 transcriptional regulator. Mol Biol Cell, 2010, 21(9): 1609–1619.
[23] Levin DE. Regulation of cell wall biogenesis in: The cell wall integrity signaling pathway. Genetics, 2011, 189(4): 1145–1175.
[24] Wang JJ, Li MQ, Zheng FY, et al. Cell wall polysaccharides: Before and after autolysis of brewer’s yeast. World J Microb Biot, 2018, 34: 137.
[25] Monerawela C, Bond U. Brewing up a storm: The genomes of lager yeasts and how they evolved. Biotechnol Adv, 2017, 35(4): 512–519.
[26] Baker E, Wang B, Bellora N, et al. The genome sequence ofand the domestication of lager-brewing yeasts. Mol Biol Evol, 2015, 32(11): 2818–2831.
[27] Ishihara S, Hirata A, Nogami S, et al. Homologous subunits of 1,3-beta-glucan synthase are important for spore wall assembly in. Eukaryot Cell, 2007, 6(2): 143–156.
[28] Martin-Yken H, Dagkessamanskaia A, Basmaji F, et al. The interaction of Slt2 MAP kinase with Knr4 is necessary for signalling through the cell wall integrity pathway in. Mol Microbiol, 2003, 49(1): 23–35.
Regulations ofgene affect the anti-autolytic ability of lager yeast
Jinjing Wang1,2, Mengqi Li1,2, Dan Hou1,2, Weina Xu1,2, Feiyun Zheng1,2, Chunfeng Liu1,2, Chengtuo Niu1,2, and Qi Li1,2
1 Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China 2 Laboratory of Brewing Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China
The autolysis of brewer’s yeast seriously affects the quality of beer and the quality of yeast is considered as one of the key factors in beer brewing. Previous studies on brewer’s yeast autolysis showed thatgene, an important transcription factor in cell integrity pathway, is closely related to the autolysis of yeast. In this study,was knocked out and overexpressed in a haploid brewer’s yeast.disruption resulted in poor anti-autolysis performance of yeast, whereas overexpression ofcontributed to the anti-autolytic ability of yeast. In addition,gene knockout affected the osmotic stress resistance, cell wall damage resistance, nitrogen starvation resistance and temperature tolerance of yeast strain. The transcriptional level ofinvolved in cell wall assembly and DNA damage response was regulated along with the expression of, whereas other genes in CWI pathway did not show apparent regularity.might mainly affect the expression ofso as to improve the stress resistance of lager yeast in harsh environment. The result from this study help further understand the mechanism of yeast autolysis and lay a foundation for breeding brewer’s yeast strain with better anti-autolytic ability.
lager yeast, anti-autolytic ability,, cell wall integrity
December 24, 2018;
February 28, 2019
National Natural Science Foundation of China (Nos. 31771963, 31571942).
Jinjing Wang. Tel/Fax: +86-510-85918176; E-mail: jjwang@jiangnan.edu.cn
国家自然科学基金 (Nos. 31771963,31571942) 资助。
2019-03-21
http://kns.cnki.net/kcms/detail/11.1998.Q.20190321.1053.001.html
10.13345/j.cjb.180530
王金晶, 李梦琦, 侯丹, 等. Lager啤酒酵母基因调控对其抗自溶性能的影响. 生物工程学报, 2019, 35(6): 1059–1070.
Wang JJ, Li MQ, Hou D, et al. Regulations ofgene affect the anti-autolytic ability of lager yeast. Chin J Biotech, 2019, 35(6): 1059–1070.
(本文责编 郝丽芳)

