人血管紧张素Ⅱ2型受体AT2R重组细胞系的构建与鉴定
陈惠莹,毛莹莹,裴娜娜,颜仁和,万鹏飞,李红卫
(1.南方医科大学 检验与生物技术学院, 广东 广州 510515; 2.暨南大学 附属第一医院 病理科, 广东 广州 510163;3. 广州伯尼兹生物科技有限公司, 广东 广州 510663)
前列腺癌是威胁当今老年男性健康的恶性疾病之一,在男性常见肿瘤中排第2位,同时也是癌症相关死亡的第5大常见原因[1].在中国,前列腺癌的发病率虽远低于西方国家,但近年前列腺癌早期诊断检查普及,检出率与发病率呈上升趋势,占泌尿系统肿瘤第2位[2].
肾素-血管紧张素系统(renin-angiotensin system, RAS)由肾素、血管紧张素转换酶、血管紧张素原和多种血管紧张素肽组成,是体内调节水、电解质、体液平衡和血压的重要激素系统.肾素催化血管紧张素原水解最终产生的血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)是RAS系统的主要效应分子,AngⅡ通过1型(angiotensin Ⅱtype 1 receptor, AT1R)和2型(angiotensin Ⅱtype 2 receptor, AT2R)受体结合而发挥生物学作用.近年研究发现AngⅡ在肿瘤发生发展中起关键的作用[3],当与AT1R结合时,会导致细胞增殖和迁移、血管生成进而引起肿瘤的生长与转移;与AT2R结合时,产生抑制肿瘤生长、诱导凋亡的作用[4-5].在大多数环境状态下,AT2R都表现出与AT1R相对立的效应.近年来,一种新型AT2R激动剂Compound 21(C21)为AT2R的研究提供了新的思路.C21是一种非肽类AT2R特异性激动剂,在体内外可与AT2R特异性结合发挥类似于AngⅡ的生理学效应[6].由于AT2R在大部分肿瘤细胞中的表达水平较低,且在前列腺癌和胰腺癌的研究结果中显示,随着肿瘤的发生发展,AT2R的表达水平显著降低[7],使C21在抗肿瘤中的应用受到限制,也使其他AT2R非特异性激动剂受到AT1R的干扰.
慢病毒载体是一种复制缺陷型反转录病毒载体,具有转染效率好、感染效率较高、基因表达稳定的特点.重组慢病毒可将携带的外源基因高效整合至宿主细胞基因组中,使外源基因在细胞内长期稳定表达[8].本研究在课题组前期研究基础上,构建人AT2R重组慢病毒表达载体,并感染PC-3、DU145细胞建立hAT2R过表达稳定细胞系,探讨C21等AT2R激动剂对前列腺癌的作用与机制,为探索C21作为新型前列腺癌治疗药物提供细胞模型与实验依据.
1 材料和方法
1.1 材料
1.1.1 实验材料
PC-3细胞株、DU145细胞株及pLV-CMV-IRES-eGFP质粒由南方医科大学生物治疗研究所保存.
1.1.2 试剂
感受态大肠杆菌DH5α购自北京天根生化科技有限公司;胶回收试剂盒、质粒提取试剂盒购自北京康润科技有限公司;NheI限制性内切酶、MluI限制性内切酶、T4 DNA连接酶均购自北京宝日医生物技术有限公司;RNAiso Plus、反转录试剂盒、高保真PCR酶PrimerSTAR、SYBR Premix Ex TaqTM 均购自Takara公司;聚醚酰亚胺(polyetherimide,PEI)、胎牛血清购自Sigma公司;DMEM、F-12k细胞培养基与青霉素-链霉素购自ThermoFisher公司;CCK-8细胞活力检测试剂盒购于日本同仁公司;抗兔AT2R一抗购于北京奥维亚生物技术有限公司;抗兔GAPDH一抗购于bioworld公司,HRP标记抗羊兔二抗为杭州弗德生物科技有限公司产品.
1.1.3 仪器设备
Veriti 96 well Thermal Cycler PCR仪购自Applied Biosystems;分光光度计购自Bio-rad;荧光显微镜购自OLYMPUS;5910型小型高速冷冻离心机购自Eppendorf公司;7500荧光定量PCR仪、凝胶成像仪、高速离心机购自ThermoFisher公司.
1.1.4 培养基
体积分数为10% FBS DMEM培养基:DMEM培养基中加入FBS至体积分数为10%,加入青霉素-链霉素细胞培养双抗至终体积分数为1%,混匀后于4℃保存备用;体积分数为10% FBS F-12k培养基:F-12k培养基中加入FBS至体积分数为10%,加入青霉素-链霉素细胞培养双抗至终质量浓度为1%,混匀后于4 ℃保存备用.
1.2 方法
1.2.1 目的基因及引物的设计与合成
根据GenBank中hAT2R基因序列合成目的基因序列,在5′及3′端分别加入NheI及MluI酶切位点,合成的hAT2R基因克隆至pUC57载体中.同时设计合成hAT2R引物序列Forward:5′-CGGAATTCATGAGCTGCGTTAATCC -3′,Reverse:5′-AACTGCAGTTAAGACACAAAGGTCTCCA-3′,以上目的基因及引物委托美吉生物科技有限公司合成.
1.2.2 载体质粒的构建
将pUC57-hAT2R和pLV-CMV-IRES-eGFP质粒用NheI和MluI双酶切,酶切产物经切胶回收得到目的基因hAT2R片段和pLV-CMV-IRES-eGFP载体大片段,用T4 DNA连接酶将回收的目的片段与载体连接并转化至E.coli DH5α感受态,挑取单克隆菌落并提取质粒.获得含有目的基因hAT2R的重组质粒命名为pLV-CMV-hAT2R-IRES-eGFP.重组质粒经酶切及测序鉴定.
1.2.3 重组表达载体的转染
使用PEI转染法将慢病毒载体质粒pLV-CMV-IRES-eGFP和含有目的基因的慢病毒载体连接质粒pLV-CMV-hAT2R-IRES-eGFP分别转染至HEK293T细胞,同时将正常培养的293T细胞作为对照,分别在转染后24、48、72 h使用荧光显微镜观察目的蛋白在细胞内表达情况.
1.2.4 慢病毒载体包装、纯化、浓缩及滴度测定
采用三质粒共转染系统,将鉴定正确的慢病毒重组质粒与慢病毒包装所必须的辅助质粒psPAX2和VSVG共转染至HEK293T细胞.转染细胞使用完全培养基在37 ℃,体积分数为5% CO2细胞培养箱中培养48 h后收集细胞上清液并纯化.纯化后病毒液经10 KD浓缩柱离心浓缩至5 mL.使用RT-PCR法测定病毒滴度,并于-80 ℃保存.
1.2.5 建立hAT2R稳定过表达细胞系
选择生长状态良好的PC-3及DU145两株前列腺癌细胞1.00×106/孔均匀铺于6孔板中,置入37 ℃,体积分数为5% CO2细胞培养箱培养24 h.第2天,去除孔内原培养基,以MOI=1 000加入pLV-CMV-hAT2R-IRES-eGFP病毒液,同时加入聚凝胺(polybrene)使其终质量浓度为8 mg/L,将6孔板放入37 ℃,体积分数为5% CO2环境中培养24 h后更换新鲜的完全培养基继续培养3~5 d,观察细胞荧光情况.使用细胞流式分选法将感染细胞分选并接种于96孔板,培养10 d后挑选96孔板中仅含有1个细胞团的荧光细胞孔即单克隆细胞株,将其传代并扩大培养,获得稳定表达绿色荧光的单克隆细胞系分别命名为PC-3-hAT2R、DU145-hAT2R.
1.2.6 RT-PCR检测hAT2R的基因表达
用RNAiso Plus提取PC-3-hAT2R、DU145-hAT2R细胞总RNA,紫外分光光度仪测得RNA浓度.以每反应体系1 μg加入RNA,按逆转录试剂盒说明步骤进行逆转录操作获得cDNA.以β-actin作为内参,使用SYBR Green法检测目的基因表达.同时设立未转染细胞组作为阴性对照.
1.2.7 Western blot检测重组细胞系hAT2R的蛋白质水平表达
使用RIPA细胞裂解液分别提取PC-3、DU145及PC-3-hAT2R、DU145-hAT2R细胞总蛋白质,以GAPDH作为内参蛋白,免疫印迹法检测各组细胞中AT2R表达量,蛋白质条带灰度分析使用ImageJ软件进行.
2 结果
2.1 pLV-CMV-eGFP-hAT2R载体构建及鉴定结果
将hAT2R基因克隆至慢病毒表达载体质粒pLV-CMV-IRES-eGFP中,NheI及MluI双酶切重组质粒pLV-CMV-hAT2R-IRES-eGFP质粒鉴定,琼脂糖凝胶电泳结果(图1),小片段与原始目的基因质粒片段相同,约为1 200 bp左右,符合预期,且大片段与原始载体酶切片段相同.PCR鉴定获得130 bp左右片段(图2).质粒测序鉴定无突变.以上结果证明目的基因慢病毒载体连接质粒pLV-CMV-hAT2R-IRES-eGFP构建成功.

M:DL2000DNA 标记物;1:pLV-CMV-IRES-eGFP;2:pUC57-hAT2R-kana/(NheI &MluI);3~8:pLV-CMV-hAT2R-IRES-eGFP/(NheI&MluI).
M:DL2000DNA marker; 1:pLV-CMV-IRES-eGFP;2:pUC57-hAT2R-kana/(NheI&MluI);3~8:pLV-CMV-hAT2R-IRES-eGFP/(NheI&MluI).
图1pLV-CMV-hAT2R-IRES-eGFP的酶切鉴定结果
Fig.1 Restrction enzyme digestion analysis ofpLV-CMV-hAT2R-IRES-eGFP
M:DL2000DNA 标记物;1~3:pLV-CMV-hAT2R-IRES-eGFP.
M:DL2000DNA marker;1~3:pLV-CMV-hAT2R-IRES-eGFP.
图2pLV-CMV-hAT2R-IRES-eGFPPCR鉴定结果
Fig.2 Agarose gel electrophoresis analysis ofhAT2Ramplified by PCR
2.2 重组质粒转染293T细胞荧光表达情况
将慢病毒载体质粒pLV-CMV-IRES-eGFP与目的基因慢病毒载体连接质粒pLV-CMV-hAT2R-IRES-eGFP分别转染HEK293T细胞,并与未转染的293T细胞进行对照,转染后24、48、72 h在荧光显微镜下观察荧光表达(图3).RT-PCR检测转染细胞hAT2R表达(图4).结果证明慢病毒质粒转染成功,目的基因蛋白在细胞内高效表达.
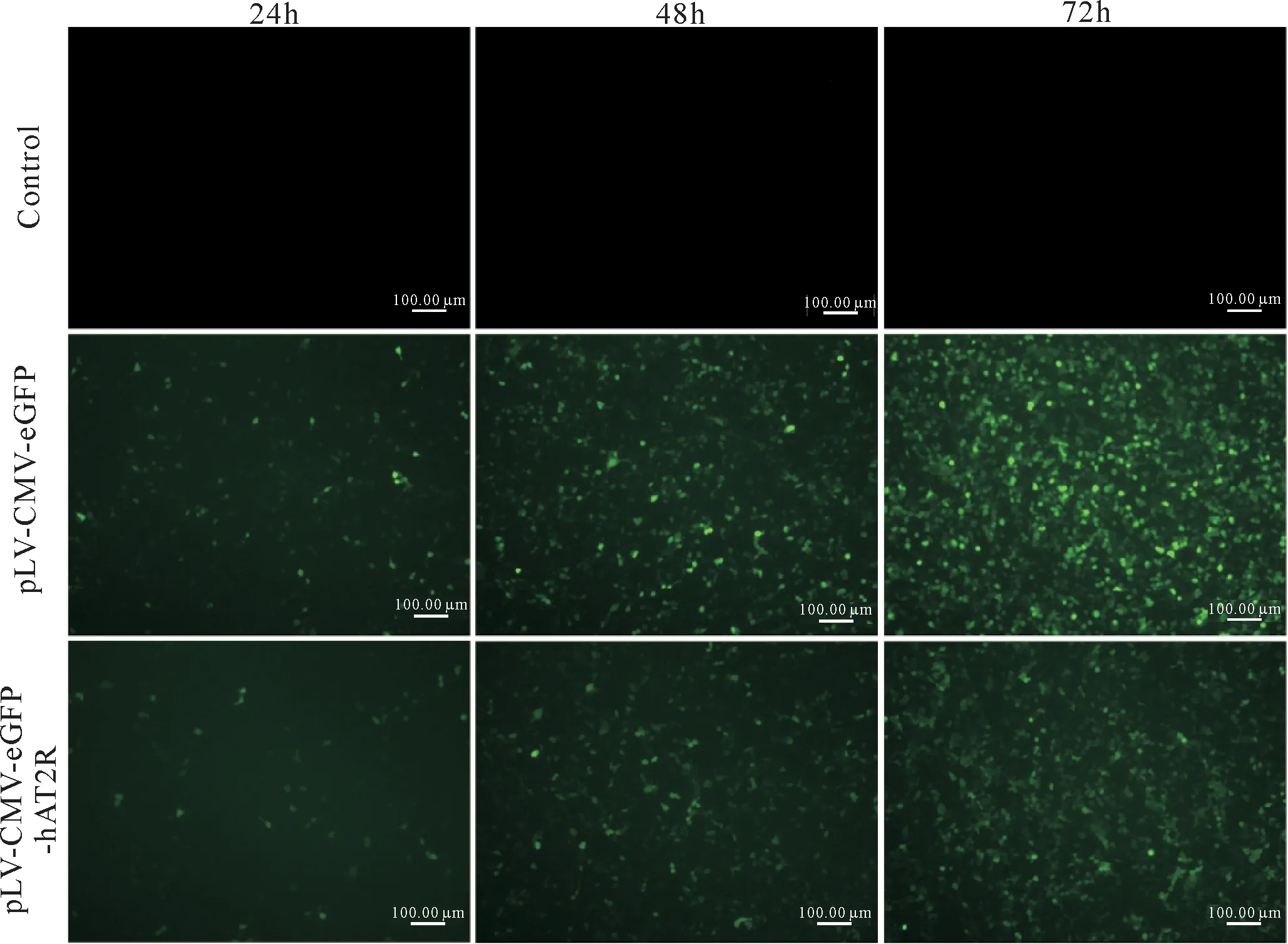
图3 质粒转染HEK293T细胞24、48、72 h荧光
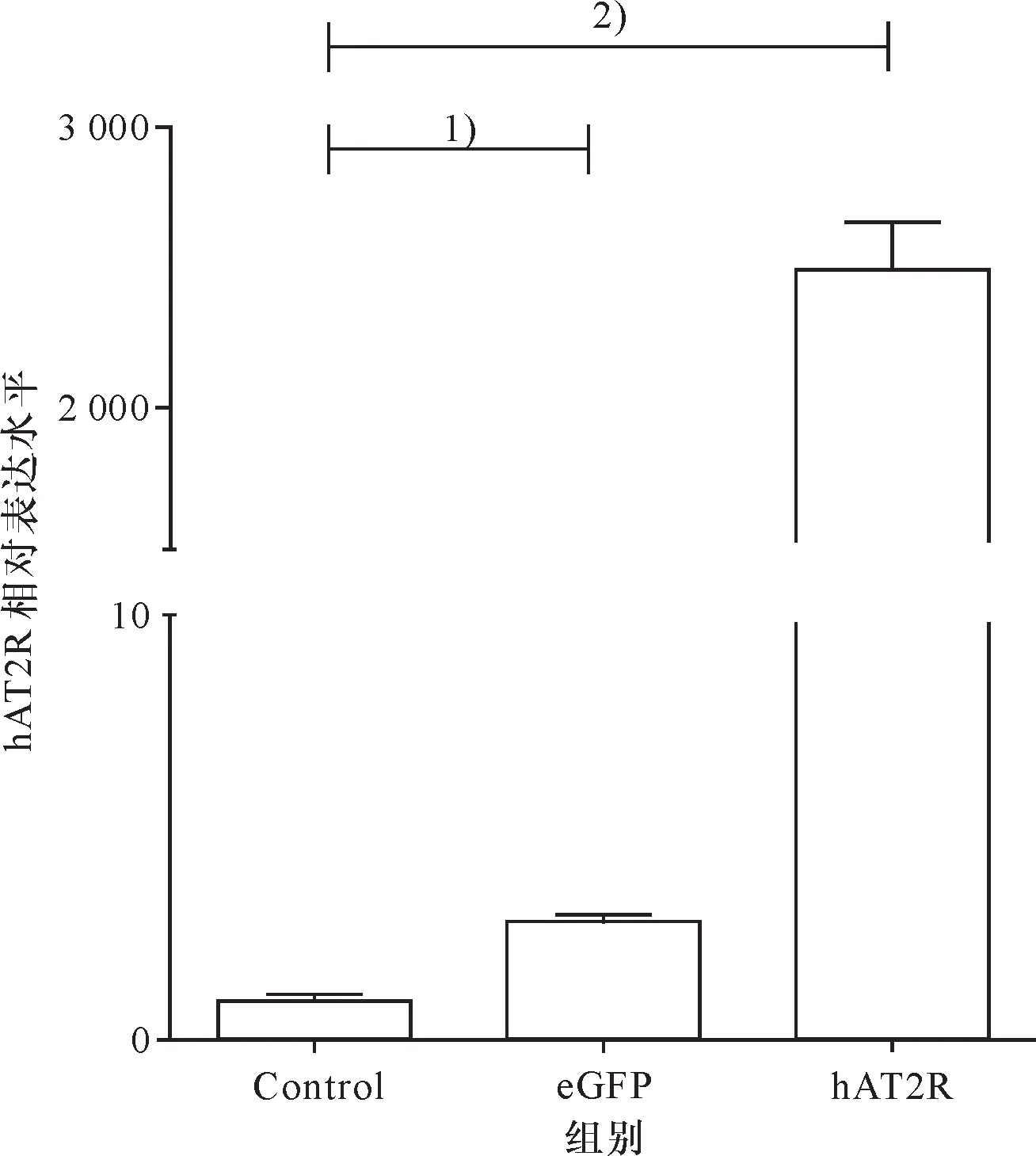
对照组:HEK293T cell;eGFP:plv-CMV-IRES-eGFP;hAT2R:pLV-CMV-hAT2R-IRES-eGFP.1)对照组与eGFP组无差异;2)eGFP组与hAT2R组差异显著,P≤0.01.
Control:HEK293T cell; eGFP:plv-CMV-IRES-eGFP; hAT2R:pLV-CMV-hAT2R-IRES-eGFP.1)No difference between the control group and the eGFP group; 2) difference between the eGFP group and the hAT2R group,P≤0.01.
图4 RT-PCR检测质粒转染HEK293T细胞hAT2R表达
Fig.4 Detection of hAT2R expression in HEK293T cells by RT-PCR
2.3 单克隆细胞系的构建
选择两株前列腺癌细胞PC-3及DU145细胞,以MOI=1 000感染48 h后,使用细胞流式分选技术将成功表达绿色荧光的细胞分选至96孔培养板中,每孔1个细胞.培养10 d后,荧光显微镜下观察96孔板细胞,每株细胞各挑选5个荧光强度较强的阳性单克隆(图5),并扩大培养于6孔板中.最终挑选生长状态好的阳性单克隆持续传代至30代并保存,分别命名为PC-3-hAT2R、DU145-hAT2R.
2.4 重组细胞系hAT2R的表达水平检测
在重组细胞系传代培养至第30代时,收集细胞,RNAiso Plus试剂提取细胞总RNA,同时提取未感染细胞总RNA,逆转录获得cDNA,使用RT-PCR检测目的基因hAT2R表达.重复3次所得结果进行统计学分析(图6).重组细胞系PC-3-hAT2R中hAT2R基因表达是未转染细胞的789倍,DU145-hAT2R中hAT2R基因表达是未转染细胞的621倍,有统计学差异.同时分别提取PC3、DU145细胞及两株重组细胞系细胞总蛋白质,使用Western blot法检测hAT2R蛋白质水平表达(图7),重组细胞系中目的基因蛋白质表达水平显著升高.

A1~5: PC-3-hAT2R单克隆白光;B1~5: PC-3-hAT2R单克隆荧光;C1~5: DU145-hAT2R单克隆白光;D1~5: DU145-hAT2R单克隆荧光
A1~5: bright-field image of PC-3-hAT2R; B1~5: fluorescence of PC-3-hAT2R; C1~5: bright-field image of DU145-hAT2R; D1~5:fluorescence of DU145-hAT2R.
图5 阳性单克隆细胞图
Fig.5 Monoclonal cell of PC-3-hAT2R and DU145-hAT2R

1)PC-3-hAT2R组较PC-3组hAT2R基因表达水平显著上升,P≤0.05;2)DU145-hAT2R组较DU145组hAT2R基因表达水平显著上升,P≤0.05.
1)Significantly difference between thePC-3-hAT2Rgroup and the PC-3 group,P≤0.05; 2)significantly difference between theDU145-hAT2Rgroup and the DU145 group,P≤0.05.
图6 RT-PCR检测重组单克隆细胞系hAT2R表达
Fig.6 Detection of hAT2R expression in recombinant monoclonal cell line by RT-PCR
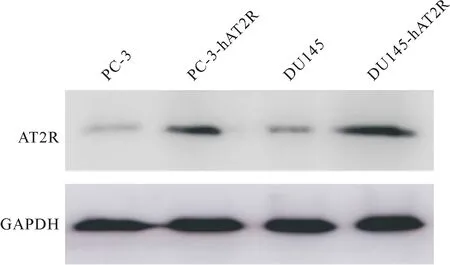
图7 Western blot检测重组单克隆细胞系hAT2R蛋白水平表达
Fig.7 Detection of hAT2R expression in recombinant monoclonal cell line by Western blot
2.5 重组细胞系hAT2R受体功能检测
使用浓度为10 μmol/L AT2R激动剂CGP42112分别处理PC-3、DU145细胞及PC-3-hAT2R、DU145-hAT2R重组细胞系,24 h后用CCK-8法检测细胞活力,两株细胞检测结果显示,与PC-3、DU145细胞相比重组细胞系PC-3-hAT2R、DU145-hAT2R细胞存活率明显下降,同时统计分析结果,PC-3、DU145细胞经CGP42112处理后,细胞呈明显增殖趋势(图8).
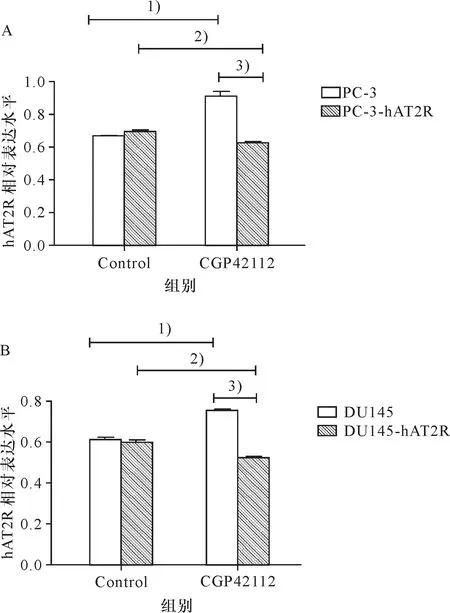
A:1)PC-3细胞中,CGP42112组与对照组比较,细胞活力升高,P≤0.05;2) PC-3-hAT2R细胞中,CGP42112组较对照组细胞活力降低,P≤0.05;3)CGP42112处理后,PC-3-hAT2R组较PC-3组细胞活力显著降低,P≤0.05.
B:1)DU145细胞中,CGP42112组与对照组比较,细胞活力升高,P≤0.05;2) DU145-hAT2R细胞中,CGP42112组较对照组细胞活力降低,P≤0.05;3)CGP42112处理后,DU145-hAT2R组较DU156组细胞活力显著降低,P≤0.05.
A:1)PC-3 cell: control and CGP42112-treated,P≤0.05;2) PC-3-hAT2R cell: control and CGP42112-treated,P≤0.05;3) CGP42112-treated: PC-3-hAT2R cell and PC-3 cell,P≤0.05.
B:1)DU145 cell: control and CGP42112-treated,P≤0.05;2) DU145-hAT2R cell: control and CGP42112-treated,P≤0.05;3) CGP42112-treated: DU145-hAT2R cell and DU145 cell,P≤0.05.
图8 CCK-8法检测CGP42112处理24 h后各组细胞活力
Fig.8 Detection of cell viability in CGP42112-treated cells by CCK-8
3 讨论
AngⅡ的两种受体AT1R和AT2R是具有30%相似序列的跨膜糖蛋白[9].其中AT2R是胚胎时期AngⅡ的主要受体,调节胚胎期组织、器官的分化和发育,出生后表达量显著下降,仅在机体的大脑某些区域、肾上腺、心脏、肾脏某些结构及子宫肌层和卵巢等特定器官表达,且表达量较低,使AT2R的相关研究受限.现阶段研究显示,与AT1R的有害性相反,AT2R是RAS的保护性分支,且常常与AT1R相拮抗,可能是机体的一种内源性保护机制[10].近年来,AT1R在多种肿瘤中的促细胞生长、血管生成和加速恶性转化的作用已得到证实,而其拮抗剂则表现为抑制肿瘤生长、转移[11].AT2R与AT1R相对立的效应使其作为肿瘤治疗的新靶点也获得越来越多的关注.已有研究发现,AT2R在前列腺癌细胞、膀胱癌细胞和肺癌细胞中表现出抑制细胞增殖并诱导凋亡,可能与AT2R内源性表达导致细胞程序性死亡相关[12].
新型非肽类AT2R激动剂C21,由一种非选择性AT1R/AT2R激动剂L-162,313改造而来,对AT2R的Ki值(浓度为0.4 nmol/L)远远小于对AT1R的Ki值(浓度大于10 μmol/L),可特异性激活AT2R[13].已有大量研究证实,C21与AT2R结合能够有效发挥的生物学效应包括抗炎、缓解胰岛素抵抗、降低氧化应激、舒张血管、抵抗血管和心肌纤维化、保护神经元等[14-15].C21作为一种新型AT2R激动剂,在治疗肺纤维化的研究已经入一期临床实验[15].此外,CGP42112以及肽类AT2R激动剂AngⅡ也常用于AT2R的研究[16].AngⅡ与AT1R和AT2R均可结合发挥作用,导致其激活AT2R的特异性较差.有研究指出CGP42112对AT2R的激活位点与AngⅡ并不完全相同,其功能不能完全被AT2R拮抗剂PD123319抑制[17-18],因此CGP42112激活AT2R的特异性也较低,所以,使用CGP42112处理PC-3、DU145细胞24 h后表现促细胞增殖作用,可能激活了AT1R所致.具有高特异性的新型AT2R激动剂C21能否用于前列腺癌的治疗,以及其激活AT2R在前列腺肿瘤细胞中的作用及其机制仍有待探究.
本研究利用人AT2R作为目的基因,构建慢病毒表达载体.慢病毒是目前分子及细胞生物实验中十分高效的工具,在基因重组方面有着许多独特的优势,相比于其他逆转录病毒,慢病毒的可感染宿主广泛,对于一些较难感染的细胞也可有较高的转导效率,可携带5kb,甚至更长的目的基因序列,并能够将目的基因整合入宿主细胞基因,使目的基因在靶细胞中获得持续高效稳定表达[19-20].本研究在使用慢病毒重组质粒成功转染293T细胞的基础上,选取两株前列腺癌细胞构建hAT2R基因过表达细胞系,并使用RT-PCR定量检测及Western blot分别检测重组细胞系中目的基因hAT2R在基因及蛋白质水平的表达,同时使用CGP42112检测了重组细胞系的受体功能,检测结果证明重组细胞系构建成功,PC-3-hAT2R、DU145-hAT2R两株重组细胞系为进一步研究C21及非特异性AT2R激动剂对前列腺癌细胞的作用及其机制提供了可靠便捷的工具.
综上,本研究成功构建了hAT2R过表达稳定细胞系,为研究AT2R激动剂C21等对前列腺癌的作用及机制提供实验基础.

