肠型与弥漫型胃癌中Sonic hedgehog与Wnt3A/β-catenin的表达
刘先勇, 王建宁, 仇伟, 李加虎, 周宇, 王玉红, 张若梅, 孟春芹
(南京医科大学附属江宁医院 1.中西医结合科, 2.消化内科, 3.病理科, 4.内镜室, 5.中心实验室, 江苏 南京 211100)
劳伦(Lauren)分型[1]把胃癌分为肠型和弥漫型.肠型胃癌(intestinal-type gastric cancer,IGC)的科雷亚(Correa)级联反应[2]序贯发生正确性已被证实[3],但此进程的分子生物学机制仍不明晰;在弥漫型胃癌(diffuse-type gastric cancer, DGC)发病机制的研究中,除E-钙黏蛋白(E-cadherin,CDH1)的基因突变致遗传性DGC发病外,其他获得的研究成果让人失望[4].音猬因子(sonic hedgehog,Shh)信号通路与经典的Wnt信号通路类似,不仅能促进胃的胚胎发育,为稳定胃腺体内环境所必需[5],也与胃癌的发病关系密切.在国内外研究Shh、Wnt3A/ β连环蛋白(β-catenin)在胃癌中表达特点的报道中,多未把胃癌区分为IGC和DGC[6-8],在少有的区分了IGC[9]或DGC[10]的文献中,鲜有研究二者在两种胃癌中表达的相关性.本研究旨在探讨蛋白Shh、Wnt3A/β-catenin及分泌型卷曲相关蛋白-1(secreted frizzled-related protein-1,Sfrp1)在IGC和DGC中表达特点及相关性,探讨这两种胃癌发病的分子机制.
1 材料与方法
1.1 诊断标准
按Lauren病理分型严格区分IGC和DGC[1],IGC选取腺管结构明显的高、中分化腺癌,对于腺管不明显的低分化腺癌则不予入选.DGC选择癌细胞散在分布、无或极少腺体形成的标本.黏液腺癌若腺体明显,则归属IGC,若以印戒细胞癌为主则归属DGC.剔除混合型胃癌.
1.2 标本选择
随机选取114例2015年11月至2018年12月于南京医科大学附属江宁医院内镜室和病理科获得的慢性浅表性胃炎(chronic superficial gastritis,CSG;作为对照组)、DGC及IGC的病理标本.其中30例CSG患者年龄35~76岁,男18例,女12例,平均年龄(55.867±9.975)岁;42例IGC患者年龄40~80岁,男26例,女16例,平均年龄(65.097±13.505)岁;42例DGC患者年龄35~78岁,男28例,女14例,平均年龄(55.561±11.384)岁.3组间年龄比较有统计学差异(F=8.165,P<0.001).IGC患者年龄较DGC、CSG患者年龄大,组间比较有统计学差别(P<0.001).各组间性别分布无统计学差异(P>0.05).
1.3 主要试剂与仪器
兔抗人Shh、Wnt3A、β-catenin一抗均购自美国Abcam公司.蛋白免疫印迹实验中使用的电泳仪及显影仪分别购自美国Bio-Rad公司以及ProteinSimple公司.
1.4 方法
1.4.1 免疫组织化学方法
使用免疫组化Max Vision法检测3组标本中Shh、Wnt3A/β-catenin及 Sfrps1蛋白的表达情况.具体步骤按照相关说明书进行操作.以PBS代替一抗作为空白对照.
1.4.2 蛋白免疫印迹试验(Western blotting)分析
于3组标本中加入蛋白裂解液按步骤提取总蛋白.采用聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)法检测蛋白浓度.分别上样体积10 μL蛋白进行聚丙烯酰胺凝胶(SDS-PAGE,体积分数为10%)电泳,电泳后将蛋白湿法转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上.将膜置于质量分数为5%脱脂奶粉中室温封闭1 h,加入一抗4 ℃孵育过夜.洗膜缓冲液(tris buffered saline Tween,TBST)洗膜后加入二抗室温孵育.再次洗膜后加入显影剂,上机检查进行条带分析,定量检测各组蛋白表达水平.β-actin 作为内参.重复3次.
1.4.3 染色评估方法
蛋白阳性胞膜、胞质或胞核中出现淡黄、棕黄色或棕褐色颗粒.具体参考本课题组相关标准等[11]判别方法:在高倍镜下(×200)观察每个标本的5个随机选择的视野.①染色强度半定量分级:无色为0分,淡黄为1分,棕黄为2分,棕褐为3分.②细胞阳性百分比评分: 0分(阳性率<1%),1分(1%≤阳性率<30%),2分(30%≤阳性率<50%),3分(阳性率≥50%).两项积分相乘获得蛋白的表达分数:0~1为阴性(-),2~4为弱阳性(+),5~8为阳性(++),9~12为强阳性(+++);阳性标准≥2分.
1.4.4 统计学方法
采用SPSS 16.0软件进行统计学分析,计量资料符合正态分布时采用单因素方差分析;非正态性数据采用秩和检验(多组间比较采用Kruskal-Wallis检验);等级资料相关性采用Spearman进行分析,以P<0.05为有统计学差异.
2 结果
2.1 Shh蛋白在3组中的表达
2.1.1 免疫组织化学法检测Shh蛋白在3组中的表达
Shh主要表达在细胞浆、细胞膜.在CSG中Shh多阳性或强阳性表达(图1A、表1);在IGC中,Shh大部分表达减少,呈弱阳性表达,部分甚至不表达(图1B、表1),但也有极少数强表达;在DGC中,Shh多呈强阳性表达(图1C、表1).3组之间的表达有统计学差异(Kruskal-Wallis检验H=46.064,P<0.001).与CSG组比较,Shh在IGC组表达显著减少(P<0.001),但在DGC组表达显著增加(P<0.05);与IGC组比较,Shh在DGC组表达显著增强,组间比较有显著统计学差异(P<0.001).
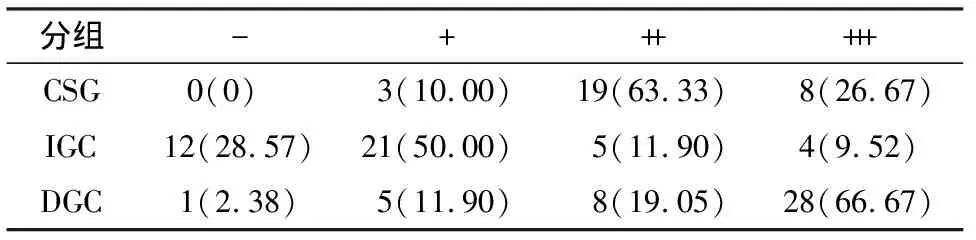
表1 Shh蛋白在3组中表达的比较
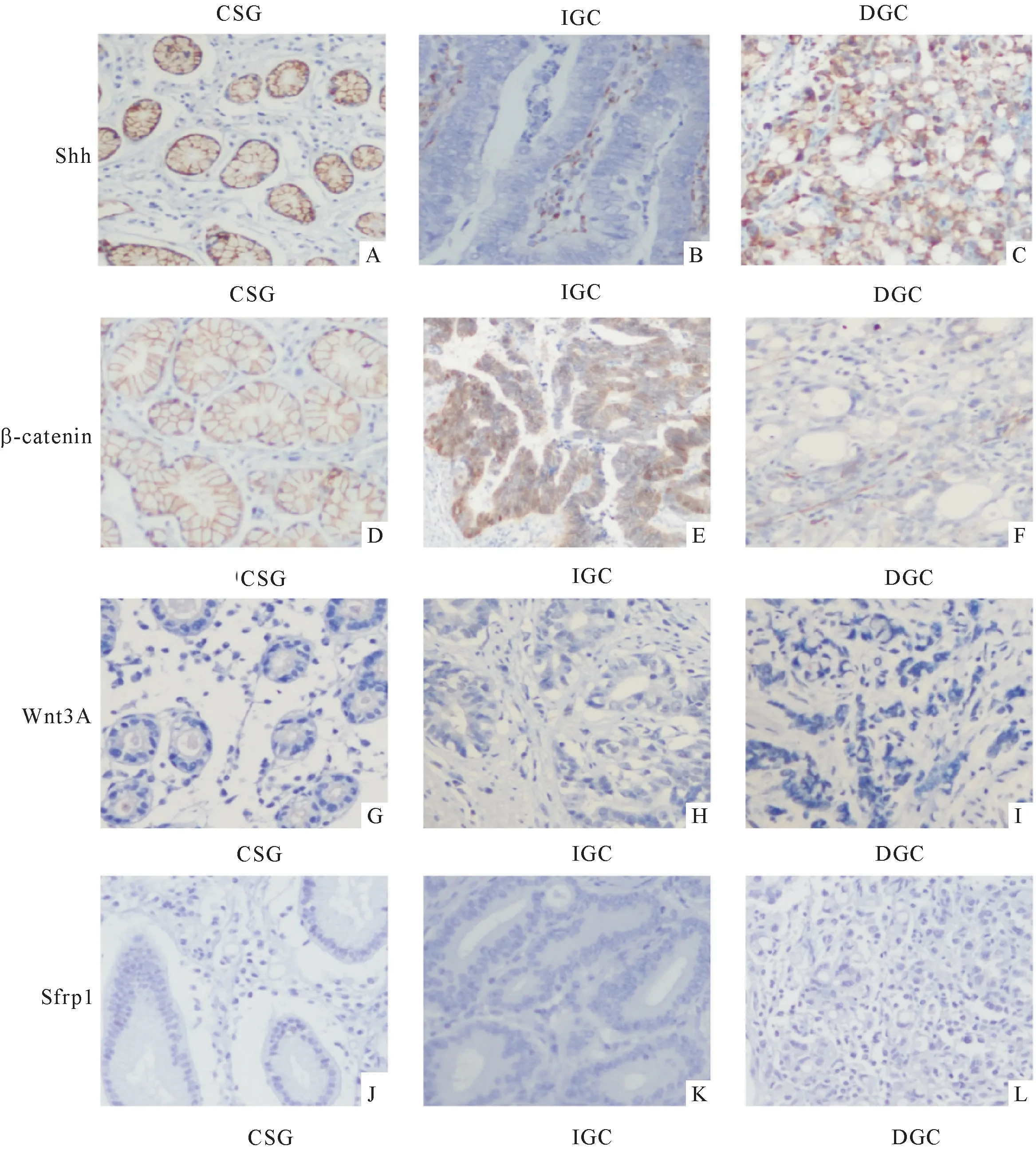
图1 免疫组织化学法检测Shh、Wnt3A/β-catenin及Sfrp1在3组中表达情况(×200)
2.1.2 Western blotting法检测Shh蛋白在3组中的表达
Shh在3组之间的表达有统计学差异(F=739.731,P<0.001).与CSG组比较,Shh蛋白在IGC组表达水平显著减少,但在DGC组表达水平显著增高;与DGC组比较,Shh蛋白在IGC中表达水平显著降低.两组间比较均有显著统计学差异(P<0.001,图2).
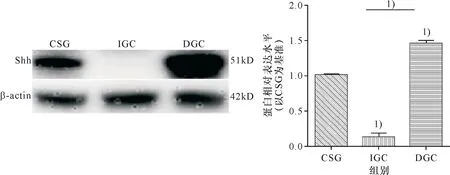
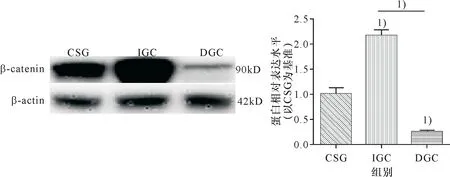
1)IGC组、DGC组与CSG组比较,P<0.001;IGC组与DGC组比较,P<0.001.
1)IGCgroup and DGCgroup were compared with CSG group,P<0.001; IGC group was compared with DGC group,P<0.001.
图2 Western blotting法检测Shh蛋白在3组中表达水平
Fig.2 Western blotting to detect the expression of Shh protein in three groups
2.2 β-catenin蛋白在3组中的表达
2.2.1 免疫组化法检测β-catenin在CSG及IGC中的定位表达
在CSG中,可以明显观察到β-catenin主要表达在细胞膜,细胞质不染色或局部淡染,胞核一般不染色(图1D);在IGC中,可见明显的胞质、胞核异位表达(图1E).
2.2.2 免疫组化法检测β-catenin在3组中的表达
β-catenin在3组之间的表达有统计学差异(Kruskal-Wallis检验H=38.629,P<0.001).与CSG组比较,β-catenin在IGC组表达水平显著增高,组间比较有显著统计学差异(P<0.05)(图1E,表2);与CSG组比较,β-catenin在DGC组表达显著减少,组间比较有显著统计学差异(P<0.001).β-catenin在一些DGC中甚至不表达(图1F、表2).与DGC组比较,β-catenin在IGC组表达显著增强,组间比较有显著统计学差异(P<0.001).
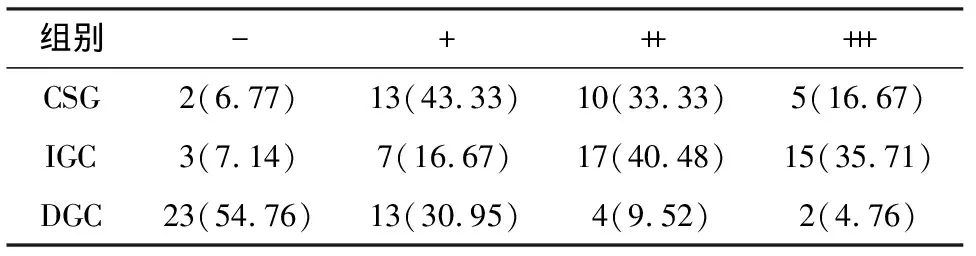
表2 免疫组织化法检测β-catenin蛋白在3组中表达的比较
2.2.3 Western blotting法检测β-catenin在3组中的表达
β-catenin在3组之间的表达有统计学差异(F=253.540,P<0.001).与CSG组比较,β-catenin蛋白在IGC组表达水平显著增高,组间比较有显著统计学差异(P<0.001);与CSG组比较,β-catenin蛋白在DGC组表达水平显著降低,组间比较有显著统计学差异(P<0.001);与DGC组比较,β-catenin蛋白在IGC组表达水平显著增高,组间比较有显著统计学差异(P<0.001).
2.3 Wnt3A与Sfrp1在3组中的表达特点
Wnt3A(图1G~I)与Sfrp1(图1J~L)在3组中多不表达.
2.4 Shh蛋白与β-catenin蛋白在3组中表达的相关性
Shh与β-catenin在CSG中表达呈负相关(r=-0.365,P<0.005);Shh与β-catenin在IGC、DGC中表达呈负相关(r=-0.507,P<0.001、r=-0.747,P<0.001).
3 讨论
IGC的Correa级联反应,主要包括CSG→慢性萎缩性胃炎(chronic atrophic gastritis,CAG)伴肠上皮化生(intestinal metaplasia, IM)→IGC.在此发展进程中,形态发生素Shh发生了深刻的变化.Shh可由胃上皮细胞和壁细胞分泌,不仅精准调节胃的病理生理[5],且为胃腺体分化的核心蛋白[12].在CSG中,Shh蛋白广泛地表达在胃腺体中.在CAG及IM中,研究表明[11-12]:Shh蛋白表达显著减少.在IGC中,本试验结果提示:Shh低表达,有一些甚至不表达,这与Lee等[13-14]研究结果不同,但与Fukaya等[15]研究结论一致.Shh在Correa级联反应中的这一变化可能导致了相关信号传导失调,进而引起了胃腺体分化障碍,参入IGC发病的早期阶段[16].Shh在DGC中表达的研究国内外报道并不多见,Lee等[14]研究认为:Shh 在IGC中表达比在DGC中更强,这与本次研究结果不同,本次研究结果提示,Shh在DGC中表达显著增多,与Fukaya等[15]研究结论类似.DGC可能源于胃干细胞[17]或骨髓源间充质干细胞[5],后者可过表达Shh蛋白[12,18]导致Shh信号通路的异常激活,参与DGC发生发展进程[12].
1)IGC组、DGC组与CSG组比较,P<0.001;IGC组与DGC组比较,P<0.001.1)IGCgroup and DGCgroup were compared with CSG group, P<0.001; IGC group was compared with DGC group, P<0.001.
经典的Wnt信号通路异常激活可导致细胞癌变,致癌常由Wnt3A等分泌性糖蛋白异常表达触发[19],实验中观察到:Wnt3A在IGC及DGC及正常胃黏膜中多无表达,说明Wnt3A虽为经典的Wnt信号通路中的重要蛋白,对细胞的分化成熟有重要作用,但并未作为分泌蛋白参与胃癌进程.β-catenin为经典的Wnt信号通路中重要的多功能蛋白,不仅是重要的转录调节因子,也参与调节细胞间的黏附[20].在CSG中,β-catenin主要表达在胃黏膜细胞膜上,发挥细胞间的黏附作用,肠表型胃癌伴随着胞膜的β-catenin向胞质/胞核异位变化[20],并伴β-catenin蛋白水平表达明显增加.而β-catenin蛋白在DGC中显著减少,有一些甚至不表达.这与之前的报道:“在IGC中,β-catenin细胞核表达和mRNA 水平升高比在DGC中更常见”相似[9,21].
本研究发现,Shh和β-catenin在IGC及DGC中表达呈负相关.在IGC中,伴随Shh的减少,β-catenin出现核异位,同时表达增多.究其原因可能是Shh的减少引起E-钙黏蛋白表达的减少,进一步导致β-catenin向胞核的移位激活经典Wnt信号通路[18,22].在DGC中,Shh表达增多,β-catenin表达减少,有一些甚至不表达.理论上讲,Shh信号作用于Wnt信号通路上游,可通过增加Sfrp1的转录水平,进而减少了β-catenin核表达,负调节Wnt信号活性[23].但实验中,这种推测未被证实.
Yanai等[6]较早观察到Shh和Wnt两个信号通路相互作用,形成一个调节环[23].胃腺体中或存在Shh-Wnt信号通路动态平衡机制[12,24],二者平衡失调可能在胃癌相关过程中发挥至关重要的作用[23],与IGC及DGC发病有密切关系.从CSG到IGC发展进程中,Shh减少,可能打破了Shh与Wnt两个信号通路在胃腺体中的动态平衡,β-catenin表达水平增高,且部分从细胞膜转移至细胞核表达,激活了经典Wnt通路导致了IGC发生;从CSG到DGC发展进程中,伴随Shh表达显著增多,可能导致Shh信号通路异常激活与DGC发病密切相关.虽然Sfrp1是Shh和Wnt两个信号通路相互作用的重要交叉点[23],但蛋白Shh和β-catenin在IGC及DGC中表达呈负相关,与Sfrp1表达水平与无关.

